盐酸多柔比星脂质体临床应用安全性评价*
尹金妥,李路亚,孟 萌,梁 平,白 靖,冯 锐
(河北医科大学第四医院药学部,河北 石家庄 050000)
多柔比星属蒽环类抗肿瘤抗生素,可嵌入DNA碱基对,干扰转录过程和阻止核糖核酸(RNA)合成,从而起到抗肿瘤作用[1]。盐酸多柔比星脂质体注射液适用于艾滋病相关卡波氏肉瘤(AIDS-KS)的治疗,亦可作为一线全身化学药物治疗(简称化疗)药物,或用作治疗病情有进展的AIDS - KS 二线化疗药[2],其在恶性肿瘤诊疗规范中推荐可用于卵巢癌、晚期乳腺癌、淋巴瘤、骨肉瘤和软组织肉瘤的治疗[3-5]。虽然该药上市以来时有药品不良反应(ADR)的报道[3,6-7],但多为单一ADR 报告。本研究中收集2016 年至2020 年我院78 例盐酸多柔比星脂质体注射液ADR 报告,根据ADR 评价原则[8],对其进行整理分析,以期为临床合理用药提供参考。现报道如下。
1 资料与方法
1.1 资料来源
自2016 年以来,我院ADR 报告表共记录盐酸多柔比星脂质体注射液ADR 病例78 例,ADR 判定标准为《药品不良反应判定标准》[8-9]。
1.2 方法
统计并分析盐酸多柔比星脂质体注射液ADR 报告中患者的临床诊断、病史、药物食物过敏史、性别年龄,该药用法用量、联合用药,ADR 的临床表现、发生时间、治疗措施及转归。
2 结果
2.1 临床诊断
78例ADR中,临床诊断最多的为卵巢癌,其次为乳腺癌,详见表1。除2019 年的1 例双下肢静脉血栓患者外,其他临床诊断均符合该药适应证。
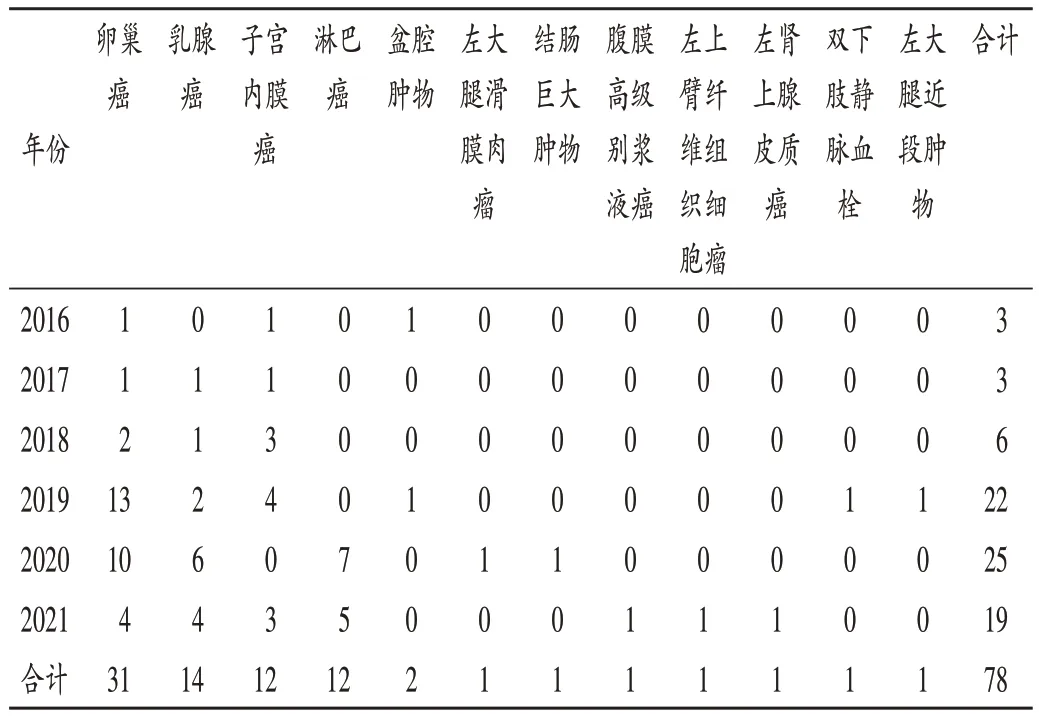
表1 患者临床诊断情况(例,n=78)Tab.1 Clinical diagnosis of patients(case,n=78)
2.2 病史及有创操作史
2.2.1 传染病史及慢性疾病史
2016 年、2017 年和 2021 年的 ADR 中,患者均无传染病史;2018 年、2019 年、2020 年分别有 1 例、1 例、3 例有传染病史。慢性疾病史以高血压史和糖尿病史较多见。详见表2。因同一患者可能患有多种慢性病,故实际慢性病例数可能多于年度ADR报告数。

表2 患者病史情况(例)Tab.2 Medical history of patients(case)
2.2.2 外伤、手术及输血史
结果表2。其中外伤史为腿外伤、左肱骨粉碎性骨折、左锁骨断裂、右尺桡骨骨折;手术史涉及卵巢切除术、子宫切除术、乳房(左乳、右乳、双乳)切除术、剖宫产术、绝育术、异位妊娠(宫外孕)手术、阑尾炎手术、疝气手术、双侧扁桃体切除术、腹腔肿物切除术、左臀部脂肪瘤切除术、结肠巨大肿物切除术、直肠癌根治术,膝关节置换术、右肺下叶切除术、房间隔修补术、眼科手术等。
2.3 药物及食物过敏史
结果见表2。过敏药物2016 年至2018 年均为紫杉醇注射液;2019 年分别为地塞米松、强的松、左氧氟沙星、紫杉醇注射液、磺胺类药物、头孢菌素类药物、青霉素及阿莫西林胶囊,2020 年为青霉素、阿莫西林、头孢菌素类药物及双黄连,2021 年为青霉素、甲硝唑、头孢甲肟、溴己新及磺胺类药物。
2.4 患者性别及年龄分布
结果见表 3。78 例 ADR 中,男 5 例,女 73 例;年龄18~75岁,主要集中在41~70岁。
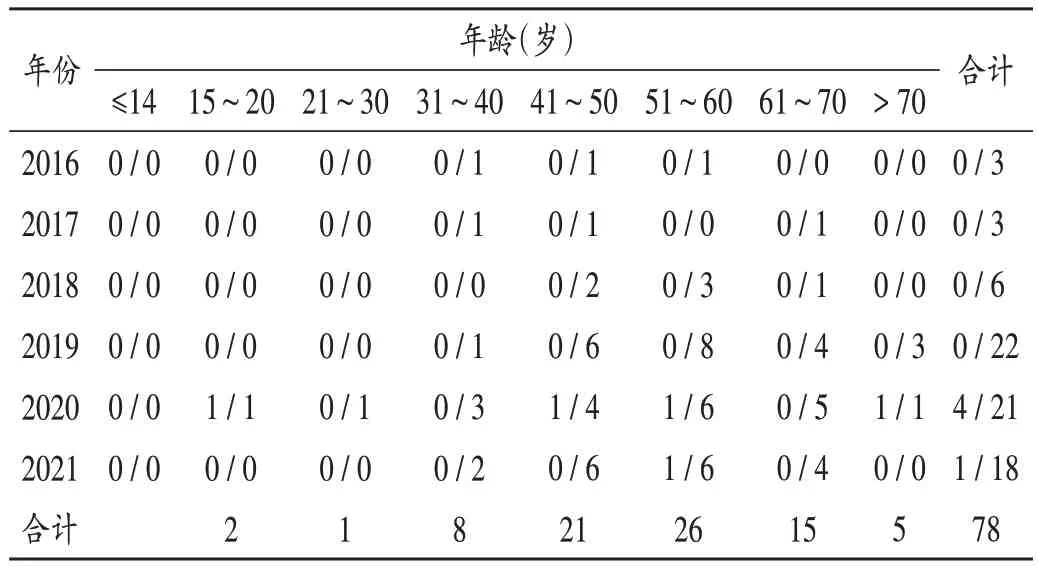
表3 患者性别及年龄分布(男/女,例,n=78)Tab.3 Distribution of patients′ gender and age(male/female,case,n=78)
2.5 用法用量
78例ADR中,患者给药途径均为静脉滴注。用药剂量为20 mg 的患者最多(均为1 日1 次,62 例,79.49%),所用溶剂为5% 葡萄糖注射液(5%GS)的患者最多(均为250 mL,77 例,98.72%),0.9%氯化钠注射液(NS)较少,符合药品说明书要求。详见表4。
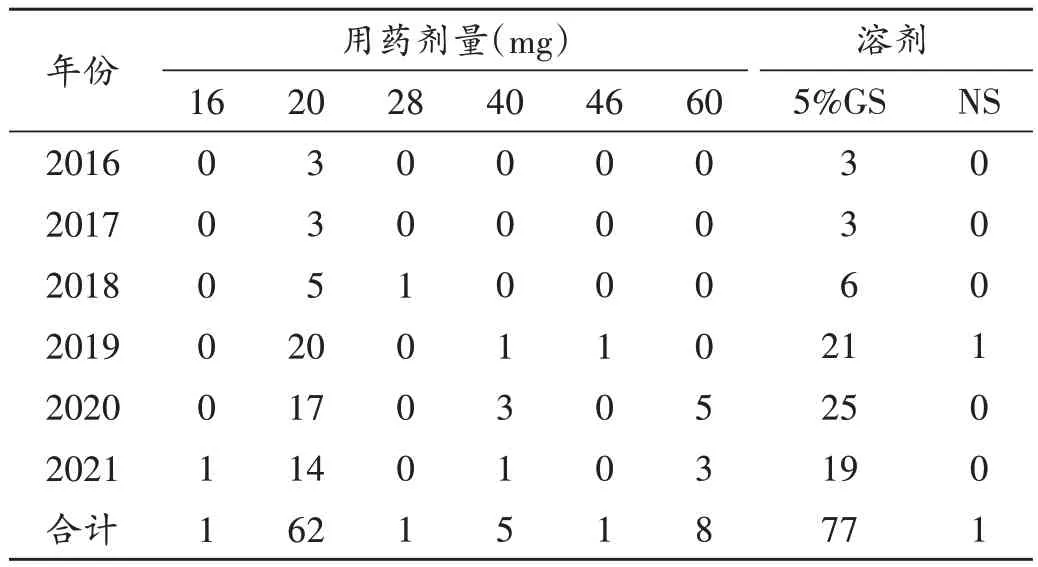
表4 盐酸多柔比星脂质体注射液用量及溶剂分布(例,n=78)Tab.4 Distribution of dosage and solvent of Doxorubicin Hydrochloride Liposome Injection (case,n=78)
2.6 联合用药情况
78例发生ADR的患者均为联合用药,因均为癌症,主要联用抗肿瘤药、止吐药、保肝药、免疫调节药、抑酸药、抗过敏药、升白细胞药等,联用合理,无配伍禁忌情况。病例发生ADR 后,停用盐酸多柔比星脂质体注射液,改用其他抗肿瘤药物,如注射用紫杉醇(白蛋白结合型)、注射用盐酸吡柔比星等。
2.7 ADR 报告类型、临床表现和累及器官/系统
已知一般ADR 表现为胸闷憋气、心慌、窦性心动过速、过敏、皮疹、红斑瘙痒、荨麻疹、咳嗽、腹痛、头晕、恶心、呕吐、反酸、潮红、气短、喉头肿胀、颈部、腰部强直性痉挛、疼痛;严重ADR 表现为骨髓抑制、Ⅳ度粒细胞缺乏症。新的一般ADR 表现为腰痛、心前区疼痛、呼吸困难、脸色青紫、掌红斑;严重ADR 表现为斑丘疹、低血压。2016 年至2018 年,盐酸多柔比星脂质体注射液引起的一般ADR 均占100.00%;2019 年,该注射液引起的新的ADR 占7.69%;2020 年,该注射液引起的新的、严重的ADR 分别占8.97%和7.69%;2021 年,该注射液引起的一般、严重ADR 分别占21.79% 和2.56%,详见表5。累及器官/系统以呼吸系统最常见,详见表6。因同一药品产生的ADR 可能累及多个器官或系统,因此实际临床表现例数可能大于年度ADR 报告数。
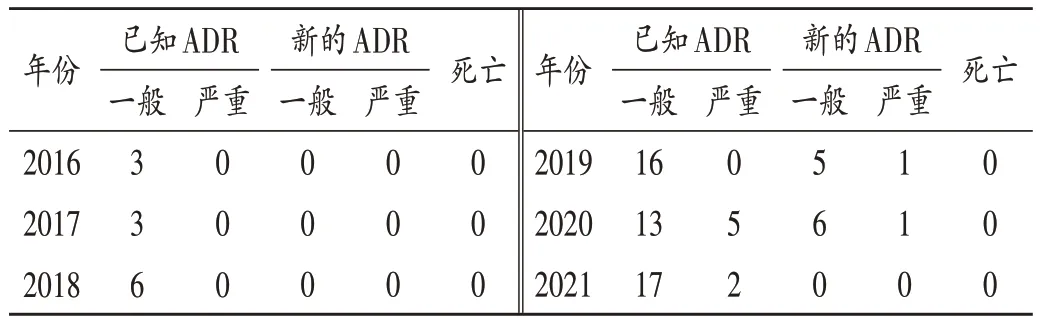
表5 ADR报告类型(例,n=78)Tab.5 Types of ADR reports(case,n=78)
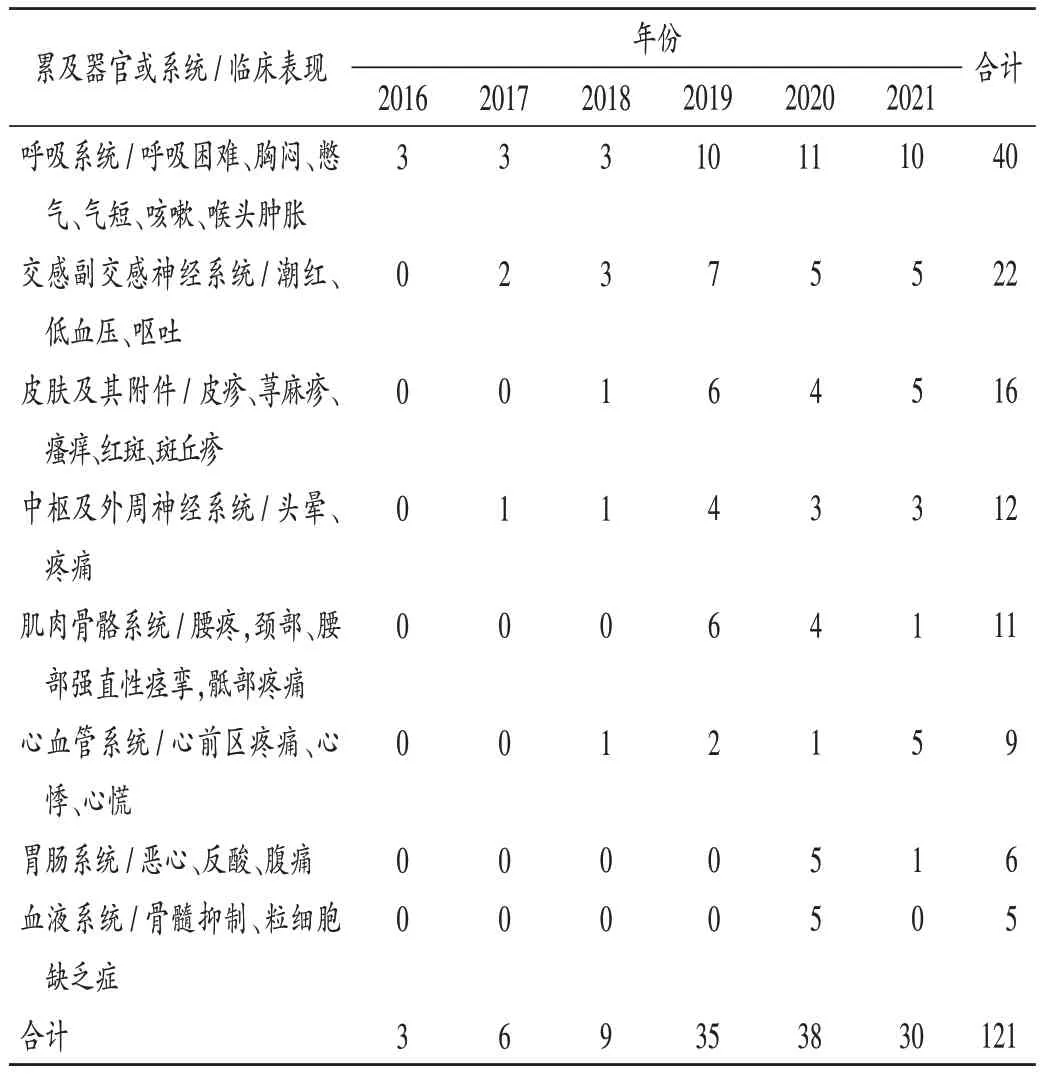
表6 ADR累及器官或系统的临床表现及报告数量(份,n=121)Tab.6 Clinical manifestations and number of reports of ADR involving organs/systems(case,n=121)
2.8 ADR 发生时间及治疗
ADR 发生时间见表7。大部分发生于用药后10 min内(46例,58.97%);少部分发生于用药后2 h以内和24 h内。6 例严重ADR 的发生时间分别为用药后1 min、8 d(3 例)、9 d、10 d。患者ADR 临床表现见表8(因同一药品产生的ADR 可能临床表现、处理情况及预后不同,因此实际临床表现、处理情况及预后例数可能大于年度ADR 报告数)。对于呼吸困难、胸闷喘憋(一般ADR),停止用药,双鼻塞吸氧可缓解;对于呼吸困难、血压下降严重及过敏性休克(严重ADR),应立即给予抗组胺/激素等抗过敏,肾上腺素/多巴胺/去甲肾上腺素/特立加压素升压;对于面部潮红、红斑瘙痒、皮疹等过敏(一般ADR),静脉注射地塞米松磷酸钠,肌肉注射苯海拉明,静脉滴注注射用甲泼尼龙琥珀酸钠;对于心前区疼痛(新的一般ADR),给予口服尼可地尔、硝苯地平治疗;对于腰痛(新的ADR),停止用药或肌肉注射地佐辛注射液;对于骨髓抑制及粒细胞缺乏症(严重ADR),立即停药,皮下注射重组人粒细胞集落刺激因子。
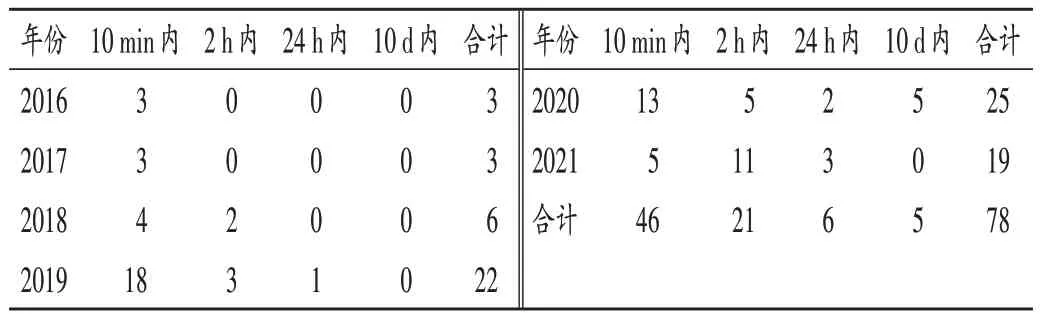
表7 ADR发生时间(例,n=78)Tab.7 Occurrence time of ADR (case,n=78)
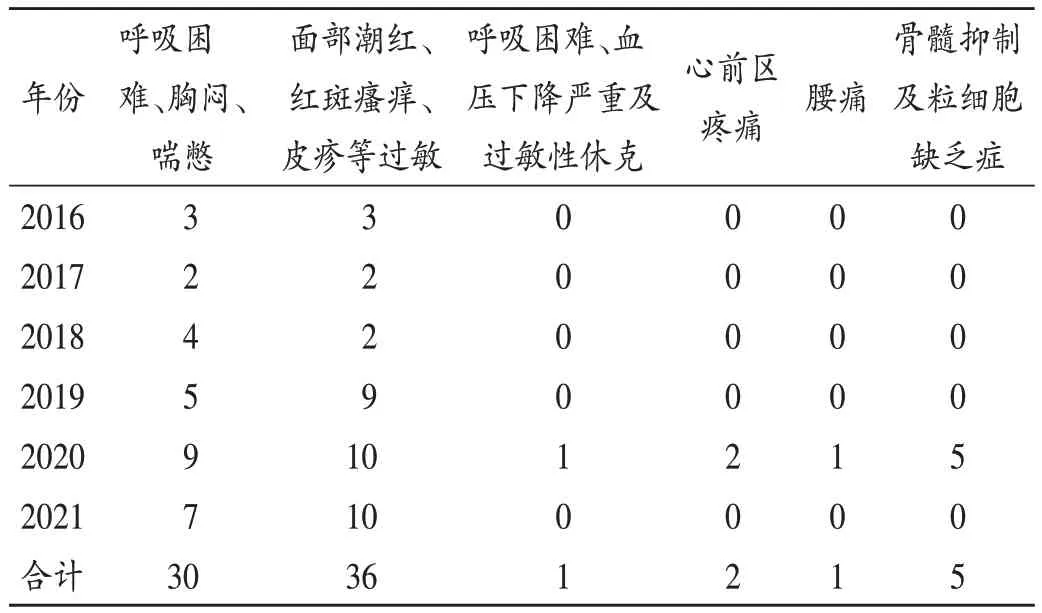
表8 ADR临床表现情况(例)Tab.8 Clinical manifestations of ADR(case)
2.9 转归
78例ADR临床转归见表9。
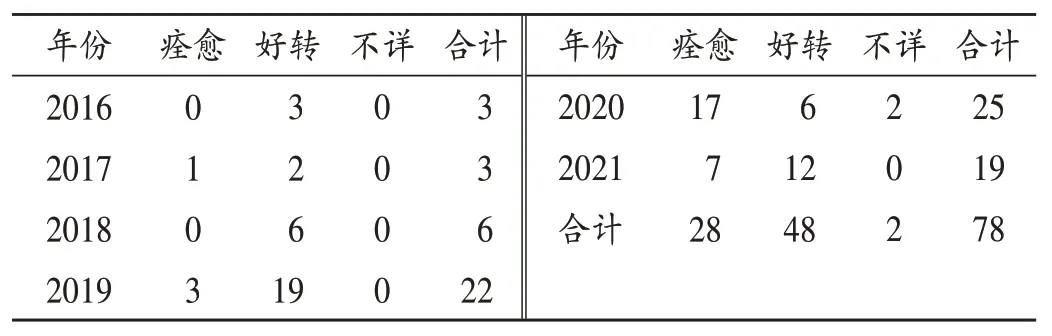
表9 患者转归情况(例,n=78)Tab.9 Prognosis of patients(case,n=78)
3 讨论
3.1 引发ADR 的原因
近年来,我院发生盐酸多柔比星脂质体注射液ADR 的例数逐年增加,如何安全、有效、合理用药并减少或避免ADR 是临床医护人员关注的重点。盐酸多柔比星脂质体注射液是一种抗肿瘤抗生素,可嵌入DNA核苷碱基对,干扰转录过程,阻止mRNA 的形成,从而起到抗肿瘤的作用[1,10]。其属于细胞周期非特异性药物,对肿瘤细胞和正常细胞分裂的阻止,不能针对性地进行区分[10]。其引发ADR的原因如下。
患者因素:1)适应证不适宜,2019 年的 1 例双下肢静脉血栓患者临床诊断不符合该注射液适应证。2)慢性疾病史,2019 年的1 例心悸患者有高血压史,2021 年的 2 例心慌患者有高血压史。3)手术史,78 例ADR 报告中,60 例患者有手术史,免疫能力降低可能更易造成ADR 发生。4)药物食物过敏史,78 例ADR 报告中,20例患者有药物过敏史,过敏药物多为紫杉醇注射液、青霉素类药物、头孢类药物,其输注多柔比星脂质体注射液过程中要格外关注,可提前注射抗过敏药物,避免 ADR 发生。5)老年患者,78 例 ADR 报告中,61 岁及以上患者更易发生ADR,应尽量避免使用。必要时,需在输注前注射抗过敏药物,防止ADR发生。
药物作用机制因素:78 例ADR 中,累及器官/ 系统最多见的为呼吸系统,其次为交感神经副交感神经系统和皮肤系统,多出现胸闷憋气,面部潮红和皮疹、红斑瘙痒等。胸闷皮疹等过敏反应表现为与补体激活相关的Ⅰ型超敏反应[11]。多柔比星脂质体清除半衰期长,稳定性高,药物释放到肿瘤或其他组织的速率较缓慢,易于集中在皮肤或给药部位,造成红斑等ADR[5,11]。盐酸多柔比星脂质体注射液在治疗中会发生胃肠道系统损害(多表现为恶心反酸)和血液系统损害(多表现为骨髓抑制、粒细胞缺乏症等)[12];化疗中会产生心脏毒性,作用机制较多,通常认为氧化应激是主要原因[13]。与多柔比星非脂质体相比,脂质体剂型的多柔比星缓释性良好,被单核巨噬细胞系统摄取后,减少了正常细胞对其的吞噬,从而明显减轻了心肌毒性[8]。
3.2 临床合理应用建议
做好用药前筛查:严格按照药品说明书和国家卫生健康委员会颁发的恶性肿瘤诊疗规范推荐的适用证使用;用药前应详细询问患者有无过敏史,有无基础疾病及基本体能状态[14],因为患者本身的体质特征,如传染病史、慢性疾病史、药物食物过敏史均可能促进ADR的发生;用药前应用糖皮质激素进行预防性抗过敏治疗,并在首次用药时监测患者的生命体征[15]。
严格执行药品说明书的用法用量:根据药品说明书,该药应采用5%GS 稀释,静脉滴注给药,但2019 年仍有1 例溶剂为NS,提示用药过程应严格按药品说明书的用法用量,尽量减少临床ADR 的发生。此外,根据药品说明书,为减少滴注反应的风险,建议起始给药速率应不大于1 mg/min。
做好用药监护:由于2016 年至2021 年我院盐酸多柔比星脂质体注射液致ADR 发生事件逐年增加,提示临床用药过程中,应全程密切观察患者生命体征,特别是用药后前10 min,一旦出现早期滴注反应,须立即停药,积极对症支持治疗。此外,骨髓抑制,往往在用药后10 d左右发生,应持续、长期关注患者用药后的反应。
考虑药物的联合应用:用药过程中,联合使用抗组胺剂、糖皮质激素、肾上腺素、支气管扩张剂等是预防和治疗过敏反应的有效措施。为预防胃肠道反应的发生,联合使用抑酸药和止吐药;当出现白细胞减少症时,可在给予粒细胞集落刺激因子;对于心脏毒性的预防,可给予心脏保护剂;右雷佐生、右旋亚丙胺和丙丁酚可减少癌症患者的长期心毒性风险的发生[13]。早期发现多柔比星引起的心脏毒性,对于防止后续损伤至关重要,多种技术可促进对多柔比星诱导的心脏毒性的监测,如超声心动图、心脏磁共振成像和血清生物标志物,这对于多柔比星诱导的心脏毒性的防治至关重要[13]。
关注药物相互作用:盐酸多柔比星制剂会增加其他抗肿瘤治疗药物的毒性。已有报道合用盐酸多柔比星会加重环磷酰胺致出血性膀胱炎,增加巯嘌呤的肝细胞毒性[4]。虽未对盐酸多柔比星脂质体进行相互作用研究,同时合用其他细胞毒性药物时,仍需谨慎。
3.3 小结
患者在使用盐酸多柔比星脂质体注射液前、使用过程中及使用后,医护人员应加强监督观察,做到用药前筛查,用药中监护,用药后持续关注,及时发现ADR,并采取有效的救治措施,有效减少或避免严重的ADR发生。同时,加强用药管理,保证患者用药安全性,降低盐酸多柔比星脂质体注射液引发ADR 的概率,提高药物的合理应用率。

