FFPE组织HPV检测中PCR-反向点杂交技术的应用:两种核酸提取方法的比较
王 诚,童玲玲,刘千琪,况 薇
四川大学华西第二医院病理科/出生缺陷与相关妇儿疾病教育部重点实验室,四川成都 610011
在全球范围内,宫颈癌是女性癌症死亡的第3大原因,每年新发病例约52.8万,死亡病例约26.6万[1]。约95%的宫颈癌是由人乳头瘤病毒(HPV)持续感染引起的,尤其是高危型HPV(HR-HPV)16和18两种亚型,是肿瘤转化发生的主要激活因素[2-3]。目前,宫颈脱落细胞HPV检测是宫颈癌筛查及后续疫苗接种研究的主要手段[4]。然而,行宫颈脱落细胞HPV检测的大部分感染人群是一过性感染[5]。采用组织标本进行检测对明确HPV感染亚型与肿瘤病变的关系尤为重要。福尔马林固定石蜡包埋(FFPE)组织是使用最广泛的可用于临床回顾性研究的标本资料,近年来,FFPE组织用于HPV检测引起研究者的广泛关注[6]。福尔马林固定及石蜡处理会引起DNA片段化、DNA与蛋白质相互交联,从而影响标本DNA的提取产量和扩增效率,因此对于FFPE组织的DNA提取及HPV检测方法尚存在争议。本研究通过对比粗提法和纯化法两种核酸提取方法获得的DNA质量,分析PCR-反向点杂交法(PCR-RDB)用于HPV检测所得结果的有效性,根据经济效益及实验室条件选择不同的核酸提取方法,为临床提供有效的HPV检测结果。
1 资料与方法
1.1一般资料 收集2019年9月至2020年10月四川大学华西第二医院病理科存档的宫颈癌标本(FFPE组织)25例。所有标本病理诊断均为浸润性宫颈癌,标本来源患者的中位年龄为48.7岁。其中宫颈鳞癌12例,腺癌/黏液腺癌6例,腺鳞癌6例,小细胞神经内分泌癌1例。宫颈癌国际妇产科联盟(FIGO)分期:ⅠB期14例,ⅡA期5例,Ⅲ期5例,Ⅳ期1例。
1.2仪器与试剂 FFPE组织核酸提取试剂盒(QIAamp®DNA FFPE Tissue kit,德国凯杰公司)、NanoDrop 2000分光光度计(赛默飞世尔科技公司)、PCR-RDB检测试剂盒(深圳亚能生物技术有限公司)、内参β-Globin试剂(上海透景生命科技股份有限公司)。
1.3方法
1.3.1FFPE组织切片的制备 切片均由有经验的病理技师完成。从蜡块中切取6张5 μm切片(面积2~4 cm2),第1张及最后1张用于HE染色及癌灶面积评估,第2、3张用于粗提法,第4、5张用于纯化法。操作前、后均用75%乙醇擦拭切片机、蜡块和刀架表面,每切一个蜡块更换一个刀口,用一次性塑料镊子转移切片至EP管。
1.3.2DNA提取 粗提法:加入200 μL裂解液,振荡混匀1 min,置入金属浴100 ℃加热10 min,放入离心机中12 000 r/min离心5 min,离心后由上至下分为3层,分别为石蜡层、DNA溶液层、组织碎片层,取中间DNA溶液层进行检测。
纯化法:二甲苯加入EP管脱腊,无水乙醇洗涤去除残留二甲苯,后续操作按照FFPE组织核酸提取试剂盒说明书操作。最后,加入100 μL洗脱液获得DNA溶液。
1.3.3DNA质量评估 用NanoDrop 2000分光光度计检测DNA纯度和浓度。通常认为A260/A280为1.8~2.0表明DNA纯度较好,低于1.6表明标本中蛋白质含量超标或酚等污染,高于2.0表明标本中含有RNA。采用实时荧光定量PCR法检测标本中β-Globin(Cy5通道)Ct值,Ct值≤32判定结果为有效,Ct值>32判定结果为无效。
1.3.4HPV-DNA亚型检测 HPV-DNA亚型检测采用PCR-RDB。标本DNA提取后,按操作说明书进行PCR扩增、杂交和显色。设置阴性和阳性对照品作为质控,以尼龙膜条上IC点作为内参质控点,膜条各检测点有蓝色信号表明HPV有对应基因亚型阳性;若HPV阳性,IC点无信号,则可能为PCR扩增竞争抑制,结果应判读为HPV阳性;若HPV为阴性,且IC点无信号,则表明该标本检测操作失败。PCR-RDB检测试剂盒可检出23种亚型,包括18种HR-HPV亚型(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82、83)和5种低危型HPV(LR-HPV)亚型(6、11、42、43、81)。
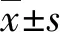
2 结 果
2.1两种提取方法提取的DNA质量比较 粗提法提取的DNA浓度为(60.70±28.50)ng/μL,纯化法提取的DNA浓度为(21.65±10.46)ng/μL,粗提法较纯化法可获得较高的DNA浓度(P<0.05);粗提法和纯化法提取的DNA A260/A280分别为1.44±0.20、1.92±0.16,纯化法获得的DNA纯度更高(P<0.05)。实时荧光定量PCR法检测两组标本β-Globin的Ct值,发现粗提法Ct值高于纯化法(18.99±1.88vs.17.44±2.79,P<0.05),但有1例标本Ct值>32。粗提法提取的DNA A260/A280虽明显低于纯化法,但DNA提取成功率可达96%,除1例标本未获得足量DNA外,其余标本均完成检测,且Ct值均<32。见图1。

注:A为两种方法DNA浓度比较;B为两种方法A260/A280比较;C为两种方法β-Globin Ct值比较;*表示P<0.05。
2.2宫颈癌标本HPV感染结果分析 采用粗提法和纯化法提取DNA后检测HPV感染情况,结果发现总HPV阳性率分别为92%和96%;在鳞癌标本中,粗提法提取时有1例失败,且PCR-RDB检测未获得有效结果,但通过纯化法检测出HPV58感染。在腺癌/黏液腺癌和腺鳞癌中,两种提取方法均发现HPV阳性病例,二者检测结果比较,差异无统计学意义(P>0.05)。见表1。

表1 25例不同病理类型宫颈癌标本HPV感染情况

续表1 25例不同病理类型宫颈癌标本HPV感染情况
2.3两种提取方法提取的DNA标本HPV亚型检测结果对比 采用粗提法提取的DNA标本HR-HPV阳性率低于纯化法(92%vs.96%),但单一型HPV16阳性率高于纯化法(44%vs.36%);与纯化法相比,粗提法提取的DNA无法检测出更多型别的混合感染,但经纯化法提取后可检测出HPV33、HPV53、HPV58等多型别感染。二者阴性率相当,均为4%。见表2。

表2 两种提取方法提取的DNA标本HPV亚型检测结果对比[n(%)]
3 讨 论
HPV是一种小型双链环状DNA病毒,其基因组长度为8 000 bp。现已知超过上百种HPV亚型,其中12种被世界卫生组织认定与癌症密切相关,尤其是HPV16和HPV18与癌症病变最相关[7]。HPV感染主要发生在上皮组织,包括宫颈、肛门和口咽部的上皮组织等,这可能与上述部位特殊的解剖结构有关,其黏膜表面可提供微生物感染的最佳环境,更容易造成HPV持续感染,导致肿瘤的发生[8]。目前,HPV检测方法主要适用于宫颈脱落细胞。从FFPE组织中获得高质量的DNA是一项难题,因为福尔马林引起的核酸-蛋白质之间的交联会影响DNA下游分析。通常,从福尔马林固定的组织标本中提取的核酸处于高度降解状态,且平均片段大小在300 bp左右。PCR-RDB主要用于宫颈脱落细胞HPV检测,因其操作简便及价格低廉,在国内较多医院被广泛使用,但其针对FFPE组织的HPV检测研究甚少。SUN等[9]通过大样本单中心临床研究发现,PCR-RDB是一种可靠、灵敏、准确的方法,其检测结果具有良好的临床参考价值,可以准确检测宫颈HPV感染[9-10]。
与宫颈脱落细胞相比,FFPE组织HPV亚型的准确鉴定对监测疾病进展和预防宫颈癌的发生具有重要意义。另外,FFPE组织可长期存放于病理档案室,为回顾性流行病学研究提供了丰富的生物样本。目前,德国凯杰公司FFPE组织核酸提取试剂已被广泛运用于分子病理基因下游检测,其主要通过二甲苯和无水乙醇预处理来去除石蜡,但存在操作复杂和二甲苯对人体危害大等缺点,尤其是反复洗涤的过程可能造成组织碎片的丢失[11]。同时,由于福尔马林的固定及石蜡的存在会引起DNA的片段化及DNA与蛋白质相互交联。一般情况下,DNA与蛋白质交联可通过加热在某种程度上逆转,但对处理的时间和温度却存有争议[12-13]。本研究采用粗提法,即标本与裂解液混合加热100 ℃ 10 min解除DNA与蛋白质交联,由于粗提法加入裂解液后直接加热提取可能存在大量有机物或蛋白质污染的风险,影响核酸的分离及病毒基因扩增,而结果显示纯化法获得的DNA纯度确实较粗提法更高,提示粗提法获得的DNA标本中残存一定量有机溶剂和蛋白质污染,可能影响后续HPV检测结果。但本研究结果发现,纯化法获得的DNA浓度明显低于粗提法,粗提法获得的DNA标本中除了1例未获得足量DNA外,其他标本均完成HPV检测,且粗提法获得的DNA标本HPV阳性率为92%,与纯化法结果相当(96%),粗提法单一型HPV16阳性率也明显高于纯化法(44%vs.36%)。粗提法中存在的有机物及蛋白质污染可能影响PCR反应扩增效率,本研究结果显示,粗提法获得的DNA标本HPV多型别感染阳性率较低,而纯化法获得的DNA标本HPV多型别感染阳性率明显较高。然而,快速、简单的粗提法获得的DNA标本HR-HPV阳性率虽然低于纯化法,但两种提取方法获得的DNA标本HR-HPV阳性率均超过90%。本研究发现粗提法获得的DNA标本足以满足HPV亚型检测,且能获得有效结果,操作过程简便易行,耗时较短,可同时进行多个FFPE组织标本的提取;虽然纯化法获得的DNA质量较好,但操作复杂,耗时较长,组织经蛋白酶K消化不佳常发生堵管现象,且成本较高。
综上所述,本研究证明了宫颈癌FFPE组织两张5 μm切片(面积2~4 cm2)即可用于HPV亚型检测。无论采用何种核酸提取方法都能获得足量DNA用于HPV检测,且在浸润性宫颈癌组织中发现HR-HPV感染超过90%。此外,FFPE组织HPV检测可以采用简便易行的粗提法提取DNA,该提取方法可供基层医院使用,操作中应避免交叉污染。若需要获得更多HPV亚型或多型别HPV感染情况,仍推荐采用纯化法提取DNA,但粗提法足以满足常规临床病理检测工作,并能够为临床提供有效的HPV检测结果。

