重症急性胰腺炎合并脾动脉假性动脉瘤致腹腔大出血一例
王迎伟 龙颖 李运泽
患者,男,43岁,因“持续性上腹部疼痛3天”于2019年2月1日入院。患者入院3天前饮酒后突发中上腹部胀痛,较剧烈且呈持续性,阵发性加重,向腰背部放射,平卧位加重而蜷曲卧位稍好转。发病后曾在我院急诊科就诊,输液治疗后腹痛好转,回家后腹痛再发,较前加剧伴全身乏力。遂又至我院急诊科就诊,急查心电图提示窦性心动过速,腹部X线平片及阑尾超声无明显异常,胰腺CT提示:重症急性胰腺炎可能性大,并腹膜炎,腹盆腔积液,为进一步诊治收入我科。既往史:20余年前有颈椎手术史。体格检查:T 36.3 ℃,P 82次/分,R 18次/分,Bp 134/86 mmHg。神志清楚,急性病容,全身皮肤、巩膜无黄染。心肺检查未见明显异常;腹部饱满,全腹压痛,以中上腹为主,可疑反跳痛,肌紧张,肠鸣音减弱,移动性浊音阴性。入院后实验室检查:血常规:WBC计数:13.7×109/L(4.0~9.5×109/L,括号内为正常参考值范围,以下相同)、血红蛋白(Hb)106 g/L(120~160 g/L);红细胞沉降率53 mm/h(0~20 mm/h);电解质:血钙1.93 mmol/L(2.03~2.54 mmol/L),余正常;C反应蛋白(CRP):66.82 mg/L(0~6.00 mg/L);动脉血气分析提示:代谢性酸中毒合并呼吸性碱中毒;肝功能:总胆红素33.7 μmol/L(5.1~19.0 μmol/L),直接胆红素21.1 μmol/l(1.7~6.8 μmol/L),余正常;肾功能:尿素氮10.29 mmol/L(2.86~8.20 mmol/L),余正常;空腹血糖:13.24 mmol/L(3.90~6.10 mmol/L);凝血功能、大小便常规、血尿淀粉酶、血脂肪酶无明显异常。入院后予禁食、胃肠减压、抗感染、抑酸、抑酶、改善循环、补液及营养支持治疗。患者2月3日仍有明显中上腹胀痛,伴低热,体温37.9 ℃,2月3日早7时解黑便1次,量约300 g。复查血常规:Hb 68 g/L,CRP 279.61 mg/L,复查血淀粉酶正常范围,粪便潜血试验阳性。体格检查:贫血貌,腹部明显膨隆,全腹部压痛,可疑反跳痛,肠鸣音弱,移动性浊音阳性。按照胰腺炎处理后患者腹痛无明显缓解,同时出现腹部明显膨隆、发热,Hb较前明显降低,立即复查腹部CT示腹腔大量积血(图1),并行腹腔穿刺术,术中抽出暗红色不凝血,穿刺液常规检查:颜色:红色;比重:1.010 g/L;无凝块,红细胞满视野,细胞数:10 640.0×106/L。初步诊断为胰腺炎合并腹腔出血,请肝胆外科、胃肠外科急会诊建议立即转科手术。于2019年2月3日19时行全麻下剖腹探查、肠黏连松解、腹腔血肿清除、腹腔引流术。术中见腹盆腔积暗红色血性液体约2 500 ml,探查见肠系膜上动静脉及小肠系膜根部有一个巨大血肿,大小约12×8 cm,其中小肠系膜因血肿张力较大,系膜撕裂,未予特殊处理,术后转入重症医学科监护治疗。继续予抗感染、生长抑素收缩血管、质子泵抑制剂(PPI)抑酸、适当化痰、加强补液及支持治疗。患者腹腔引流管持续引流出较多血性液体,输血后Hb无明显升高,并出现失血性休克。考虑患者仍有活动性出血,加大补液量同时输血以纠正贫血,并予血管活性药物维持血压,请介入科急会诊后建议行介入治疗。遂于2月4日凌晨1时行选择性腹腔干-脾动脉数字减影血管造影(DSA),脾动脉近端见一异常分支血管并见少量造影剂外溢,提示局部出血明确,予局部栓塞治疗(图2)。介入栓塞术后继续监护治疗,定期复查血常规了解Hb变化,监测腹腔引流管引流量变化。患者腹腔引流管仍持续有血性引流液引出,多次输注红细胞后复查Hb较前无明显变化,波动在52~54 g/L间。患者因持续腹腔出血再次请介入科会诊,并于2月5日12时急诊行腹腔干、脾动脉、胃十二指肠动脉及肠系膜上动脉造影+栓塞术,术中见脾动脉主干开口约5 cm处新发异常血管,并与胃十二指肠动脉相交通,其近段可见假性动脉瘤形成,并见造影剂外溢,提示局部出血明确;用金属弹簧圈栓塞靶血管及脾动脉,加用明胶海绵栓塞胃十二指肠动脉,栓塞后造影剂外溢出血染色消失(图3)。患者第2次介入治疗后腹腔引流管引流液逐渐减少,动态复查血常规示Hb较前升高,于2月8日转普通病房继续治疗,2月13日顺利拔除引流管后出院。半年后随访,患者出院后恢复良好,已正常工作和生活。
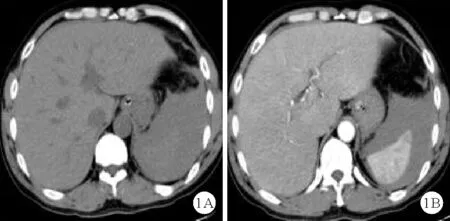
图1 2019年2月3日患者腹部CT结果(A:腹部CT平扫,提示脾周低密度影;B:腹部增强CT,提示脾周积液,考虑腹腔大出血)

图2 2019年2月4日患者选择性腹腔干-脾动脉DSA造影结果(A:脾动脉近端异常分支并见少量造影剂外溢;B:应用明胶海绵局部栓塞治疗术后;如箭头所示) 图3 2019年2月5日患者腹腔干、脾动脉、胃十二指肠动脉及肠系膜上动脉造影结果(A:脾动脉主干开口可见新发异常血管,近段见假性动脉瘤,并见造影剂外溢;B:应用金属弹簧圈栓塞靶血管及脾动脉治疗术后;如箭头所示)
讨 论
急性胰腺炎是临床上常见的消化系统疾病,重症急性胰腺炎(SAP)为胰腺炎的危重类型,病死率高,早期死因多为合并多器官功能衰竭,晚期则为合并感染[1]。胰腺和脾脏解剖位置毗邻,但胰腺炎的脾脏并发症少见,总体发生率为1%~5%[2]。胰腺炎的脾脏并发症包括脾脓肿、脾梗死、脾动脉假性动脉瘤、脾内血肿、脾动脉破裂等[3]。脾动脉假性动脉瘤为胰腺炎少见并发症,而其破裂出血表现为消化道出血或腹腔出血则为罕见的危重并发症[4]。胰腺炎并发脾假性动脉瘤存在解剖学基础,国内学者连续面解剖发现,89%胰尾插入脾肾韧带,75.6%与脾门相连[5]。急性胰腺炎发作时,胰蛋白酶、胰脂肪酶等消化酶在腹腔迅速激活,此类消化酶极易通过二者潜在通道侵蚀脾脏实质和脾血管,导致脾动脉外膜及内膜损失,形成脾动脉假性动脉瘤或脾动脉破裂出血。本例患者既往无引起脾动脉假性动脉瘤的相关疾病,如慢性胰腺炎、外伤或医源性微创操作等诱发脾动脉假性动脉瘤的危险因素。虽患者病程相对较短,但重症急性胰腺炎进展迅猛,结合上述脾动脉假性动脉瘤形成的病理生理过程,考虑脾动脉假性动脉瘤由本次重症急性胰腺炎诱发。
脾动脉假性动脉瘤临床症状无特异性,常见症状包括上腹痛、呕血、解黑便、腹腔及腹膜后出血[6]。患者在短时间内大量出血常伴有Hb进行性下降,并伴有心率加快、血压下降等失血性休克表现。根据出血流出道的不同,可表现为腹腔或胃肠道出血。腹腔出血患者主要表现为腹胀,慢性隐匿性出血或短时间大量出血可引起致命性低血容量休克。胃肠道出血患者则表现为呕血及解黑便,常规胃镜或十二指肠镜可见十二指肠乳头出血。本例患者在重症胰腺炎病程中出现解黑便及腹腔大量出血,考虑同时存在假性动脉瘤破裂血液流入腹腔和消化道。胰腺炎并脾动脉假性动脉瘤诊断方法包括腹部彩色超声、计算机断层扫描血管造影(CTA)和DSA。对于较小的动脉瘤,腹部彩色超声的作用较局限,而CTA是诊断假性动脉瘤的金标准。CTA可见出血部位造影剂外溢,可直观、准确判断出血血管的位置和出血速度,同时还可进一步行栓塞治疗,达到诊断及治疗目的[7]。据报道,对于有CTA或DSA检查禁忌证的患者,可考虑行超声造影检查协助诊断[8]。
胰腺炎并脾动脉假性动脉瘤致大出血自行停止可能性不大,病情凶险,病死率超过50%,临床强调必须早期诊断,尽快选择合适的治疗方案。治疗方案包括药物治疗、经导管动脉栓塞治疗(TAE)及手术治疗。药物治疗包括应用新鲜血浆、纤维蛋白原等血制品,静脉可应用止血药物、生长抑素、垂体后叶素等收缩血管药物。多数SAP并大出血患者单纯应用药物治疗无效,其仅可作为后续有创治疗的过渡。近年脾动脉TAE术和覆膜支架置入术等介入性治疗方法日益受到广泛关注,因其创伤小、恢复快、简便、灵活、止血效果较好的优点,有望成为脾动脉假性动脉瘤及脾动脉破裂出血的首选治疗方法[7,9]。脾动脉TAE最主要的并发症是脾梗死或脾脓肿[10],但因脾动脉分支在栓塞后易形成侧支循环,故上述并发症较少见。栓塞后部分患者复发出血,可再次行栓塞治疗[11]。对于反复栓塞后止血效果不佳或栓塞治疗有禁忌证患者,可考虑手术治疗。
回顾本例患者,虽经两次介入治疗成功止血,但仍有值得思考的地方。患者胰腺炎并发消化道及腹腔大出血,请肝胆外科、胃肠外科等外科医生会诊,行急诊手术后未能找到出血病因和达到止血目的;而后因反复活动性出血请介入科医生会诊并行介入治疗。考虑其原因,一是该病较少见,以前未遇到过类似病例。另外对于复杂、危重病例在临床诊治过程中会遇到很多困难,加强多学科合作,集思广益,以进一步制定合理的诊治方案。

