急性髓系白血病来源骨髓间充质干细胞的基因表达谱和细胞因子表达
吴金娴 刘晓燕 黎鑫琦 梅恒 周芙玲
急性髓系白血病(AML)是一组由造血干/祖细胞获得性遗传或表观遗传病变引起的异质性克隆性疾病[1-3]。骨髓移植是治愈AML的有效途径,但费用高昂。大多AML患者仍采用化疗治疗,但疾病易复发,预后不佳,提高治疗效果并改善预后是亟待解决的问题[4]。越来越多的证据支持骨髓微环境异常对AML发生发展有重要影响,白血病可重塑骨髓微环境,促进白血病细胞自身增殖耐药[5]。骨髓微环境由间充质干细胞(MSC)、成骨细胞、脂肪细胞、神经纤维、微血管网络和细胞外基质组成[6]。MSC在一定条件下,具有分化为成骨细胞、软骨细胞和脂肪细胞的潜力。骨髓MSC在正常和异常造血过程中起着重要作用,但其潜在的分子机制尚不清楚。近年研究发现异常骨髓微环境可成为AML发生和维持的始动因素。骨髓微环境通过自身重塑诱导AML发生或促进疾病进展。如微环境中交感神经病变破坏MSC稳态平衡,MSC过度增殖而逐渐耗竭,早期成骨细胞分化增加,而成熟成骨细胞生成降低,以致骨小梁数量减少,骨结构破坏。由内皮细胞组成的微小动脉和血窦密度则会增加,且结构紊乱。MSC中细胞因子如趋化因子12(CXCL12)、干细胞因子(SCF)表达水平下降[3]。不同于正常造血干细胞,白血病干细胞稳态维持对CXCL12、SCF依赖较小,所以微环境的重塑抑制了正常造血,促进了AML的进展。但是关于AML患者骨髓MSC(AML-MSC)的潜在分子改变如何促进白血病发生的机制仍存在争议。本研究将在细胞和分子水平上对AML-MSC和健康人骨髓MSC(HD-MSC)之间的生物学变异进行多方面比较,提供骨髓微环境调控AML的新证据,为AML治疗提供新的视角,寻找治疗潜在靶点。
对象与方法
1.对象:2020年1月~6月于武汉大学中南医院血液内科初诊为AML患者4例,其中男2例,女2例,中位年龄34岁,白血病分型为M2、M5。纳入同期于我院体检的健康者4例,其中男2例,女2例,中位年龄32岁。白血病细胞株HL-60购自中国科学院(上海)细胞库,人骨髓单个核细胞分离液购自天津TBD公司,人骨髓MSC完全培养基、人骨髓MSC成骨培养基和人骨髓MSC成脂培养基均购自广州赛业公司,Trizol试剂购自中国诺唯赞,人CD45抗体、CD90抗体、CD73抗体、CD34抗体和CD44抗体均购自biolegend,人转化生长因子(TGF)-β1、趋化因子8(CXCL8)、血管内皮细胞生长因子(VEGF)、白细胞介素(IL)-1β、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、IL-6 酶联免疫吸附试验(ELISA)试剂盒均购自CUSABIO,凋亡试剂盒购自联科生物,阿糖胞苷购自赛德萨。本研究经武汉大学中南医院研究伦理委员会批准,所有受试者均签署知情同意书。
2.方法
(1)人骨髓MSC分离与培养:抽取所有受试者骨髓血2~3 ml,置于抗凝管中,低温保存。用巴氏管沿管壁加入2~3 ml等体积骨髓分离液。以550 g的离心力离心25 min后,吸取单个核细胞层。用10 ml MSC培养基重悬单个核细胞转至10 cm培养皿中。3 d后换液去除未贴壁细胞,以后每3 d换液1次,直至贴壁的MSC长满10 cm培养皿,进行传代。
(2)人骨髓MSC表面抗原表达水平检测:取传至第3代人骨髓MSC,分为AML-MSC组和HD-MSC组,分别加入以PE标记的CD34、CD44和CD45、FITC标记的CD90、APC标记的CD73各流式抗体2 μl,孵育后采用流式细胞仪检测两组细胞CD34、CD44、CD45、CD90、CD73表面抗原表达水平。根据MSC国际定义标准,骨髓MSC不表达CD34、CD45(阳性率均在5%以下),表达CD44、CD90、CD73(阳性率在95%以上)[7]。
(3)人骨髓MSC的成骨分化及成脂分化:将两组人骨髓MSC按照说明书要求配置相关试剂,并对其进行成骨分化及成脂分化诱导。成骨诱导14~21 d后,用茜素红染色鉴定成骨分化情况。成脂诱导10 d后,用油红O染色鉴定成脂情况。
(4)转录组测序:用Trizol试剂从AML-MSC和HD-MSC中提取总RNA。RNA文库的制备和转录组测序由天津诺和公司进行。P<0.05和|log2(FoldChange)|>0的基因被认为是差异表达基因(DEGs)。本研究使用clusterProfiler R package对差异基因进行基因本体论(GO)富集分析和京都基因组百科全书(KEGG)通路富集分析。阈值<0.05被认为差异有统计学意义。
(5)ELISA法检测MSC上清液中细胞因子水平:收集第3代AML-MSC和HD-MSC的细胞培养上清液,按照指示准备试剂、样品和标准品进行孵育,在每孔中加入50 μl的停止液。5 min内在450 nm处读取OD值代表细胞因子表达水平。检测TGF-β1、CXCL8、VEGF、IL-1β、GM-CSF与IL-6的表达水平。
(6)AML-MSC与白血病细胞株HL-60共培养:将HL-60分为两组,共培养组为HL-60与AML-MSC共培养,不共培养组仅为HL-60,调整细胞的密度为1×106/ml,接种于6孔板中,加入阿糖胞苷使之终浓度为1 μM,培养48 h后采用流式细胞仪检测两组细胞凋亡情况。
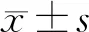
结 果
1.两组细胞分离与培养情况:所有受试者的骨髓血经过密度梯度离心后获得单个核细胞,培养72 h后部分细胞贴壁,约15 d细胞融合至80%,可进行传代,连续传5~6代细胞形态未发生变化,7代后开始老化。选取第3代细胞进行试验,通过体外培养,发现AML-MSC组与HD-MSC组细胞在形态上没有差异,均显示出典型的纺锤形(图1)。

图1 两组细胞分离与培养情况
2.两组细胞成骨和成脂分化情况:用成骨和成脂诱导培养基在体外对MSC进行诱导,经茜素红染色,可见橘红色的钙结节,说明此时细胞外基质发生矿化,成骨分化基本完成(图2A、B)。经油红O染色后,可见细胞胞浆内布满大小不一的红色脂滴颗粒,提示成脂分化基本完成(图2C、D)。AML-MSC组与HD-MSC组细胞在体外均完成成骨分化与成脂分化。

图2 两组细胞成骨和成脂分化情况(A、B:成骨分化;C、D:成脂分化;A、C:AML-MSC组;B、D:HD-MSC组;×200)
3.两组细胞表面抗原表达水平比较:流式细胞仪检测结果显示分离所得的AML-MSC与HD-MSC均为纯度较高的骨髓MSC,其表面抗原表达水平比较差异均无统计学意义(P>0.05)。见图3。

图3 两组细胞表面抗原表达水平比较
4. 两组细胞转录组测序情况:以P<0.05和|log2(FoldChange)|>0作为标准筛选AML-MSC和HD-MSC之间差异基因。通过比较AML-MSC与HD-MSC RNA-seq共检测到563个DEGs,其中262个上调,301个下调。为进一步了解已识别的DEGs影响通路和过程,分别进行GO和KEGG分析。使用clusterProfiler Rpackage对上述563个差异基因进行GO分析。生物过程(BP)改变可能与DNA生物合成过程的正向调控、蛋白磷酸化、成纤维细胞迁移的正向调控等途径有关;细胞组成(CC)变化与核复制、焦点粘连等途径有关;分子功能(MF)改变主要涉及细胞骨架的结构成分、肿瘤坏死因子受体超家族结合等。本研究随后进行KEGG分析,结果显示通路KEGG主要富集于吞噬体、感染、细胞因子受体相互作用等通路。见图4。

图4 两组细胞转录组测序情况(A:DEGs的火山图谱;B:DEGs的热图;C:GO分析柱状图;D:DEGs的KEGG分析气泡图)
5.两组细胞上清液细胞因子水平比较:AML-MSC组中TGF-β1、CXCL8、VEGF水平均高于HD-MSC组(P<0.05),而IL-1β、GM-CSF与IL-6水平在两组细胞间比较差异均无统计学意义(P>0.05)。见表1。

表1 两组细胞上清液中细胞因子水平比较
6.AML-MSC与白血病细胞株HL-60共培养后细胞凋亡的情况比较:共培养组活细胞比例(63.19%±2.38%)高于不共培养组(47.32%±3.17%,P<0.05)。
讨 论
MSC在骨髓微环境中发挥重要作用,其异常改变可能导致AML的发生和发展。越来越多的证据表明,骨髓微环境异常可能是AML发生和维持的起始因素。骨髓微环境通过自我重塑诱导AML进展和化疗耐药性[3]。因此,了解AML-MSC的异常变化,有助于探索骨髓微环境异常与AML之间的作用机制,并为治疗AML寻找新的靶点。
异常骨髓微环境能引起造血干细胞遗传或信号通路变化。Blau等[8]对AML患者进行染色体分析结果发现,30%~70%AML患者MSC发生染色体异常改变,且MSC基因组变化往往伴随造血干细胞中不利于AML预后的染色体异常改变[9]。此外有学者研究发现,AML-MSC生长能力受损,并伴特定的甲基化特征,对正常造血干细胞支持减少,AML-MSC异常改变导致MDS和AML造血功能不足,恶性骨髓细胞和MSC之间调控明显失调[10]。但目前对AML-MSC的大多研究都相对零散,对AML发病机制的认知及解释仍严重不足。本文通过体外培养AML患者与健康人骨髓MSC,首先对AML-MSC与HD-MSC在免疫表型和多项分化能力方面进行比较,结果两者显示出相似性,与相关研究结果一致[11]。利用高通量测序和生物信息学技术共鉴定出563个DEGs,其中上调基因262个,下调基因301个。KEGG富集分析显示,通路KEGG主要富集于吞噬体、感染、细胞因子受体相互作用等通路。既往研究也有类似结果,有研究报道这些通路与AML发病机制和预后相关[12]。值得注意的是,KEGG通路在细胞因子通路显著富集。MSC来源炎症相关因子也是调控AML进展的重要因素。研究报道AML疾病进展与MSC来源的TGF-β1、单核细胞趋化蛋白-1(MCP-1)及前列腺素E2(PGE2)、IL-6等细胞因子异常分泌相关[13-15]。因此,本研究通过对MSC上清液细胞因子进行测定,结果发现AML-MSC高表达TGF-β1、CXCL8、VEGF。相关研究发现健康人MSC添加TGF-β1会使健康细胞功能受损[16],表明MSC来源的CXCL8可通过PI3K/AKT通路促进白血病进展。另外,VEGF过度表达在临床上与白血病患者的侵袭性临床病程、化疗反应和不良预后相关[17]。这些因子可通过改变MSC自身生物学特性及调控造血干细胞中信号通路而影响AML疾病进展。此前有研究结果显示,AML耐药不仅与AML细胞自身生物学特征相关,且骨髓微环境在其中发挥的重要作用相关。骨髓微环境不但可通过分泌多种细胞因子及细胞与细胞间的接触,保护AML细胞免受化疗药物杀伤,且可通过促进白血病细胞生长,调节相关信号通路以介导AML细胞耐药[5]。本研究结果发现,白血病细胞与AML-MSC共培养后,可降低阿糖胞苷对其的杀伤作用,增加耐药性,进一步支持AML-MSC在AML进展中发挥耐药作用的观点。
综上,来自AML患者的原代骨髓MSC与来自健康供体的正常骨髓MSC相比,显示出不同的细胞因子和转录水平,AML-MSC增加白血病细胞的耐药性,为研究MSC促进AML进展提供新的证据与研究思路。

