影响高脂饮食诱导联合链脲菌素建立2 型糖尿病大鼠模型存活率的实验研究
朱贞洋 沈晶 陈晴晴 伍建林
1.大连大学附属中山医院放射科,辽宁大连 116001;2.攀枝花市中心医院放射科,四川攀枝花 617067
糖尿病(diabetes mellitus,DM)是以高血糖为主要特征的慢性代谢性疾病,其发病率呈持续增长趋势。中国DM人数已超过1.4亿,以2型糖尿病(type 2 diabetes mellitus,T2DM)最为常见。T2DM 以持续高血糖、高胰岛素血症及胰岛素抵抗为特征,临床表现典型“三多一少”症状,但具体病因不明。有研究基于肠–脑轴探索肠道微生物对T2DM 及其并发症的影响,并利用益生菌制剂治疗T2DM 取得了进展。稳定可靠的T2DM 动物模型对研究其病因、病理及治疗药物开发至关重要,目前建立T2DM大鼠模型主要包括基因动物及药物制备2 种模式,其中高脂饮食(high fat diet,HFD)诱导联合链脲菌素(streptozotocin,STZ)是建立T2DM 动物模型有效且较为经济的方法。本研究拟利用上述方法验证其构建T2DM 大鼠模型的可行性及稳定性,并重点探究影响大鼠成模率及存活率的潜在因素。
1 材料与方法
1.1 动物及材料
雄性SD(sprague–dawley)大鼠,7~9 周龄,体质量180~220g,由辽宁长生生物技术股份有限公司提供[SCXK(辽)2020–0001]。STZ(美国Sigma公司),罗康全卓越精采型血糖仪(德国Roche 公司)。大鼠维持饲料:水分>10%、蛋白质25%、碳水化合物50%、脂肪5%及适量氨基酸和微量元素;高糖高脂饲料配方:66.5%维持饲料+10%猪油+20%蔗糖+2.5%胆固醇+1%胆酸钠,均由小黍有泰(北京)生物科技有限公司提供[许可证号:SCXK(京)2018–0006]。大鼠饲养于大连大学附属中山医院动物实验中心[SYXK(辽)2018–0005],并经大连大学附属中山医院实验动物伦理委员会批准(审批号:202104012)。
1.2 动物分组及模型建立
80 只雄性SD 大鼠按购入时间随机分为4 个批次5 个组别,分别为P1(=10)、P2(=20)、P3(=10)、P4(=30)及正常对照(normal contrast,NC)(=10)组。各组大鼠均在同一间实验室饲养,自由摄取水和饲料,正式实验前均适应性喂养1 周。T2DM 大鼠建模:P1~P4 组大鼠通过HFD 饲养5 周,然后禁食12h 后,均于次日上午8:00~9:00 以40mg/kg STZ溶液单次腹腔注射的方式建立T2DM 大鼠模型。STZ溶液配制方法:依据文献[6]将STZ 溶于0.1mol/L pH 4.2~4.5 的柠檬酸钠缓冲液中,最终浓度为0.1%。NC 组大鼠注射与体质量相符的柠檬酸钠缓冲液,并以普通饲料喂养至实验终止。STZ 溶液均现场配制并在30min 内完成注射,各组大鼠均由相同实验人员、按相同操作手法给药。
1.3 检测指标
每周监测大鼠体质量,STZ 给药前1 周及给药后72h、1 周、2 周、3 周、4 周在空腹状态下通过尾静脉采血检测空腹血糖(fasting blood glucose,FBG),测量当日上午7:00~9:00 禁食,下午13:00~15:00 测定。给药后每日观察记录各组大鼠的一般状况与生命体征,包括食量、饮水量、尿量、毛发颜色及精神状态等,并记录各组大鼠的存活时间,存活时间≥4 周者记录为28d。查询实验室值班日志并记录各模型组给药后1 周内的实验室温度、湿度信息。STZ 给药72 h 后,通过鼠尾静脉采血测得FBG≥8.3 mmol/L 并伴有尿量及饮水量明显增多则认为T2DM 模型成立。
1.4 统计学方法
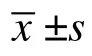
2 结果
2.1 T2DM 模型大鼠一般指标比较
模型组大鼠(P1~P4)HFD 饲养5 周后体质量显著高于NC 组(=2.53,=0.01);模型组大鼠给药后均伴有体质量明显下降,显著低于同期NC 组大鼠(<0.05),见表1。STZ 给药前模型组和NC 组大鼠的FBG 比较差异无统计学意义(=-0.43,=0.66);给药24h 后,模型组大鼠出现不同程度的多饮、多尿症状,且皮毛发黄、易脱落,多食症状不明显,STZ 给药后模型组大鼠FBG≥8.3mmol/L,显著高于同期NC 组大鼠(<0.01),见图1、表2。

图1 STZ 给药前后模型组与NC 组大鼠FBG 折线图
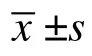
表1 STZ 给药前后各组大鼠的体质量水平比较(,g)
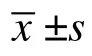
表2 STZ 给药前后各组大鼠的FBG 比较(,mmol/L)
2.2 T2DM 模型组大鼠给药早期与后期存活率比较
模型组大鼠给药24h 后陆续出现死亡事件,给药72h 模型组大鼠总存活率58.6%(41/70),NC组大鼠存活率100%(10/10),差异有统计学意义(=4.83,=0.03);给药后期(4 周)模型组大鼠总存活率48.6%(34/70),NC 组大鼠存活率100%(10/10),差异有统计学意义(=7.39,=0.07)。P3 组大鼠死亡率最高,给药早期(1 周)死亡率达50%(5/10),后期(4 周)死亡率达70%(7/10);P1 组大鼠死亡率最低,给药早期、后期死亡率分别为20%(2/10)、30%(3/10);P2、P4 组大鼠早期死亡率分别为30%(6/20)、53%(16/30),后期死亡率分别为45%(9/20)、57%(17/30),模型P1~P4组间早期及后期存活率比较差异无统计学意义(早期:Fisher 值=4.88,=0.19;后期:Fisher 值=3.76,=0.31)。由图2 可知,模型组大鼠给药后1~3d 内的死亡率最高,给药3d 后模型组大鼠多趋于稳定。结合检验,模型组大鼠给药72h 内的总死亡率为41.4%(29/70),给药72h~4 周的死亡率为12.2%(5/41),差异有统计学意义(=10.40,<0.01)。

图2 模型组(P1~P4)与NC 组大鼠的生存分析
2.3 T2DM 模型组大鼠存活率的影响因素
本研究模型P1~P4 组的建模时间分别是本年度的5~8 月,实验日志显示建模空间环境的温度均维持在(21±2)℃,但空气湿度差异较大,即5、6 月份空气相对湿度较低,分别为50%、62%,而7、8月份湿度分别高达71%、67%,均值为62.5%。基于湿度62.5%将模型组分为2 组:湿度<62.5%(P1+P2)组大鼠存活率显著高于湿度≥62.5%(P3+P4)组(χ=4.72,=0.03),见表3。

表3 不同湿度环境下模型组大鼠STZ 给药1 周后存活率比较
3 讨论
稳定的动物模型对研究T2DM 及其并发症具有重要的科研与临床意义,药物(STZ)诱导相较于手术造模和基因改造具有操作简单和性价比高等特点。众所周知,T2DM 病程早期以糖脂代谢紊乱及胰岛素抵抗为主,病程晚期以胰岛素相对缺乏为特征。因此,利用高脂饲料饲养一段时间引起实验动物糖脂代谢紊乱并导致胰岛素抵抗,再辅以小剂量STZ 破坏胰岛β 细胞,能建立符合T2DM 病理生理状态的动物模型。多数学者建议HFD 诱导时间为4~8 周,STZ 剂量以25~45mg/kg 为宜。本研究证实,HFD 饲养5 周联合单次40mg/kg STZ 腹腔注射可成功构建SD 大鼠T2DM 模型,与既往研究一致。本研究在相同实验条件下模型组大鼠存活率不尽相同,经回顾对比实验各环节后发现,可能由于T2DM 建模时间选择在夏季及本地区阴雨天较多,导致模型鼠的存活率下降,经统计分析后发现T2DM 大鼠存活率与环境空气湿度有直接关系。
关于T2DM 动物模型成模标准尚存在争议,但普遍以血糖升高合并T2DM 病征作为模型成功与否的判断标准。本研究各个模型组大鼠在给药72h后,存活大鼠FBG 均>8.3mmol/L,且连续检测4 周血糖基本维持在较高水平,可认为T2DM 大鼠模型建立成功。T2DM 是以高血糖、高胰岛素血症及胰岛素抵抗为特征的慢性系统性疾病,以肥胖者多见,多伴有典型“三多一少”症状。本研究中各组模型鼠亦有类似发现,表现为给药后24h 内大鼠饮水量显著增加,垫料呈明显湿润状态,但与唐辉等研究不同,模型组大鼠多食症状并不明显,推测由于长期高脂饲喂导致食欲下降所致。T2DM 大鼠不能有效利用葡萄糖,脂肪及蛋白质分解供能导致机体迅速消瘦。实验中模型组大鼠高脂喂养5 周后体质量显著高于NC 组,STZ 给药后模型组大鼠体质量则出现明显下降,给药后1~4 周体质量均明显低于NC 组,符合T2DM 高代谢、高消耗的特征,与Mayyas等研究结果相符。T2DM 大鼠模型建立1~4 周内,模型大鼠多饮、多尿症状均持续存在,FBG 维持在较高水平,体质量减低维持在338~364g,与既往研究相仿。
本研究STZ 给药4 周模型组大鼠的总存活率为48.6%(34/70),显著低于钟尉等60%的存活率,其原因可能与STZ 纯度、操作方法及实验室环境等因素有关。本研究模型组大鼠给药后72h 内的总死亡率显著高于72h~4 周内死亡率,与既往研究相仿。目前普遍认为STZ 注射早期胰岛β 细胞被破坏,大量胰岛素释放入血导致低血糖,是给药72h内大鼠死亡的主要原因;给药后期,T2DM 大鼠多因自身高代谢状态、T2DM 并发症及STZ 毒副作用死亡,但死亡率远低于给药早期。此外,实验中个别大鼠因补水不及时导致在24h 内出现嗜睡并快速死亡,也提示T2DM 大鼠建模中提供充足饮水的重要性,因为缺水合并高血糖促使血浆渗透压迅速增高而发生高渗性昏迷,是导致建模后期实验动物突然死亡的重要诱因。另外,笔者还发现模型组大鼠给药后1 周内死亡率亦存在较大差异,即P1 及P2组均低于50%,P3 及P4 组均高于50%。回顾实验日志,建模时间为5~8 月,实验室温度基本恒定,但湿度却有较大改变,不难发现,低湿度条件下大鼠存活率显著高于高湿度条件,以此可认为空气湿度是影响STZ 给药后大鼠存活率的关键因素,低湿度环境造模更有助于提高大鼠的存活率。研究发现高湿度环境会导致大鼠免疫功能紊乱及多脏器损伤,笔者推测这亦是高湿度环境下T2DM 造模死亡率较高的原因之一。
本研究仍存在以下不足:①HFD 诱导联合低剂量STZ 是建立T2DM 动物模型常规方法,本研究参考既往文献将空腹血糖显著升高及存在糖尿病特征作为模型建立标准,未结合生化指标综合评估模型鼠状态;②鉴于不能对大鼠实时监控,模型组大鼠给药后存活时间粗略以“天”计算,与大鼠实际生存时间存在一些不可避免的误差。另外,本研究设置的终点事件为“给药后4 周”,观察时间相对较短。
总之,本研究验证了HFD 诱导联合小剂量STZ单次腹腔注射建立较为稳定T2DM 大鼠模型的可行性,操作简单,成模率较为理想,且研究中发现空气湿度对模型鼠存活率有较大影响,较低的空气湿度更有利于提高给药后模型鼠的存活率,对后续类似研究有参考价值。由于T2DM 大鼠自身高代谢状态及STZ 的毒副作用,给药后24~72h 模型组大鼠死亡率最高,给药1 周后T2DM 大鼠大多趋于稳定,此阶段应注意模型大鼠的日常护理,尤其要保证饮水充足。

