米卡芬净联合头孢他啶对铜绿假单胞菌生物被膜形成与清除的研究
李艳华, 张树逍, 杨 阳, 徐广健, 邓启文
铜绿假单胞菌是一种常见的条件致病菌,在自然界分布广泛,可致肺囊性纤维化和对免疫功能低下的患者有致死性[1-2]。因其具有较强形成生物膜的能力,使它成为临床上难治性病原体之一。生物膜是嵌在细胞外聚合物基质中的微生物群落。随着生物膜的形成,这些病原体表现出对抗生素的极端耐受性,并保护其逃避宿主免疫清除[3-6]。
棘白菌素类抗真菌药物包括卡泊芬净、米卡芬净和阿尼芬净,被认为是治疗与生物膜形成相关的念珠菌血症的一线药物[7-8]。这些抗真菌药物对β- (1, 3) -D-葡聚糖合成酶具有非竞争性的抑制作用。β- (1, 3) -D-葡聚糖合成酶催化UDP-葡萄糖聚合成 β-(1, 3) -D-葡聚糖,为真菌细胞壁和念珠菌生物膜细胞外聚合基质的主要成分[9-10]。而在铜绿假单胞菌感染患者的血清中检测到β- (1,3)-D-葡聚糖,对比研究证实,高浓度米卡芬净可抑制铜绿假单胞菌生物膜的形成[9,11-12]。前期研究表明,米卡芬净对铜绿假单胞菌无抑菌和杀菌作用,但可明显抑制多重耐药铜绿假单胞菌生物膜的形成,而且还能清除成熟的生物膜,清除率达15.43%~30.87%[13]。本研究以米卡芬净为基础,探索联合具有抑菌、杀菌作用的抗生素头孢他啶是否可增强对铜绿假单胞菌生物膜感染的治疗效果,为临床治疗提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 选取4株铜绿假单胞菌生物膜强阳性菌株,均分离于华中科技大学协和深圳医院临床送检的痰标本(实验室编号:铜绿假单胞菌04、05、27、40),经基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS, Germany)鉴定。质控菌株铜绿假单胞菌ATCC 27853,菌株均保存于-80℃超低温冰箱。
1.1.2 仪器与试剂 MALDI-TOF MS、酶标仪购自法国生物梅里埃公司,LB培养基购自青岛日水生物技术有限公司,结晶紫购自上海斯信科技有限公司,米卡芬净(商品目录号:M888201)、头孢他啶(商品目录号:C832496)购自中国MCE公司,96孔细胞培养板、24孔细胞培养板、细胞刮棒购自美国Corning公司。
1.2 方法
1.2.1 药物敏感性试验 根据CLSI M100-S27文件在阳离子调节的Mueller-Hinton肉汤(CAMHB)中采用肉汤微量稀释法测定抗菌药物对浮游细菌和生物膜的MIC。所有实验均重复3次。抗菌药物使用前先用无菌蒸馏水溶解,然后用CAMHB培养基稀释。生物膜相细菌通过24孔细胞培养板构建生物膜,37℃静置培养4 d,每24小时更换一次新鲜LB培养基,然后用无菌生理盐水冲洗3次后, 细胞刮棒刮取培养板表面生物膜细胞,收集于50 mL无菌塑料管中[14],轻轻混合稀释至0.5麦氏浊度单位。重悬后的生物膜用革兰染色检查生物膜结构,见图1。
1.2.2 药物单用与联合对细菌生物膜形成的作用 将铜绿假单胞菌菌株传代2次,取单个菌落接种于LB培养基,振摇过夜,用LB培养基1∶200稀释后加入96孔培养板(100 μL/孔),37℃静态培养6 h后,添加含不同药物的新鲜LB培养基(100 μL/孔)。设米卡芬净组(米卡芬净终浓度:10、20、40、80、160、320、640、1 280、2 560、5 120、10 240 mg/L),头孢他啶组(头孢他啶终浓度 :1/32×MIC、1/16×MIC、1/8×MIC、1/4×MIC、1/2×MIC),米卡芬净联合头孢他啶组(头孢他啶终浓度同单药组,米卡芬净终浓度 10 000 mg/L[9,11-12]),对照组加入生理盐水;37℃静态培养24 h后,弃上清液,生理盐水漂洗培养板3次,室温晾干,加99%甲醇固定15 min,去除甲醇后晾干,加0.5%的结晶紫染色10 min,弃染液,无菌生理盐水漂洗3次,室温晾干,加95%乙醇(200 μL/孔)溶解染料20 min,转移各孔溶液150 μL/孔至新的96孔板,通过酶标仪测定570 nm吸光度值(D)检测生物膜的量,比较生物膜变化情况[15]。根据D值计算抑制率:抑制率(%)=(对照组D570nm-药物组D570nm) /对照组D570nm。
1.2.3 药物单用与联合对成熟生物膜的清除作用 同上述稀释的菌悬液200 μL接种至96孔培养板,37℃静置培养,每24小时更换等体积的新鲜LB培养基,培养4 d后,用无菌生理盐水洗涤3次,加入含不同药物的新鲜LB培养基(200 μL/孔),设米卡芬净组同上、头孢他啶组(头孢他啶终浓度 :1×MIC、2×MIC、4×MIC、8×MIC、16×MIC、32×MIC),米卡芬净联合头孢他啶组(头孢他啶终浓度同单药组,米卡芬净终浓度 10 000 mg/L[9,11-12]),通过结晶紫染色半定量法检测米卡芬净和头孢他啶对铜绿假单胞菌成熟生物膜清除作用,根据D值计算清除率: 清除率(%)=(对照组D570nm-干预组D570nm) /对照组D570nm。
1.2.4 统计学分析 计量资料以均数±标准差表示,两组之间方差齐采用Student-t检验,方差不齐采用近似t检验,应用SPSS 23.0软件进行统计分析,以P<0.05为差异有统计学意义。
2 结果
2.1 药物敏感性试验
生物膜形成后,头孢他啶对3株铜绿假单胞菌的MIC增加了4~8倍;当米卡芬净存在时,头孢他啶对3株铜绿假单胞菌的MIC降低50%,见表1。
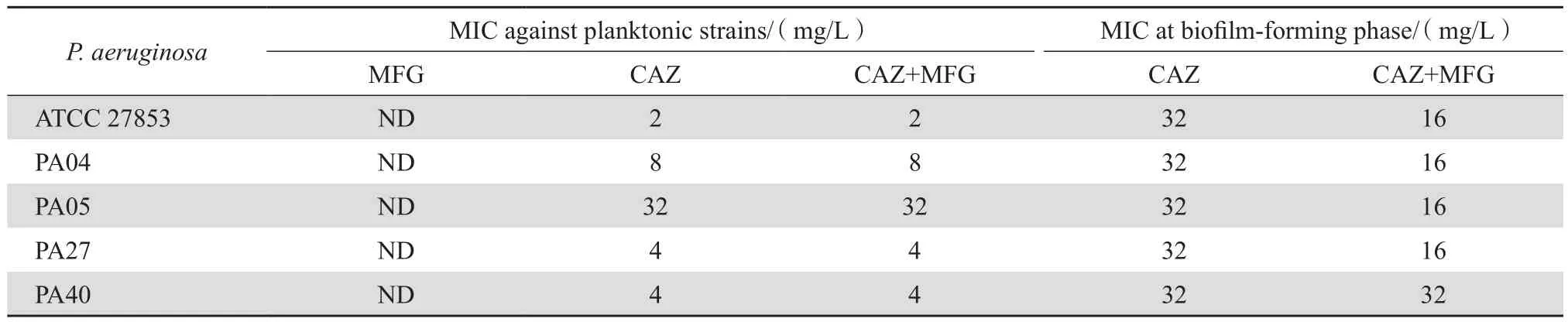
表1 铜绿假单胞菌对抗菌药物敏感性试验Table1 Antimicrobial susceptibility testing of Pseudomonas aeruginosa
2.2 米卡芬净对生物膜的作用
米卡芬净对所有细菌的生物膜形成均有明显的抑制和清除活性,但有效浓度各不相同(见图2、图3),对生物膜形成和成熟生物膜活性均有剂量依赖性,随药物浓度增加,抑制率和清除率逐步提高,抑制率最高可达64.86%~72.30%,清除率最高可达62.13%~64.48%,见表2。

表2 米卡芬净对铜绿假单胞菌生物膜的抑制和清除Table 2 The inhibition and eradication rates of micafungin on Pseudomonas aeruginosa biofilm (%)
2.3 药物联合对生物膜的作用
亚抑菌浓度的头孢他啶对铜绿假单胞菌被膜的形成有明显的抑制作用,但与米卡芬净联用表现出拮抗作用,对被膜形成的抑制效果低于米卡芬净单用(见表3、图4);高浓度头孢他啶对成熟被膜也有明显的清除作用,但与米卡芬净联合仅1株(PA04)表现出协同作用,清除效果高于米卡芬净单用,对其余3株菌表现拮抗作用,效果低于米卡芬净单用(见表4、图5)。
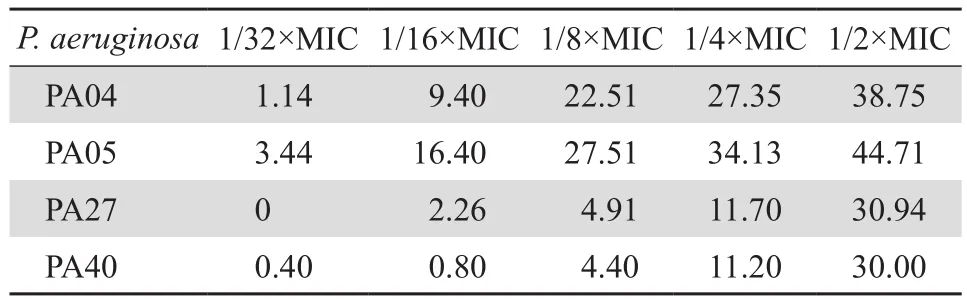
表3 头孢他啶对铜绿假单胞菌生物膜形成的抑制率Table 3 The inhibition rate of ceftazidime on P. aeruginosa biofilm formation (%)
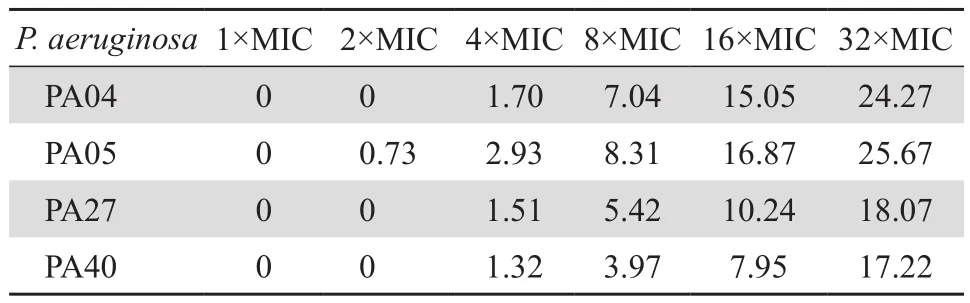
表4 头孢他啶对铜绿假单胞菌成熟生物膜的清除率Table 4 The eradication rate of ceftazidime on the mature biofilm formed by P. aeruginosa (%)
3 讨论
米卡芬净通过非竞争性抑制 β-(1, 3)-D-葡聚糖的合成而发挥抗真菌作用,而铜绿假单胞菌生物膜基质中存在周质葡聚糖, 其中高度甘油磷酸化β-(1→3)葡聚糖,具有封闭抗生素、减慢或阻止抗生素分子扩散到其活性位点的作用[16-17]。而此成分与侵袭性真菌感染的外周血β-(1→3)葡聚糖反应性试验存在交叉反应,因此,米卡芬净很有可能具有潜在的抗铜绿假单胞菌生物膜作用。研究结果证实高浓度米卡芬净能明显抑制铜绿假单胞菌生物膜形成[9,11-12]。本实验中发现低浓度的米卡芬净对铜绿假单胞菌生物膜也有抑制作用,并呈浓度依赖性,随着米卡芬净浓度增加,抑制作用逐步增大。但这种抗生物膜作用的浓度依赖性仍需体内试验和临床研究的验证。同时,在研究中还发现米卡芬净可以提高铜绿假单胞菌生物膜对头孢他啶的敏感性,这可能与米卡芬净破坏了生物膜结构,促进了抗菌剂通过受损的生物膜渗透有关[9,11-12]。因此,这使得米卡芬净联合抗生素治疗铜绿假单胞菌生物膜感染成为可能。
头孢他啶是一种重要的抗假单胞类细菌的抗生素,研究证实亚抑菌浓度的头孢他啶通过降低铜绿假单胞菌黏附和多糖基质合成的lecA、lecB、pel和psl基因的表达,从而抑制其生物膜的形成,并呈现药物浓度依赖性[18-19]。在本研究中也观察到了这种药物浓度依赖性;此外,我们还研究了头孢他啶对成熟生物膜的清除能力,但其对成熟生物膜的清除能力弱于对生物膜形成的抑制能力,这可能提示应用头孢他啶治疗早期铜绿假单胞菌感染可防止生物膜在体内定植。
本研究发现,米卡芬净与亚抑菌浓度的头孢他啶联合抑制铜绿假单胞菌生物膜形成表现出拮抗作用,联合用药抑制生物膜效果差于米卡芬净单用,且与高浓度头孢他啶联合时有3株也表现出拮抗作用,对成熟生物膜的清除效果弱于米卡芬净单用,但有1株菌(PA04)表现出联合后的协同作用,这与Kissoyan等[12]报道一致,但Kissoyan等仅研究了1株临床菌株,造成此种差异作用可能与米卡芬净与头孢他啶联合的作用机制及不同菌株可能存在的耐药机制不同有关,目前尚无相关机制报道,仍需进一步深入研究。

