枯草芽孢杆菌分离鉴定及其对烟叶化学成分和吸味品质的影响
毛多斌,黄晓玉,周利峰,刘 强,陈芝飞,冯颖杰,黄 申,张俊岭*
1.郑州轻工业大学食品与生物工程学院,郑州高新技术产业开发区科学大道136号 450001 2.河南中烟工业有限责任公司技术中心,郑州经济技术开发区第三大街8号 450002 3.山西昆明烟草有限责任公司,太原市小店区大昌南路21号 030000
芽孢杆菌属(Bacillus)是土壤和植物生态环境的优势菌属之一,具有生长快、抗逆性强以及生物安全性高等特点[1-2]。研究发现,多种芽孢杆菌属(Bacillus)微生物能够释放挥发性物质,并对植物病原菌具有抑制作用[3-4]。枯草芽孢杆菌(Bacillus subtilis),是芽孢杆菌属的一种,因生物安全性高、无致病性以及具有产蛋白酶、淀粉酶等特性,被广泛应用于基础研究[5]、医药生产、植物抗病[6]及畜牧养殖等领域中。
在烟叶陈化进程中芽孢杆菌属(Bacillus)多为烟叶表面优势菌属[7-9],用该类微生物发酵烤烟[10]、雪茄烟[11]以及烟草浸提液[12]后,香气量和吸食品质都有明显提高。梁开朝等[13]筛选到一株蜡样芽孢杆菌(Bacilluscereus),用其发酵烟草浸提液5 d后,烟叶中2,3-丁二醇、苯乙酮以及乙酸丁酯等香气成分增加。吕欣等[14-15]筛选到包括芽孢杆菌(Bacillus sp.)在内的多株微生物,发酵55 g烟叶48 h后,烟叶感官品质明显提升。瞿娇娇等[16]从豆豉中分离出枯草芽孢杆菌(Bacillussubtilis),发酵烟叶15 d后,可减少杂气、降低刺激性。王芳等[17]从茅台酒致香微生物中筛选出枯草芽孢杆菌(Bacillussubtilis),发酵中、下部烟叶各1 kg,发酵20~25 d后增香效果明显。陈兴等[18]通过嗅香及感官评吸,从烟叶表面分离得到一株产香西姆芽孢杆菌(Bacillussiamensis),发酵烟叶48 h能有效改善烟叶的吸味品质。然而,利用上述芽孢杆菌属(Bacillus)微生物发酵烟叶存在发酵时间长、处理量小等问题,且其发酵机制尚未明确。为此,借助平板涂布法从初烤后烟叶表面分离筛选菌株,利用嗅香变化挑选出菌株H11,采用分子生物学方法对其进行鉴定,再将此菌株用于低等级烟叶的发酵处理,分析其对烟叶化学成分和吸味品质的影响,旨在开发新菌株并缩短发酵时间,为微生物发酵低等级烟叶提供技术参考。
1 材料与方法
1.1 材料、试剂和仪器
供试烟叶产地为平顶山,采收年份为2017年,等级为DCFB,由河南中烟工业有限责任公司技术中心提供。
Taq酶、DNA Marker DL10000购自日本Takara公司;DNA提取试剂盒RNeasy Mini Kit购自北京麦克罗科技有限公司;琼脂粉、酵母粉和蛋白胨购自英国Oxoid公司;氯化钠和无水乙醇等常规分析纯试剂购自上海麦克林生化科技有限公司。
每升液体LB培养基含酵母粉5 g,蛋白胨10 g,氯化钠10 g;固体LB培养基含酵母粉5 g,蛋白胨10 g,氯化钠10 g,琼脂粉20 g;再造烟叶浓缩液培养基含再造烟叶浓缩液200 mL。上述3种培养基经121℃高压灭菌25 min后用于菌种培养和发酵。
恒温培养箱DHP-9162(太仓市科教器械厂);恒温摇床TH2-C(太仓市试验设备厂);GC-MS色谱联用仪6890a(美国Agilent公司);连续流动分析仪AA3(德国SEAL公司);PCR仪2720 thermal cycler(美国Applied Biosystems公司);显微镜DM6B(德国徕卡公司)。
1.2 方法
1.2.1 菌株筛选
采集河南省三门峡市陕州区烟叶种植基地不同品种的初烤后烟叶样品30个,各取5 g烟叶,加入100 mL无菌水,在30℃、150 r/min条件下震荡培养2~4 h,将其按照体积分数1%接种至液体LB培养基培养6~8 h。将得到的富集菌液按照6个稀释梯度(10-1、10-2、10-3、10-4、10-5和10-6)稀释后分别涂布到固体LB培养基平板上,28℃倒置培养2 d。从平板上挑选单菌落,采用平板划线法获得纯菌。将分离到的微生物接种至再造烟叶浓缩液培养基中,28℃、150 r/min震荡培养24 h,利用嗅香变化筛选菌株。
1.2.2 菌种鉴定
用细菌基因组提取试剂盒提取菌株的基因组DNA。以该基因组DNA为模板,利用通用引物27-F/1492-R和gyrB-34-F/gyrB-977-R分别对16S rDNA基因和gyrB基因进行PCR扩增。随后将PCR扩增产物与pMD18-T载体进行连接,将阳性克隆送生工生物工程(上海)有限公司测序。将测序得到的序列提交NCBI数据库,使用NCBIBlast在线工具与数据库中已有的细菌16SrDNA序列以及gyrB序列进行比对分析,获得相似性较高的序列信息,并建立系统发育树,最终明确筛选微生物的分类地位。
1.2.3 烟叶发酵处理
经筛选鉴定的菌株在液体LB培养基中扩大培养,当OD600nm为0.8~1.2时将菌液于4℃、10 000 r/min条件下离心10 min,弃上清,用等量无菌水重悬,获得种子液。按照接种量6.3×107CFU/g将3 L种子液均匀喷洒到20 kg烟叶表面,装于密封袋,放置于温度为35℃湿度80%的恒温恒湿房中发酵30 h。不做任何处理的烟叶为CK 1,加等量无菌水相同条件处理的烟叶为CK 2。
1.2.4 感官评价
样品和对照烟叶的切丝、烘丝在郑州烟草研究院中试车间进行,单料烟样品在河南中烟驻马店卷烟厂制作。由河南中烟技术中心13名专业评吸人员组成评吸小组,采用对比评吸方式和九分制单料烟评吸标准进行感官评价[18]。
1.2.5 烟叶常规成分测定
参照YC/T 160—2002[19]、YC/T 161—2002[20]、YC/T 159—2002[21]、YC/T 217—2007[22]以及YC/T 162—2011[23]的标准,用连续流动分析仪分别测定发酵前后烟叶中的化学成分(烟碱、总氮、水溶性总糖、还原糖、钾和氯)。每个待测样品各指标测定3次,取平均值。
1.2.6 烟叶中性香味成分测定
采用同时蒸馏萃取法分离中性香味成分。称取烟叶粉末30 g放入1 000 mL的圆底烧瓶中,加入4粒沸石和400 mL去离子水,将100 mL的二氯甲烷倒入圆底烧瓶中。同时蒸馏萃取2.5 h后,将得到的萃取液进行酸碱萃取,得到中性萃取液后,加入适量的无水硫酸钠进行干燥过夜,再加入100μL 2,6-二氯甲苯作为内标,蒸馏浓缩至1 mL,进行GC/MS检测分析。分析条件为:色谱柱:HP-5MS毛细管柱(60 m×250μm×0.25μm);进样口温度:240℃;进样量1.0μL;载气:He;流速:1.0 mL/min;分流比:不分流;升温程序:50℃下保持4 min,3℃/min升至70℃并保持5 min,2℃/min升至100℃并保持17 min后,继续升温至120℃保持10 min,再以6℃/min升至280℃。质谱条件:电离方式为电子轰击(EI),电子能量70 eV;溶剂延迟10 min;全扫描检测,扫描质量范围(m/z)35~500 amu。烟叶中性香味成分的GC检测结果利用NIST20标准谱库进行检索,结合标准样品的GC保留时间和烟草中化学成分进行定性分析。对有标准样品的香味成分采用GC内标工作曲线法定量,没有标准样品的香味成分采用峰面积相对定量法(化合物峰与内标峰面积之比)定量。
1.2.7 菌株基因组测定及分析
将筛选得到的菌株从-80℃冰箱中取出进行活化,将活化好的菌液离心,弃去上清液,保留沉淀。PCR引物合成和DNA测序均由生工生物工程(上海)有限公司完成。使用HiSeq测序仪(美国Illumina公司)进行测序。为了校正原始数据中序列,首先用SPAdes软件对原始序列进行校正,然后综合Kmer值,填补拼接后重叠群并对其矫正。采用Blast算法比较两段核酸或者蛋白序列之间的相似性。将蛋白序列与CAZy数据库进行比较。
1.2.8 烟叶表面微生物宏基因组测定及分析
将用到的量筒、纱布、三角瓶和剪刀等器材全部进行高温灭菌处理(121℃,20 min)。称取样品烟叶和对照烟叶各40 g剪碎后置于500 mL的磷酸盐缓冲溶液(PBS,0.1 M、pH 7.0)中,在37℃、200 r/min的摇床上震荡30 min。震荡结束后,在超净工作台中将震荡后的PBS溶液用双层纱布过滤,重复两次,去除PBS中的杂质。将过滤后的PBS溶液在4℃、10 000 r/min的条件下离心10 min,将微生物富集到离心管底部,弃去上清,沉淀置于-80℃低温冷冻保存。
采用Ezup柱式细菌基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司]对其沉淀微生物进行DNA提取。以提取的总DNA为模板,利用通用引物27-F/765-R对DNA的V区进行PCR扩增。PCR的最终产物用1%的琼脂凝胶电泳检测。并用荧光试剂对PCR扩增回收产物进行定量分析。根据荧光定量结果,按照每个样本的测序量需要,对各样本按相应比例进行混合。使用MiSeq测序仪(美国Illumina公司)进行双端测序。测序完成后进行数据分析,首先获得拼接成的Tags数据,将拼接的Tags经过优化后,在97%相似度下将序列聚类为操作分类单元(Operational taxonomic units,OTUs)。
2 结果与分析
2.1 菌种的筛选与鉴定
2.1.1 菌株的筛选
共从初烤后烟叶中分离筛选出16株菌株,编号分别为H1、H2、H3~H16,分别接种至再造烟叶浓缩液培养基中,在28℃,150 r/min条件下培养24 h,根据发酵前后嗅香变化,发现菌株H11嗅香变化明显,因此选定H11为烟草发酵候选菌株。
2.1.2 菌株的鉴定
2.1.2.1 菌株的形态鉴定
将菌株H11接种至LB固体培养基上培养36 h后(图1A),菌落表面有光泽、边缘整齐,染色后在普通光学显微镜(×100油镜)下观察,菌体呈丝状,菌体长为2μm左右(图1B),为革兰氏阳性菌。
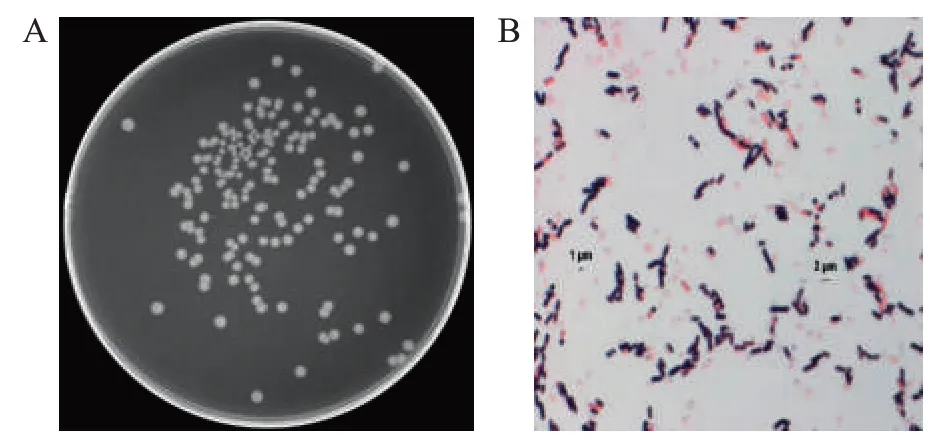
图1 菌株H11菌落及细胞形态Fig.1 Colony and cell morphology of strain H11
2.1.2.2 菌株H11的系统发育分析
扩增测序得到菌株H11的16SrDNA基因长度为1 427 bp,经GenBank数据库中同源分析后发现,菌株H11与枯草芽孢杆菌亚种(B.subtilis subsp.)的同源性在94%以上。下载相似度较高的相关菌株序列并构建系统发育树(图2),结果表明,菌株H11与枯草芽孢杆菌亚种(B.subtilis subsp.)的多个已知菌株序列聚类为一个独立分支,表明菌株H11属于芽孢杆菌属(Bacillus)。
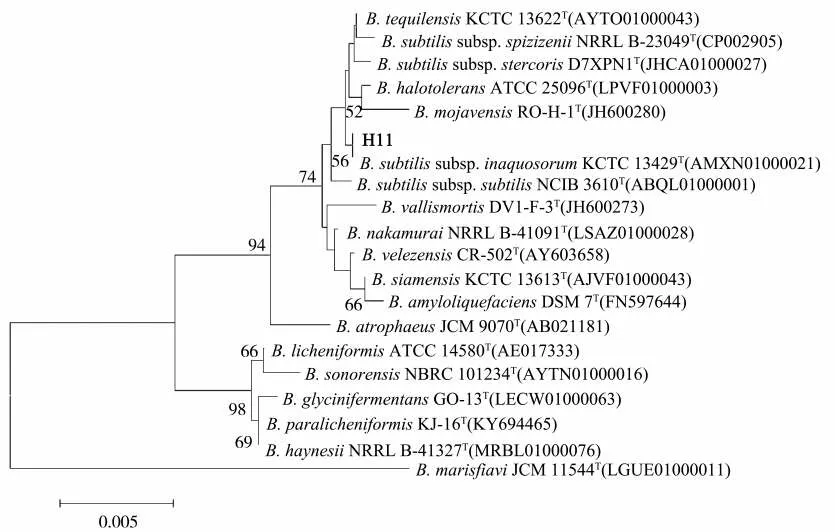
图2 菌株H11 16Sr DNA区域序列系统发育树Fig.2 Phylogenetic tree of 16S r DNA region sequence of strain H11
扩增测序获得菌株H11的gyrB基因,长度为907 bp。将该序列在GenBank数据库中进行同源分析后发现,菌株H11与枯草芽孢杆菌枯草亚种(B.subtilis subsp.subtilis)的同源性为100%。构建系统发育树后分析结果(图3)表明,菌株H11与枯草芽孢杆菌枯草亚种(B.subtilis subsp.subtilis)聚为一个单独分支,初步鉴定该菌株属于枯草芽孢杆菌枯草亚种(B.subtilis subsp.subtilis)。
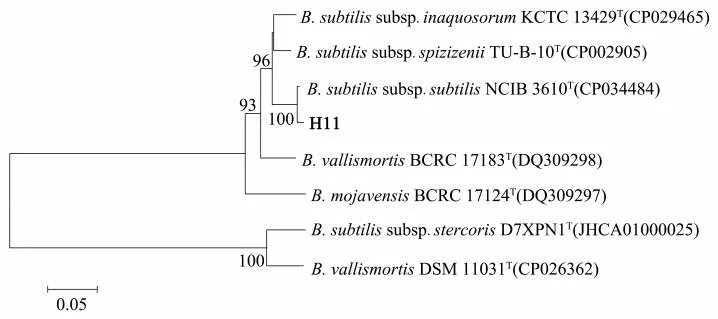
图3 菌株H11基于gyr B基因序列的系统发育树Fig.3 Phylogenetic tree of strain H11 based on gyr B gene sequence
2.2 发酵前后单料烟的评吸结果
发酵前后烟支感官评吸结果见表1。与对照相比,H11菌株发酵后香气质有所改善,甜感和香气量得分都有所增加,刺激性明显下降,劲头有所减少,余味尚干净。发酵后烟叶总体得分比CK 1高1.2分,比CK 2高1.4分,说明H11发酵后烟叶的整体品质有所提升。
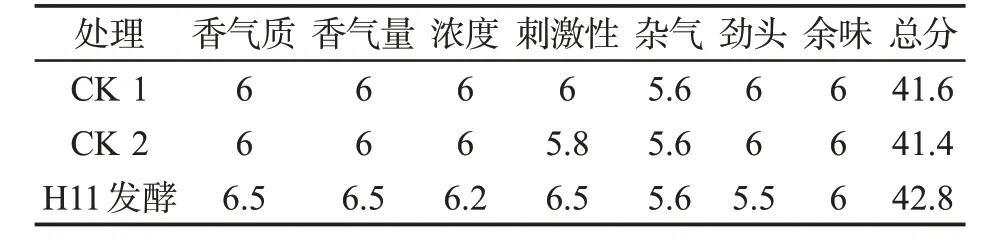
表1 感官质量评吸结果Tab.1 Results of sensory quality assessment(分)
CK 2相比CK 1刺激性略大,整体评分少0.2分,可能是烟叶自身微生物作用的结果,因此后续实验样品不再与CK 2进行比较。
2.3 烟叶发酵前后理化指标变化
2.3.1 烟叶常规成分
发酵前后烟叶化学成分测定结果如表2所示。相比CK 1,经H11菌株发酵后,烟叶常规化学成分中的水溶性总糖、还原糖含量(质量分数)变化明显,烟碱、总氮、钾和氯的含量(质量分数)变化不明显。水溶性总糖增加可能是淀粉水解的结果所致。其中水溶性总糖含量和还原糖含量分别上升了2.52%和1.92%。还原糖含量的增加,使得H11菌株发酵后烟叶中的糖碱比增加,吸味品质提升。水溶性总糖和还原糖含量增加可提升烟气醇和度。
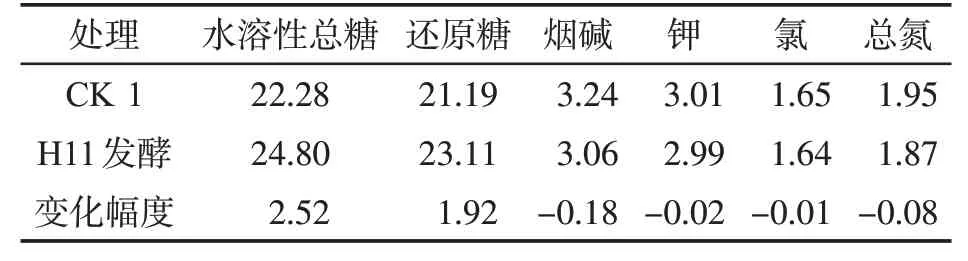
表2 H11发酵前后烟叶常规成分变化Tab.2 Variations of routine components in tobacco leaves from Pingdingshan before and after H11 fermentation(%)
2.3.2 烟叶中性香味成分
发酵前后烟叶的中性香味成分结果见表3,检测到中性香味成分26种,其按官能团分类结果见图4。
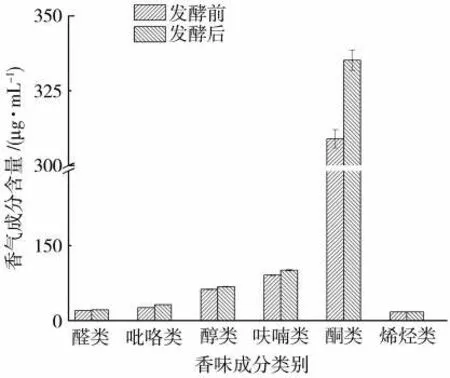
图4 烟叶发酵前后香味成分含量变化Fig.4 Variations of aroma components in tobacco leaves before and after fermentation
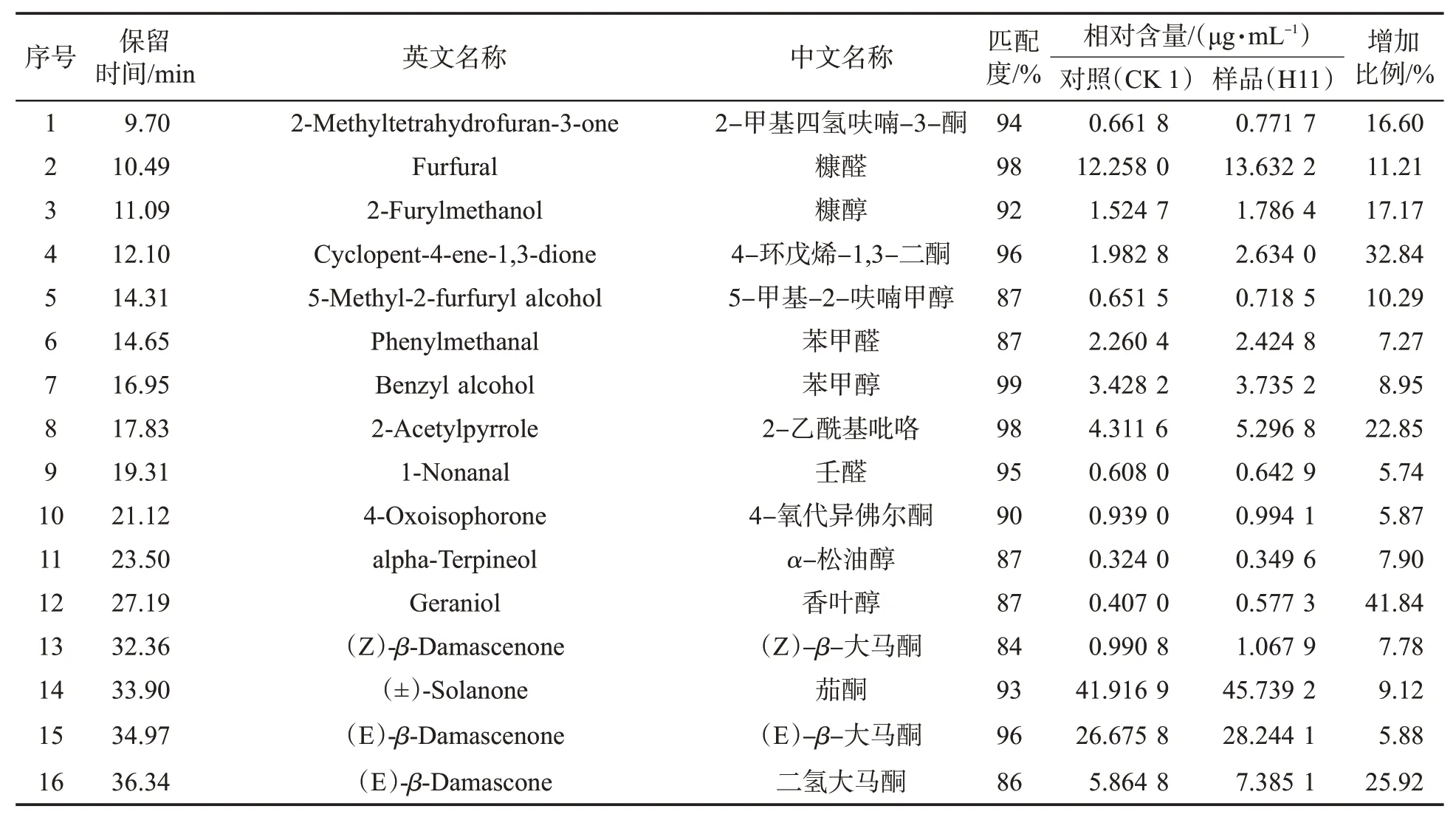
表3 H11发酵对香味成分的影响Tab.3 Effects of H11 fermentation on aroma components
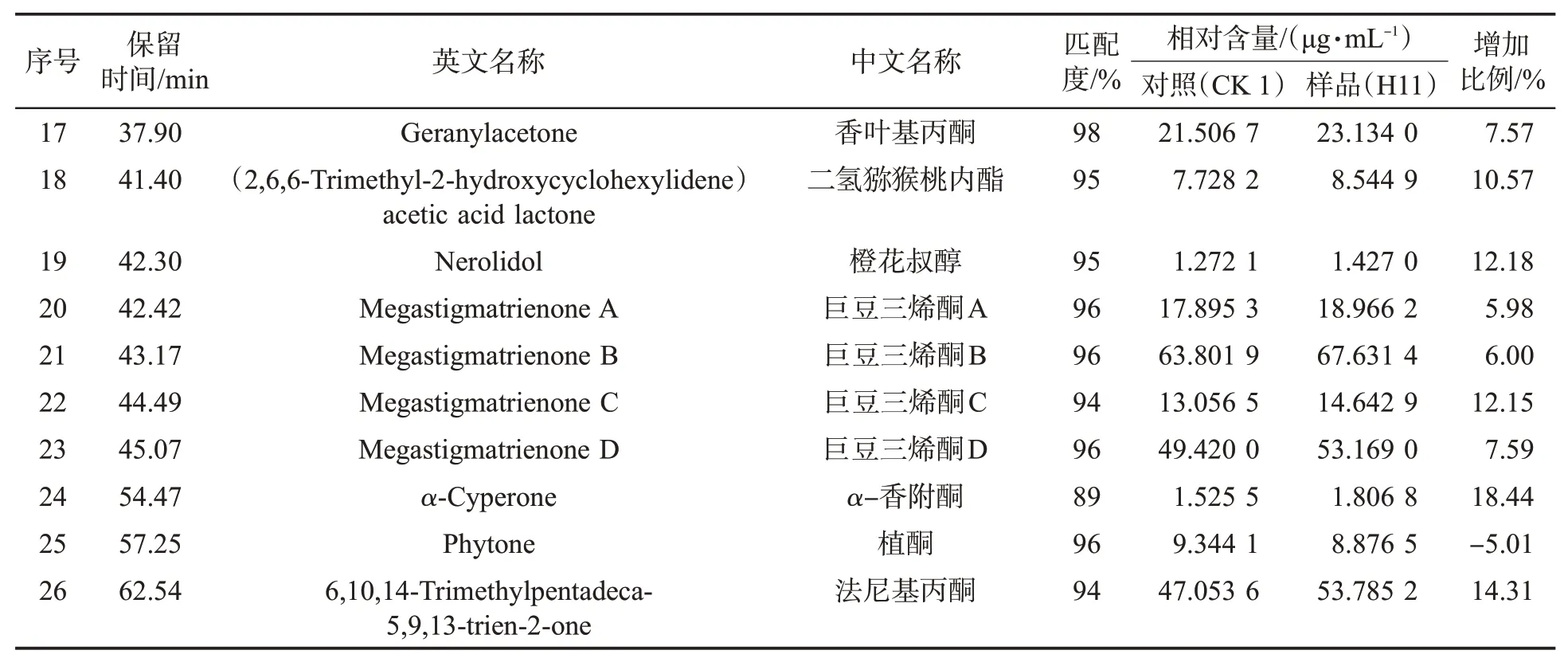
表3(续)
由表3可见,多种香味成分含量均有不同程度的提升。发酵前后茄酮含量分别为41.916 9μg/mL和45.739 2μg/mL,增加了9.12%;(E)-β-大马酮含量分别为5.864 8μg/mL和7.385 1μg/mL,增加了25.92%;二氢猕猴桃内酯含量分别为7.728 2μg/mL和8.544 9μg/mL,增加了10.57%;巨豆三烯酮C含量分别为13.056 5μg/mL和14.642 9μg/mL,增加了12.15%;法尼基丙酮含量分别为47.053 6μg/mL和53.785 2μg/mL,增加了14.31%。这些成分含量的增加提升了烟气品质,与感官评吸结果一致。
由图4可见,发酵后烟叶的醇类、酮类和醛类香味成分含量均有不同程度增加。醛类、酮类、醇类和呋喃类香味成分含量分别增加了6.5%、8.5%、8.2%和10.7%,上述成分的提高有利于提高烟叶的吸味品质。
2.4 烟叶表面微生物变化分析
2.4.1 烟叶表面微生物OTU丰度分析
为探究发酵前后烟叶表面微生物的群落变化,采用OTU统计工具中的维恩(Venn)图进行群落分析。如图5所示,2个样品中细菌在多样性OTU聚类后有253(15.14%)个是共有的,对照样品CK1有844(50.51%)个为独有;H11发酵的样品有574(34.35%)个为独有。H11菌发酵后的样品细菌种类数量减少270个,占OTUs总数的24.61%。
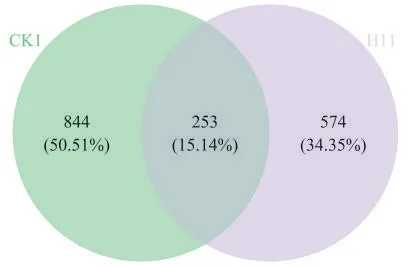
图5 烟叶表面微生物操作分类单元(OTU)Venn图Fig.5 Venn diagram of microbial operational taxonomic units(OTUs)on tobacco leaves
为进一步分析维恩图中各个区域的物种丰度组成,在门和属水平上统计每个区域相应OTU的丰度。由图6可见,对照烟叶中优势菌门为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes),分别占总的高质量序列的81%、11%和4%,其中变形菌门为主要的优势菌门。用H11发酵后的烟叶中厚壁菌门(Firmicutes)相对丰度最高,为90%。由图7可见,对照烟叶中优势菌属为假单胞菌属(Pseudomonas),但用H11发酵后烟叶中芽孢杆菌属(Bacillus)成为丰度最高的属,其相对丰度为76%。由此可见,用H11发酵可明显改变烟叶表面微生物的多样性,其中厚壁菌门和芽孢杆菌属微生物占优势。
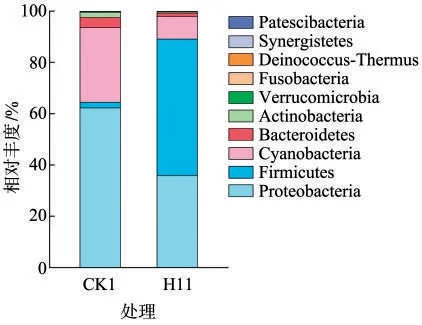
图6 发酵前后烟叶表面微生物门水平的相对丰度柱状图Fig.6 Relative abundances(phylum level)of microorganisms on tobacco leaves before and after fermentation
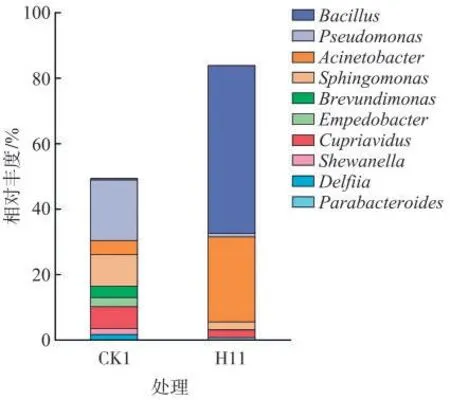
图7 发酵前后烟叶表面微生物属水平的相对丰度柱状图Fig.7 Relative abundances(genus level)of microorganisms on tobacco leavesbeforeand after fermentation
2.4.2 烟叶表面微生物物种组成热图分析
在属水平上将细菌群落组成按照其在样品中的相对丰度大小排序,并选择排名前20的属绘制物种丰度聚类热图(图8)。经H11发酵后的烟叶表面大多数细菌属的相对丰度都有所减少,而芽孢杆菌属(Bacillus)的相对丰度增加较为明显,说明H11对烟叶表面微生物组成有较大的影响,并对其他菌属有抑制作用。
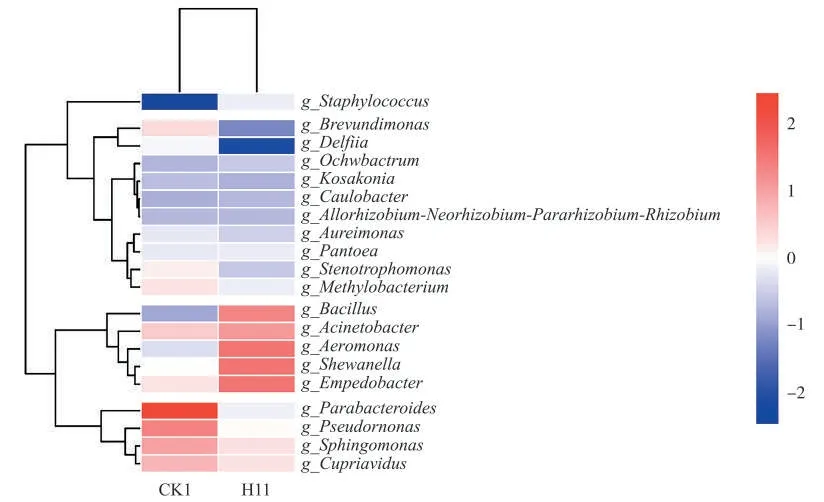
图8 属水平上发酵前后烟叶表面微生物分布热图Fig.8 Heat map of distribution(genus level)of microorganisms on tobacco leaves before and after fermentation
2.5 枯草芽孢杆菌枯草亚种碳水化合物活性酶分析
分析菌株H11基因组后发现,该菌株基因组中具有725 520 bp碱基,共编码7 960个基因。将菌株H11的蛋白序列与CAZy数据库进行比对,得到其对应的碳水化合物活性酶注释信息共284条(图9)。推测参与烟叶增香提质的关键酶主要为糖苷水解酶(GH)、氧化还原酶(AA)和糖类酯解酶(CE)(表4)。
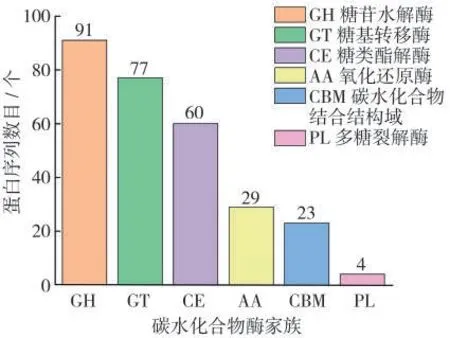
图9 枯草芽孢杆菌枯草亚种碳水化合物活性酶(CAZy)分类统计Fig.9 Classification and statistics of carbohydrate active enzymes(CAZy)in Bacillus subtilis subsp.subtilis
由表4可见,菌株H11具有过氧化氢酶、过氧化物酶、4-羟基苯乙酮单加氧酶、α-淀粉酶以及纤维素酶等碳水化合物活性酶。在酶促作用下,烟叶中的大分子物质如淀粉、蛋白质、β-胡萝卜素、叶黄素和西柏烯发生降解,生成香味物质,对吸味品质的提升起到重要的作用。
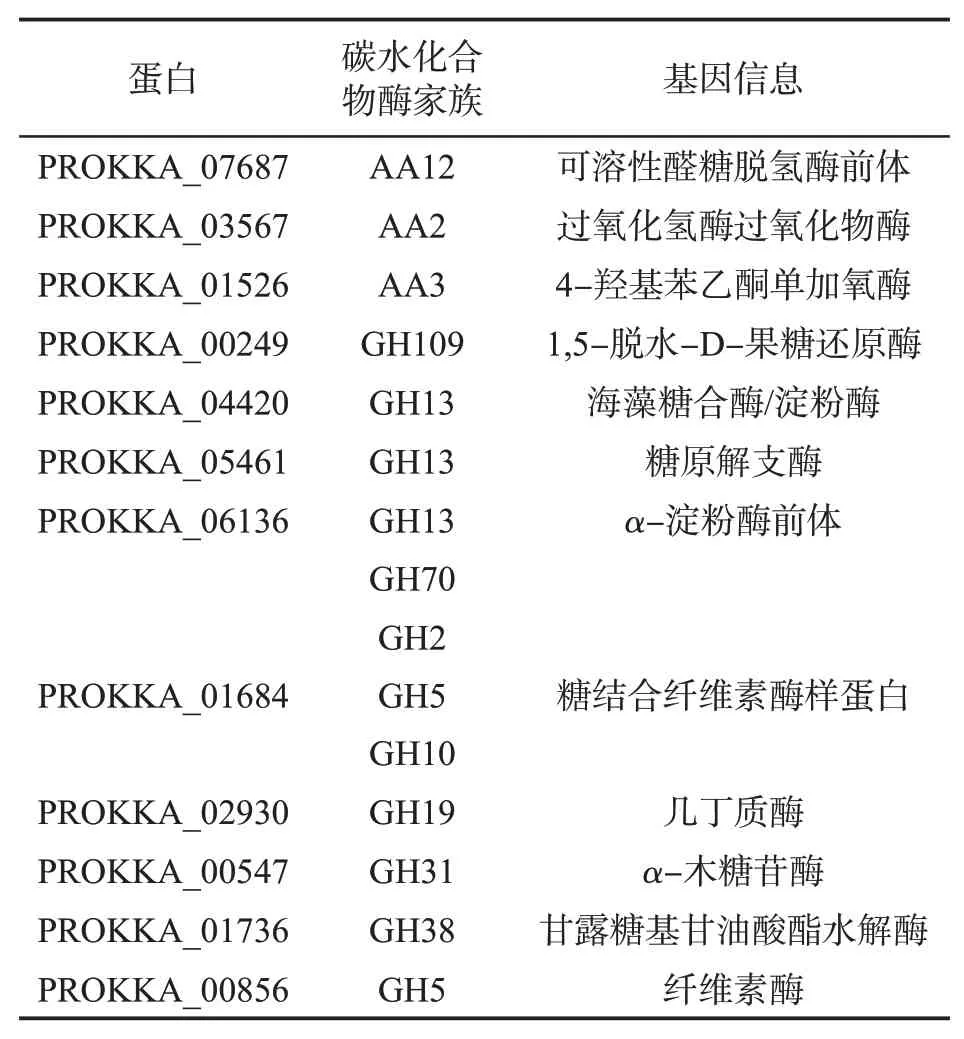
表4 枯草芽孢杆菌枯草亚种关键碳水化合物活性酶信息Tab.4 Information of key carbohydrate activity enzymes in Bacillus subtilis subsp.
常规成分分析结果显示,发酵后烟叶中水溶性糖和还原糖的含量增加。与对照相比,发酵后烟气更醇和,香气质也有提升。原因可能是H11中存在α-淀粉酶将淀粉水解成水溶性糖和还原糖,有利于提高烟气醇和度,且糖类成分与氨基酸缩合生成烟叶香气前体物,还能提升烟叶香气品质[25];对比分析发酵前后烟叶中性香味成分变化,发酵后烟叶中的茄酮、二氢大马酮、二氢猕猴桃内酯、巨豆三烯酮和金合欢基丙酮等香味成分含量增加。评吸结果显示,H11发酵后香气质提升、香气量增加。
3 讨论
从初烤后烟叶中筛选到一株枯草芽孢杆菌枯草亚种,用其发酵河南平顶山2017年产DCFB烟叶后,评吸结果显示增香提质效果明显,这与瞿娇娇等[16]对枯草芽孢杆菌(Bacillus subtilis)烟叶增香提质效果的研究结果一致。烟叶香气质的提升主要表现为重要致香成分的增加,另外还可能与其他成分的减少有关。枯草芽孢杆菌发酵烟叶后对吸食品质产生有益影响,发酵后烟叶中香叶基丙酮、二氢猕猴桃内酯和巨豆三烯酮C等香味成分含量均有不同程度的增加,这可能是类胡萝卜素、糖苷以及西柏烯等香气前体物发生降解,增加了烟叶中小分子致香物质的总量,进而整体提高了感官品质[26]。前人研究发现,枯草芽孢杆菌发酵烟叶存在发酵时间长,发酵量小的问题。杨培香等[27]在枯草芽孢杆菌(Bacillussubtilis)Van3菌株提高烟丝品质的研究中将40 mL菌液喷施于200 g烟叶表面,并在22℃、60%的恒温恒湿条件下发酵烟叶,30 d后香气量增加,品质提升。本研究中发现的菌株H11发酵20 kg烟叶仅30 h时即能达到增香提质的作用,大大缩短了发酵时间,扩大了发酵量。
H11菌株关键酶有纤维素酶和α-淀粉酶等,其中α-淀粉酶可以水解淀粉,从而使水溶性糖和还原糖含量增加,糖类成分又可与氨基酸发生反应,生成对烟叶香气有贡献的物质,进而改善烟叶的香气品质。
菌株H11发酵烟叶后,烟叶表面微生物多样性减少,芽孢杆菌属(Bacillus)微生物丰度显著升高,这与黄亚丽等[28]在枯草芽孢杆菌菌剂不同施用方式对甜瓜土壤微生物多样性及生长影响的研究结果相似。
4 结论
从初烤后烟叶中筛选出一株新的增香提质的微生物菌株H11,经形态学和分子生物学鉴定为枯草芽孢杆菌枯草亚种(Bacillus subtilis subsp.subtilis)。对河南平顶山2017年产DCFB烟叶用H11发酵30 h后,烟叶甜感增强、香气质提升、香气量增加,吸味品质改善明显。对比分析烟叶发酵前后常规成分、中性香味成分和烟叶表面微生物种群变化,结果表明:发酵后烟叶水溶性糖、还原糖含量分别增加了2.52%、1.92%;(E)-β-大马酮、二氢猕猴桃内酯和巨豆三烯酮C等香味成分含量分别增加了25.92%、10.57%和12.15%;经H11发酵后,烟叶表面微生物多样性有所减少,H11芽孢杆菌属(Bacillus)微生物丰度大幅度增加。与已报道的相关烟叶发酵技术相比,菌株H11发酵工艺用时更短、发酵量更大,具有更好的工业应用潜力。

