苏木提取物对动脉粥样硬化模型ApoE-/-小鼠氧化应激作用及对p38/JNK/ERK的影响
★ 范增光 袁野(江西中医药大学附属医院 南昌 330006)
动脉粥样硬化(atherosclerosis,AS)是由氧化应激、炎症反应、免疫失衡、脂质浸润等多种机制共同参与的一类慢性疾病,是诱发心脑血管疾病发生发展的重要原因[1-3]。现今人们不健康的生活方式(如生活、工作压力过大、高脂肪饮食、缺乏运动等)均可导致体内脂质代谢紊乱,诱发细胞氧化应激、局部炎症反应,继而导致AS的形成[4]。随着AS的不断进展可引起急性心脑血管事件和慢性损害(如心肌梗死、卒中、外周动脉等疾病),严重危害人类健康[5-6]。全球流行病学统计,每年因AS相关疾病死亡人数可达2 000余万[7]。因此,深入研究AS的发病机制,并以此为靶点延缓,甚至逆转AS进程,是降低心脑血管疾病发生发展的关键。氧化应激是指机体内活性氧(ROS)聚集过多,而体内清除氧自由基与氧化物质失衡,进而促使组织细胞氧化损伤。近年来,氧化应激在AS中的作用备受人们关注,众多研究显示,氧化应激可以通过促进泡沫细胞产生、促进AS斑块破裂、引起血管内皮细胞损伤等途径参与、促进AS的形成,是AS发生发展的重要机制之一[8-10]。ROS积累引起的氧化应激可以通过MAPK成员的磷酸化来启动MAPK信号转导,其中哺乳动物细胞中的三个主要MAPK亚家族是p38、JNK、ERK参与了ROS的产生,可以通过促进细胞凋亡等途径诱发或加重AS[11-13]。本课题组前期研究证实了苏木是一种具有免疫抑制、抗氧化、抗炎、抗心脏移植排斥反应、保护血管等多方面的作用的药物[14-17]。但是具体的机制尚未完全阐述清楚,因此,本研究建立AS小鼠模型,观察苏木提取物对氧化应激的影响,并明确与p38/JNK/ERK信号通路的关系,进而探讨苏木提取物抗AS的作用机制。
1 材料和方法
1.1 实验动物
8周龄雄性ApoE-/-小鼠40只和相同基因背景的8周龄雄性C57BL/6J小鼠10只,体重在18~21 g左右,许可证号SCXK(京)2016-0006,均购于北京维通利华实验动物技术有限公司。饲养于清洁级动物实验室,调节温度20~25 ℃,湿度(55±15)%,风速0.1~0.2 m/s,12 h循环照明。
1.2 实验药物
苏木提取物制备:取苏木生药,产地为云南,购于黑龙江省药材公司,由黑龙江中医药大学药学院提取和制备。具体方法:经生药鉴定制成40目苏木粗粉并浸泡浓度为75%乙醇溶液中4 h,经重复回流2次,去渣,加热至85 ℃,水浴蒸干制成干粉,将提取的干粉加入双蒸水中充分混匀得到混悬液,然后使用乙酸乙酯进行萃取,即得到苏木提取物。
1.3 实验试剂与仪器
油红O染液(南京建成生物工程研究所)、4%多聚甲醛(武汉塞维尔公司)、ELISA试剂盒(碧云天生物)、p38、JNK、ERK抗体(德国CST公司)。石蜡切片机(德国Leica公司)、石蜡包埋机(德国Leica公司)、液氮罐(中国四川乐山东亚公司)、移液枪(德国Eppendorf公司)、离心机(常州峥嵘仪器有限公司)、4 ℃冰箱(青岛海尔股份有限公司)、-80 ℃超低温冰箱(中科美菱)、显微镜(广州明美光电技术有限公司)等。
1.4 动物分组
小鼠适应性饲养2周后,将10只C57BL/6J小鼠设为空白组;40只ApoE-/-小鼠随机分为,模型组、苏木提取物低剂量组,苏木提取物中剂量组,苏木提取物高剂量组,每组10只。
1.5 模型制备
小鼠适应性喂养2周后,采用高脂饮食喂养复制动脉粥样硬化模型:C57BL/6J小鼠继续给予普通饲料喂养;ApoE-/-小鼠给予高脂饲料(含15%可可脂、2.5%胆固醇)喂养8周建立动脉粥样硬化模型。
1.6 动物给药
根据课题组前期实验结果及人小鼠换算公式给药,小鼠的给药剂量=人的剂量(mg/kg)×人的体重(kg)×换算系数(0.002 6)/所求动物的体重(kg)。配制成为5‰的羧甲基纤维素钠溶液(CMC-Na)。于实验的第9周对各组小鼠进行灌胃,时间为4周。具体方法如下:(1)空白组:等体积的5‰ CMC-Na(0.1 mL/10 g)灌胃;(2)模型组:等体积的5‰ CMC-Na(0.1 mL/10 g)灌胃;(3)苏木提取物低剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量0.83g/(kg·d);(4)苏木提取物中剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量1.66 g/(kg·d);(5)苏木提取物高剂量组:苏木混悬剂(0.1 mL/10 g)灌胃,相当于生药量3.32 g/(kg·d)。
1.7 标本取材与指标检测
于实验的第12周末,小鼠禁食12 h,不禁水,10%水合氯醛(0.1 mL/10 g)腹腔注射麻醉,摘取眼球取血,3 000 r/min,离心10 min,分离血清;剥离主动脉,并将周围的组织剔除干净,取主动脉根部,用4%多聚甲醛溶液固定,用石蜡包埋标本,切片备用。
1.8 油红O染色观察主动脉窦脂质沉积情况
主动脉根部制备石蜡切片,油红O染色液中染色10 min,清水冲洗2 min,75%乙醇分化,清水冲洗5 min,将切片放入苏木素中3~5 min,对细胞核进行染色,清水反复冲洗切片,将切片放置于分化液中进行分化5 s,流水冲洗,直至细胞核的颜色变为深蓝色,而细胞浆无颜色,然后吸干并加入适当的甘油明胶进行封片,显微镜下观察主动脉窦的脂质沉积情况并拍照。
1.9 ELISA检测主动脉MDA、GSH-Px、SOD水平
按ELISA试剂盒说明书的步骤,检测MDA、GSH-Px、SOD的含量。
1.10 Western Blot法检测主动脉p-p38、p-JNK、p-ERK蛋白表达
取小鼠主动脉组织匀浆,进行总蛋白的提取。根据BCA蛋白质浓度测定试剂盒说明书测定样品蛋白浓度。取40 μg蛋白,在SDS/PAGE中以分离胶电压按120 V、浓缩胶电压按50 V进行恒压电泳。100 V恒压转膜,并根据靶蛋白的分子量大小调整。转膜结束后,取下支架,将转好的膜放入封闭液中,室温下封闭1 h;弃去封闭液,加入已稀释的一抗缓冲液中,4 ℃过夜;回收已稀释好的一抗,室温下TBST漂洗3次,每次5 min;加入稀释好的二抗,室温下培养30 min,室温下TBST在摇床漂洗4次,每次5 min。在NC膜的蛋白面侧滴加超敏ECL显色液,暗室中操作;将胶片依次显影、定影后,用Image J软件计算各条带的密度值,以目的条带密度值与内参(GAPDH)密度值的比值,作为其相对表达量。
1.11 统计学方法
应用SPSS 23.0软件对实验数据进行统计分析,计量资料以均数±标准差(±s)表示,统计方法采用单因素方差分析(One-Way ANOVA),方差齐者行LSD检验,方差不齐者行Dunnett's T3检验。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 对小鼠主动脉窦脂质沉积水平的影响
空白组小鼠主动脉窦未见脂质斑块的形成;与空白组比较,模型组小鼠主动脉窦有大量的脂质斑块形成;与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组主动脉窦脂质斑块均有不同程度的下降。见图1。

图1 各组小鼠主动脉窦油红O染色结果(×200)
2.2 对小鼠主动脉MDA表达的影响
与空白组比较,模型组小鼠主动脉MDA表达升高,差异具有显著统计学意义(P<0.01);与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组MDA表达降低,差异具有统计学意义(P<0.05、P<0.01),见表1和图2。
表1 各组小鼠主动脉MDA表达比较( ±s,n=10)nmol/mg

表1 各组小鼠主动脉MDA表达比较( ±s,n=10)nmol/mg
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 MDA空白组 2.281±0.210模型组 4.140±0.115**苏木提取物低剂量组 3.969±0.095#苏木提取物中剂量组 3.570±0.148##苏木提取物高剂量组 3.254±0.111##
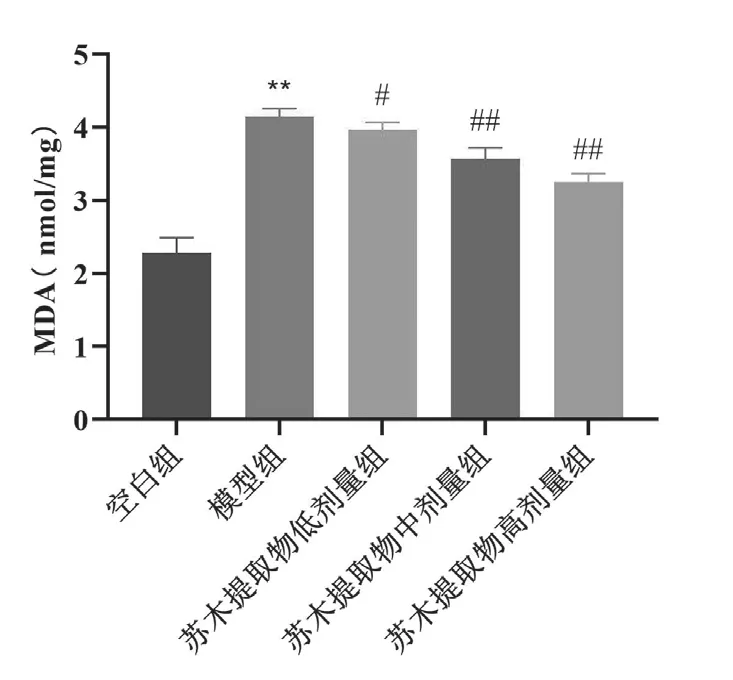
图2 各组小鼠小鼠主动脉MDA表达水平比较
2.3 对小鼠主动脉GSH-Px、SOD表达的影响
与空白组比较,模型组小鼠主动脉GSH-Px、SOD表达降低,差异具有显著统计学意义(P<0.01);与模型组比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组MDA表达升高,差异具有统计学意义(P<0.05、P<0.01),见表2和图3。
表2 各组小鼠主动脉GSH-Px、SOD表达比较( ±s,n=10)
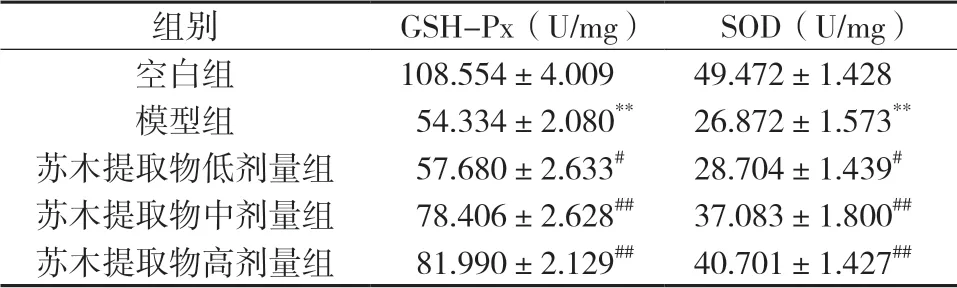
表2 各组小鼠主动脉GSH-Px、SOD表达比较( ±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05、##P<0.01。
组别 GSH-Px(U/mg) SOD(U/mg)空白组 108.554±4.009 49.472±1.428模型组 54.334±2.080** 26.872±1.573**苏木提取物低剂量组 57.680±2.633# 28.704±1.439#苏木提取物中剂量组 78.406±2.628## 37.083±1.800##苏木提取物高剂量组 81.990±2.129## 40.701±1.427##
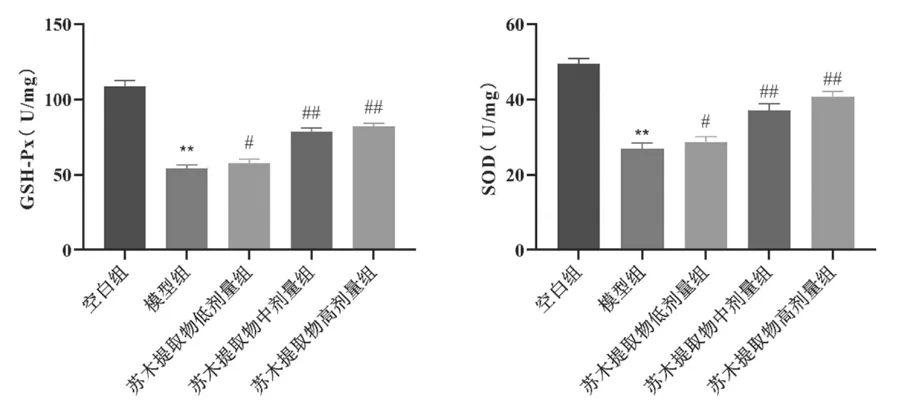
图3 各组小鼠小鼠主动脉GSH-Px、SOD表达水平比较
2.4 对小鼠主动脉p-p38蛋白表达的影响
与空白组比较,模型组p-p38蛋白表达水平升高,差异具有显著统计学意义(P<0.01);与模型比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组p-p38蛋白表达水平降低,差异具有显著统计学意义(P<0.05,P<0.01),见表3和图4。
表3 各组小鼠主动脉p-p38蛋白表达比较( ±s,n=10)
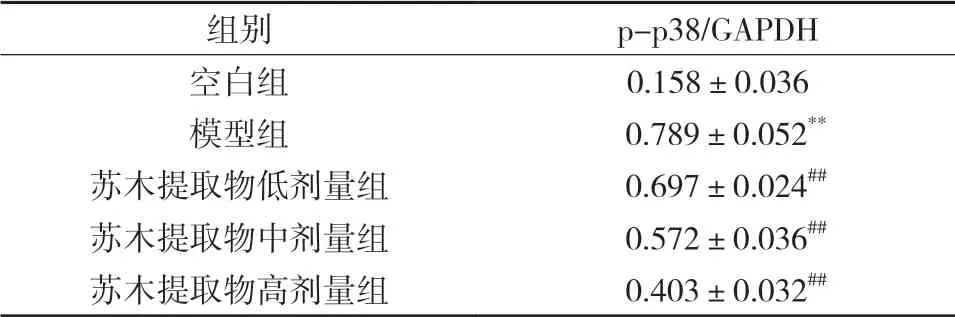
表3 各组小鼠主动脉p-p38蛋白表达比较( ±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 p-p38/GAPDH空白组 0.158±0.036模型组 0.789±0.052**苏木提取物低剂量组 0.697±0.024##苏木提取物中剂量组 0.572±0.036##苏木提取物高剂量组 0.403±0.032##

图4 各组小鼠主动脉p-p38蛋白表达比较
2.5 对小鼠主动脉p-JNK蛋白表达的影响
与空白组比较,模型组p-JNK蛋白表达水平升高,差异具有显著统计学意义(P<0.01);与模型比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组p-JNK蛋白表达水平降低,差异具有显著统计学意义(P<0.05,P<0.01),见表4和图5。
表4 各组小鼠主动脉p-JNK蛋白表达比较( ±s,n=10)

表4 各组小鼠主动脉p-JNK蛋白表达比较( ±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 p-JNK/GAPDH空白组 0.145±0.012模型组 0.900±0.027**苏木提取物低剂量组 0.870±0.015#苏木提取物中剂量组 0.619±0.034##苏木提取物高剂量组 0.527±0.031##
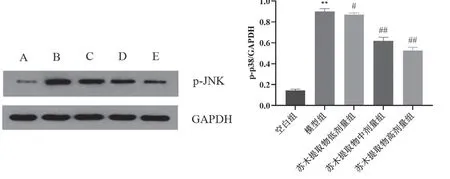
图5 各组小鼠主动脉p-JNK蛋白表达比较
2.6 对小鼠主动脉p-ERK蛋白表达的影响
与空白组比较,模型组p-ERK蛋白表达水平升高,差异具有显著统计学意义(P<0.01);与模型比较,苏木提取物低剂量组、苏木提取物中剂量组、苏木提取物高剂量组p-ERK蛋白表达水平降低,差异具有显著统计学意义(P<0.05,P<0.01),见表5和图6。
表5 各组小鼠主动脉p-ERK蛋白表达比较( ±s,n=10)
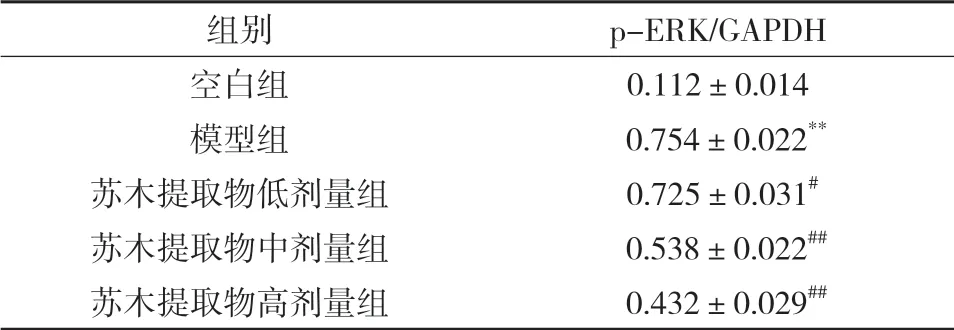
表5 各组小鼠主动脉p-ERK蛋白表达比较( ±s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 p-ERK/GAPDH空白组 0.112±0.014模型组 0.754±0.022**苏木提取物低剂量组 0.725±0.031#苏木提取物中剂量组 0.538±0.022##苏木提取物高剂量组 0.432±0.029##

图6 各组小鼠主动脉p-ERK蛋白表达比较
3 讨论
氧化应激反应是机体氧化-抗氧化失衡的表现,是多种疾病的发生发展的重要机制之一。在AS的发生发展过程中血管内皮细胞损伤扮演着关键角色,而氧化应激损伤是血管内皮细胞常见的病理损伤,因其可以导致内皮细胞活力降低,促使细胞坏死、凋亡,同时也会引起脂质过氧化物增多,进而引发血管内皮结构改变和功能障碍[18]。研究表明,MAPKs广泛存在于真核细胞中,包括p38、JNK、ERK三部分,其在静息状态下主要存在于细胞质中,而在氧化应激等因素刺激下会激活MAPKs并促使其向细胞核内转移,而后与其相应底物结合发生一系列反应,进而参与细胞增殖、凋亡等病理生理过程[19]。p38是氧化应激过程重要的调节蛋白,可诱发甚至加重氧化应激,在AS的形成过程中具有重要作用[20-21]。JNK又称为应激活化蛋白激酶,在AS形成中发挥着重要的作用[22]。ERK是MAPK家族中最知名的成员,与细胞增殖、分化及转化密切相关,与AS 的病理改变过程密切相关[23]。氧化应激指标中的丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)水平可大致反映出机体的氧化应激状态,其中MDA是膜脂过氧化过程中最重要的产物之一,是常用检测氧化应激反应的指标;SOD是一种天然的超氧自由基消除剂,可催化超氧自由基的歧化反应;而GSH-Px可清除ROS、SOD与GSHPx活性水平,与氧化应激程度呈负相关,研究表明以上三者可以通过引起血管内皮和组织细胞过氧化损伤,影响机体免疫炎症反应等途径促进AS的发生[24-25]。综上所述,氧化应激能够通过影响免疫炎症反应,干预细胞增殖、凋亡等病理生理过程,可以看作是AS形成的始动因素,因此,深入研究氧化应激相关机制对于防治AS具有重要的意义。
AS多归属于中医学“胸痹心痛”“中风”等范畴,其病机主要在于血行不畅、痹阻不通。一方面中医学认为,脾虚生痰,尤其现代人们长期不规律饮食或者暴饮暴食的生活习惯日久会损伤脾胃的功能,导致脾胃虚弱,而脾胃虚弱则运化功能失司,水谷难以运化使得津(液)停为痰,痰浊积聚于脉中,导致AS斑块的发生,如《格致余论》论述了脾胃受损,痰浊生成,导致脉道痹阻,即“或因忧郁,或因厚味……气腾血沸,清化为浊,老痰宿饮,胶固杂糅,脉道阻塞,不能自行”;另一方面当血液运不畅后,机体便出现相应的病理状态,即血瘀,血瘀为害,阻滞络脉,致使心脉不通,而血停脉中,血液无法正常运行,亦是引发AS的重要因素,如《医学纲目》中记载“中风皆因脉道不利,血气闭塞也”为瘀血诱发AS提供了理论依据[26]。AS作为一种病理结果,由多种因素相互作用、共同参与的过程,发病主要责之于正气虚衰,无力推动血液、水液的输布运行以致痰浊、瘀血等病理产物停聚于脉中,血脉不通,心失所养,属本虚标实之证。苏木载于《新修本草》,具有舒经活络、活血散瘀、消肿止痛等功效,临床上主要用于治疗心腹疼痛、瘀滞肿痛、跌打损伤等病症[27-29]。日本学者永井正博率先对苏木化学成分进行研究,而后随着生物技术的不断发展进步,现以从苏木中分离提取了上百种成分,其中巴西苏木素是苏木药材主要的活性化合物,属高异黄酮类的衍生物,其含量最高,约占总含量的2%,也是评价其质量优劣的重要依据,现代药理学研究表明苏木具有抗氧化、免疫抑制、抗炎、抗心脏移植排斥反应、保护血管等多方面作用[30-31]。本研究结果显示苏木能够升高小鼠血清中GSH-Px、SOD表达水平,降低MDA表达水平。综合上述文献及本研究结果再次证实了苏木具有抗氧化应激的作用。所以本实验选用苏木进行研究,以期为苏木治疗AS提供理论依据。
本研究结果显示:与空白组比较,模型组小鼠主动脉中MDA表达水平升高,p38、JNK、ERK蛋白磷酸化水平升高,GSH-Px、SOD表达水平降低;与模型组比较,苏木提取物低、中、高组小鼠主动脉中MDA水平降低,p38、JNK、ERK蛋白磷酸化表达降低,GSH-Px、SOD表达水平升高。初步说明了苏木提取物能够抗氧化应激损伤,可以下调p38/JNK/ERK信号通路的表达,即苏木提取物能够通过抗氧化应激损伤发挥抗AS的作用,部分机制可能与抑制p38/JNK/ERK信号通路活化有关。

