不同灰树花多糖提取及其体外抗氧化活性研究
肖建勇,陈智超,朱育娴,陈可文,3,黄梓芮,2,刘斌,2*
1. 福建农林大学食品科学学院(福州 350002);2. 福建农林大学国家菌草工程技术研究中心(福州 350002);3. 西南民族大学食品科学与技术学院(成都 610041)
灰树花(Grifola frondose)是一种食药两用菌,又被称之为“千佛菌”,其在世界范围内分布广泛,在日本、俄罗斯及中国的浙江、福建、四川等地均有种植,在日本还享有“舞茸”的称号[1-2]。灰树花不仅风味独特、口感丰富,而且富含如多糖、多肽、多酚及黄酮等生物活性物质,其独特的药用与营养价值使其成为近年来的研究热点。灰树花有效成分的研究主要集中于多糖,灰树花多糖具有抗氧化[3]、免疫调节、抗肿瘤[4]、抗乙型肝炎病毒等生物活性,此外越来越多的研究开始关注其在预防和治疗糖尿病、高血糖等疾病方面的潜力。
然而,市面上的灰树花品类丰富,特征差异极大,有的灰树花分支长,叶片大,颜色灰白,而有的则菇型紧凑,分支适中,颜色呈灰褐色,大朵灰树花的单朵质量远超于小朵灰树花。很多灰树花工艺研究以及营养学分析都未提及所用灰树花的具体品类,这对灰树花的后续研究有着较大的阻碍。最早开始研究灰树花栽培技术的国家是日本,经过多年的探索不仅保证产量逐年上升,而且实现周年化栽培。我国浙江省庆元县和河北迁西县在20世纪80年代开始野生灰树花人工驯化栽培和菌棒式栽培,开创仿野生栽培方式、二次覆土栽培和二次无土栽培模式,在灰树花栽培方面技术相对成熟[5]。然而优良菌株是推动灰树花产业发展的重要动力,福建南平响应国家科技扶贫相关政策,近年来也开始对灰树花进行选育工作,虽然起步相对较晚,但部分地区已开展规模化栽培。试验通过与庆元的灰树花品种相比较来培育和推广生物活性物质含量更高的新品种以促进福建省灰树花的开发利用。同时,灰树花作为一种中温型、喜光的木质腐生菌,其生长受环境因素影响较大,环境温度、水分湿度及光照情况等都会影响其子实体的发育[6]。不同地区的气候等条件有所差别,产自不同地区的灰树花也具有不同的形态学方面的特征,但其营养价值以及生物活性物质含量等方面是否具有显著性差别则需要通过试验验证。因此,试验针对产自浙江庆元以及福建南平的4种灰树花的主要成分多糖进行提取,并对获得的多糖的体外抗氧化活性进行进一步对比研究。
1 材料与方法
1.1 材料与试剂
灰树花(D1,福建南平大朵;D2,浙江庆元大朵;X1,福建南平小朵;X2,浙江庆元小朵;经福建农林大学菌草工程技术研究中心鉴定,烘干粉碎后备用);普通型透析袋(3 500 Da,MD3525)、3, 5-二硝基水杨酸(DNS,R23236)、 DPPH(S30629)、2, 2’-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS,S19198),均为上海源叶生物科技有限公司;BCA试剂盒(P0010BCA,上海碧云天生物技术有限公司);10×PBS缓冲液(E607016,上海生工生物股份有限公司);过硫酸钾、FeSO4、H2O2、水杨酸、葡萄糖、无水乙醇、丙酮、无水乙醚等化学试剂(均为国药分析纯)。
1.2 灰树花多糖的制备
精确称取20 g经烘干粉碎的灰树花粉末,加入其10倍体积的95%乙醇,在45 ℃恒温水浴条件下按45 kHz超声处理1 h,经六层纱布过滤后按4 000 r/min离心15 min,滤渣烘干后加入25倍体积的去离子水,超声1 h(45 ℃,45 kHz),于100 ℃水浴1 h,离心,将上清液经减压浓缩后加入4倍体积乙醇于4 ℃醇沉12 h,按4 000 r/min离心15 min获得沉淀即为粗多糖。依次用无水乙醇、丙酮、无水乙醚洗涤,于40 ℃烘干乙醚,用Sevag法(V氯仿∶V正丁醇=4∶1)除去蛋白,并用3 500 Da的透析袋透析48 h,减压浓缩后冻干,即制得灰树花多糖。
1.3 试验方法
1.3.1 灰树花多糖理化性质测定
1.3.1.1 总糖含量测定
灰树花总糖含量的测定参考苯酚-硫酸法[7]。绘制标准曲线:配制质量浓度分别为0,0.2,0.4,0.6,0.8和1.0 mg/mL的葡萄糖标准体系;各取500 μL至装有500 μL 5%苯酚的试管中,充分摇匀后加入2.5 mL浓硫酸,沸水浴15 min后放置20 min冷却,每管中移取200 μL至96孔板,测定样品吸光度(490 nm)。绘制标准曲线并计算得回归方程y=3.836 8x+0.261 2(R2=0.990 8)。
灰树花多糖溶液吸光度的测定:配制质量浓度1 mg/mL的灰树花多糖溶液,重复上述步骤测定吸光度。
1.3.1.2 还原糖含量测定
还原糖含量的测定参考DNS法[8]。绘制标准曲线:参照1.3.1.1小节配制葡萄糖标准体系;各取100 μL至装有100 μL DNS试剂的试管中,充分摇匀后水浴5 min;流水冷却后用蒸馏水定容至1 mL;移取200 μL至96孔板,测定在540 nm波长下的吸光度。绘制标准曲线并计算得回归方程y=0.655 7x-0.015 8(R2=0.990 8)。
灰树花多糖溶液吸光度的测定:配制质量浓度2 mg/mL的灰树花多糖溶液,重复上述步骤测定吸光度。
1.3.1.3 蛋白含量的测定
测定灰树花蛋白质含量参考BCA法[9],并稍加修改。绘制标准曲线:参照1.3.1.1小节配制牛血清白蛋白(BSA)标准体系;各取0.1 mL至装有2 mL工作液(VA液∶VB液=50∶1)的试管中,充分摇匀后于37 ℃孵育30 min;移取200 μL至96孔板,测定在562 nm波长下的吸光度。绘制标准曲线并计算得回归方程y=0.562 7x-0.014 3(R2=0.991 6)。
灰树花多糖溶液吸光度的测定:配制质量浓度2 mg/mL的灰树花多糖溶液,重复上述步骤测定吸光度。
1.3.2 抗氧化性测定
1.3.2.1 DPPH自由基清除率的测定。
DPPH自由基清除方法已经在比较姬松茸胞外多糖抗氧化能力中得到应用[10]。将灰树花多糖以及VC配制成质量浓度分别为0.125,0.250,0.500,1.000和2.000 mg/mL的溶液体系;各取100 μL加入至装有100 μL浓度为0.2 mmol/L DPPH的1.5 mL离心管中,其中抗坏血酸(VC)溶液为阳性对照组;充分混匀后在避光条件下保存,反应30 min,离心后取上清液;测定样品吸光度(517 nm),并根据式(1)计算。
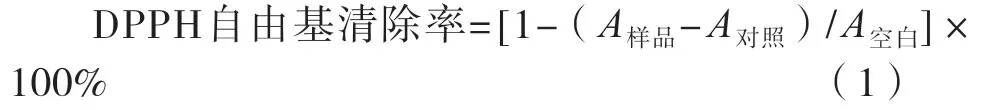
式中:A样品为灰树花溶液体系反应后的吸光度;A对照为用无水乙醇取代DPPH反应后的背景吸光度;A空白为用无水乙醇取代灰树花多糖与DPPH反应的阴性对照吸光度。
1.3.2.2 ABTS自由基清除率的测定。
参照吴娟等[11]的ABTS清除试验。制备ABTS自由基溶液:将5 mL过硫酸钾(2.45 mmol/L)与5 mL ABTS(7 mmol/L)混合后在室温条件下避光保存16 h,测定前用PBS(浓度50 mmol/L,pH 7.4)稀释至其在734 nm处吸光度为0.70±0.02;参照1.3.2.1小节配制灰树花多糖及VC溶液体系;各取50 μL至酶标板,其中抗坏血酸(VC)溶液为阳性对照组;保温3 min(30℃)后迅速加入150 μL ABTS自由基溶液,摇匀后继续保温,反应6 min;测定样品吸光度(734 nm),并根据式(2)计算。
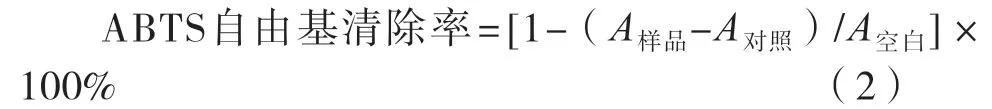
式中:A样品为灰树花溶液体系反应后的吸光度;A对照为50 μL样品加入150 μL PBS的背景吸光度;A空白为用PBS取代灰树花多糖的阴性对照吸光度。
1.3.2.3 羟自由基清除率的测定。
参考羟自由基清除法[12]。参照1.3.2.1小节配制灰树花多糖及VC溶液体系,体积均为1 mL,其中VC溶液为阳性对照组;依次加入0.5 mL FeSO4、0.35 mL H2O2后混匀并在37 ℃条件下孵育10 min;加入0.15 mL水杨酸(20 mmol/L)混匀并在37 ℃条件下反应30 min;测定样品吸光度(562 nm),并根据式(3)计算。
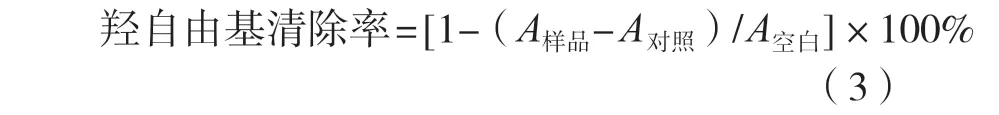
式中:A样品为灰树花溶液体系反应后的吸光度;A对照为用去离子水取代水杨酸后的背景吸光度;A空白为用去离子水取代灰树花多糖的阴性对照吸光度。
1.4 数据分析
试验中涉及吸光度的测定均采用4组平行试验并求取平均值。采用Excel软件对数据进行统计分析、绘制标准曲线并计算回归方程,采用SPSS 26进行显著性分析,采用GraphPad Prism 8软件进行IC50的计算。
2 结果与分析
2.1 灰树花多糖得率
根据前期试验确定提取方案,精确称取4种灰树花粉末,各20 g,最终计算得到得率,如表1所示。D1多糖5.43%,D2多糖3.93%,X1多糖5.71%,X2多糖4.79%。提取得率按式(4)计算。
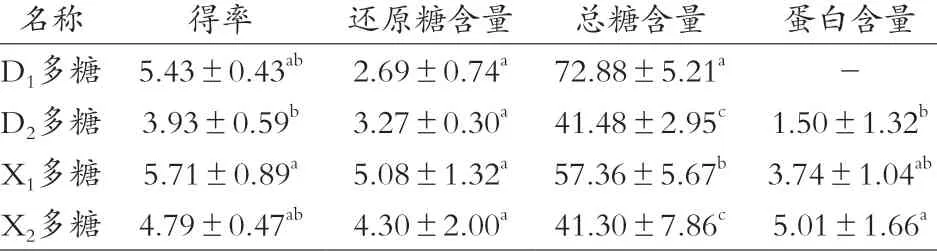
表1 灰树花多糖得率及理化性质 单位:%
提取得率=所得多糖质量(g)/灰树花粉末质量(g)×100% (4)
2.2 灰树花多糖理化性质
根据灰树花多糖样品吸光度及回归方程,计算得4种灰树花多糖各自的还原糖含量、总糖含量和蛋白含量。从表1可以看出,不同种类灰树花还原糖含量差异较小,说明透析的效果基本相同,小分子量的低聚糖或者单糖已被除去,后续可用过柱纯化或者其他方式进一步得到精多糖。特别地,4种多糖的总糖含量差异较大,含量最高的为D1,其总糖含量达到72.88%,但是D2和X2灰树花多糖的总糖含量较低,都不足50%,有可能是苯酚硫酸法的局限性,多糖中包含的不同的单糖在苯酚硫酸法反应后显色程度不一,张美等[13]关于三七多糖含量的测定试验表明除还原糖种类外,加热时间、温度、苯酚用量等因素同样会影响体系吸光度,也有可能是其本身有较多的其他杂质不易除去,这在粗多糖的提取研究中较为常见。此外,在D1多糖中未检测到蛋白含量,说明D1灰树花本身的多糖含量较高且蛋白质含量低,这与灰树花品种以及生长地区气候条件息息相关,所以D1灰树花适合得到较高产率及纯度的灰树花多糖。此外,虽然已用Sevag法反复多次纯化其他多糖,但是仍有蛋白质的残留,这说明通过Sevag法洗脱蛋白仍有改进的空间,或是因为不同品种灰树花所含蛋白分子量差异较大,3 500 Da的透析袋对于其他3种灰树花无法彻底除去蛋白,这有待进一步试验验证。但是,相关试验表明Sevag法是除了三氯乙酸法以外蛋白清除率较高并且多糖损失较少的方法[14]。
2.3 灰树花多糖抗氧化指标综合分析
由图1可知,与其他3种多糖相比,D1多糖的自由基清除能力明显较弱。4种灰树花多糖对DPPH自由基的IC50分别为1.460±0.070(D1),0.500±0.050(D2),0.390±0.010(X1)和0.620±0.060 mg/mL(X2)。结果表明,4种灰树花多糖均具有较好的DPPH自由基清除能力,相比之下D1多糖自由基清除能力弱于其他3种灰树花多糖,4种多糖DPPH自由基清除能力从强到弱排序为X1、D2、X2和D1。
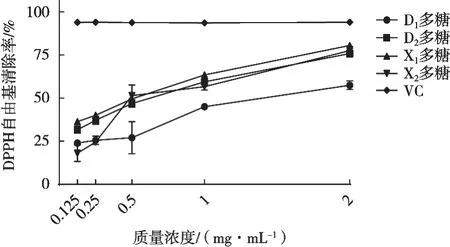
图1 灰树花多糖对DPPH自由基清除作用
由图2可知,质量浓度0.5 mg/mL时X2多糖的自由基清除率与作为阳性对照的VC相接近,其余3种多糖的清除率分别为51.89%(D2),71.62%(X1)和93.08%(D1)。在质量浓度从0.5~2 mg/mL的范围内,自由基清除率随浓度增加而增强的趋势减缓。结果显示,灰树花多糖的IC50分别为0.430±0.010(D1),0.170±0.010(D2),0.270±0.007(X1)和0.160±0.004 mg/mL(X2),因此4种多糖ABTS自由基清除能力从强到弱排序为X2、D2、X1和D1。
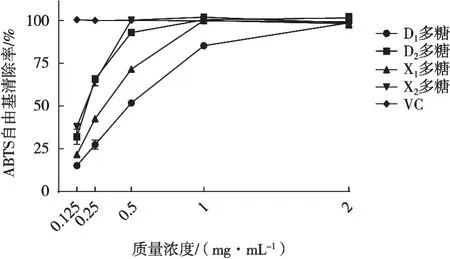
图2 灰树花多糖对ABTS自由基清除作用
由图3可知,质量浓度2 mg/mL时,羟自由基清除率由高到低分别为70.43%(D2),68.90%(X1)、63.06%(X2)和43.57%(D1)。这说明不同灰树花多糖也具有一定的羟基自由基清除能力。进一步计算其IC50,结果分别为2.810±0.569(D1),0.650±0.051(D2),1.070±0.025(X1)和1.420±0.282 mg/mL(X2),因此多糖抗氧化能力从强到弱排序为D2、X1、X2和D1。这与DPPH自由基清除能力的结果相似,X1和D2和抗氧化能力较高,D1则最低。
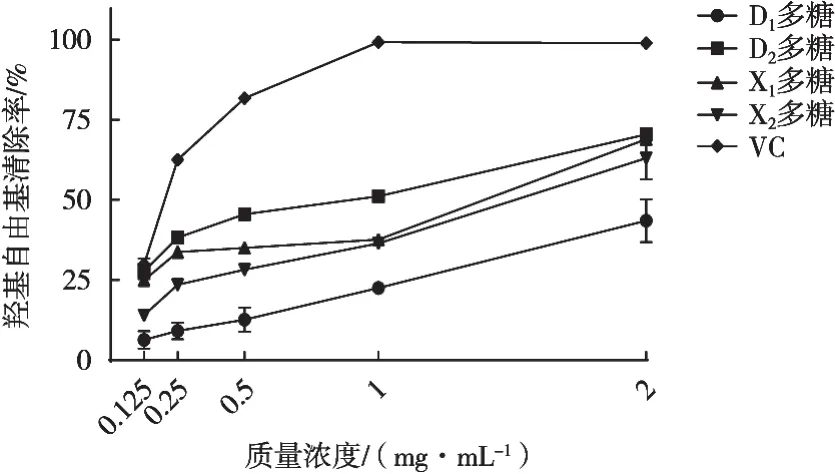
图3 灰树花多糖对羟基自由基清除作用
由图4可知,参与试验的4种灰树花多糖在3种自由基清除指标下的IC50值均较小,因此具有较强的抗氧化能力。DPPH自由基清除能力最强的是X1,其IC50为0.390±0.010 mg/mL;X2多糖对ABTS自由基有最佳的抑制能力,IC50为0.160±0.004 mg/mL;D2多糖对羟自由基抑制能力的IC50为0.650±0.051 mg/mL,是同组中抑制率最高的。由图4可以直观地看出:当采用DPPH和OH-为指标时,D2与X1多糖的IC50小于同组的D1与X2多糖;仅当采用ABTS为指标时,X2多糖效果会优于X1多糖,但与D2多糖相比无显著性差异。因此综合3种抗氧化指标,D2及X1灰树花多糖的抗氧化能力最为理想。关于灰树花多糖结构与其生物活性间关联的研究较少,张宗启等[15]对其研究现状进行总结得出,多糖生物活性与其聚合度、分子量、糖苷键类型、支链数等因素有关,以一种叫作FGFP-11的灰树花杂多糖为例,它主要由α-(1→6)糖苷键和α-(1→3)糖苷键构成,并被认为具有较强的抗氧化性;除此之外,灰树花多糖的分子量、分子结构、生物活性也受品种、处理手段等多种因素的影响。结合表2与图4可以看出,D1灰树花多糖的总糖含量最高,但经过脱蛋白后未检测出蛋白含量,而其余3种多糖中均有检测出。有研究表明灰树花多糖提取副产物中蛋白也具有抗氧化性[16]。因此,D1多糖抗氧化活性最低,除了可能与本身分子结构有关以外,还可能是因为完全脱除具有一定抗氧化性能的蛋白。
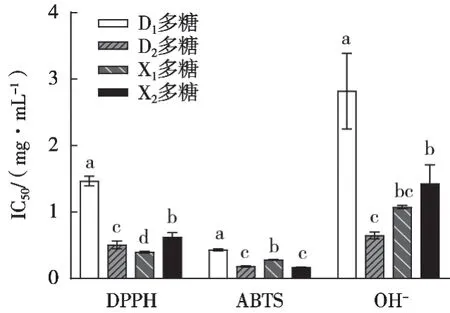
图4 灰树花多糖不同抗氧化指标下的IC50
3 结论
主要从多糖提取率、抗氧化性这2个方面对D1,D2,X1和X2这4种不同产地和品种的灰树花进行比较。经过水提醇沉、Sevag除蛋白、透析等操作获得灰树花多糖。其中,福建南平大朵灰树花(D1)不仅提取率较高,还具有总糖含量高、蛋白洗脱效果好的特点,作为原料对进一步的多糖纯化制备有着天然优势。在抗氧化性方面,浙江庆元大朵(D2)与福建南平小朵(X1)的多糖对DPPH、ABTS及羟基自由基的清除能力均较为优秀,具有被开发成安全性高的天然抗氧化剂的潜力。因此,福建南平出产的2种灰树花在多糖含量以及抗氧化活性方面各具优势。为最大程度地开发利用灰树花资源,在进一步试验中需要对福建南平出产的灰树花进行品种鉴定以及系统学命名。此外,还需要对其灰树花多糖进行色谱纯化以获取精多糖,并针对精多糖进一步进行生物活性评价。

