健心颗粒对心力衰竭大鼠模型心肌代谢重构的作用
苏天生 肖章武▲ 卢 静 王志民
1.福建中医药大学附属第二人民医院急诊科,福建福州 350003;2.福建中医药大学附属第二人民医院急危重症医学部,福建福州 350003
心力衰竭是指各种原因导致心脏结构和/或功能异常,使心室射血或充盈能力受损的一种临床综合征[1]。心力衰竭已成为全球的健康重负,目前全球心力衰竭患者约有2600万,我国约有450万,约60%的患者在确诊5年内病死[2]。心力衰竭由于其高发病率和高病死率,目前已成为严重的公共卫生问题和临床医学亟待解决的难题[3]。健心颗粒是福建中医药大学附属第二人民医院(我院)全国百名名老中医陈美华、林求诚主任医师在中医传统理论指导下,基于心力衰竭的病因病机及临床特点,结合现代药理研究成果研制的院内制剂,具有益气活血、通阳利水之功效[4]。临床研究结果表明健心颗粒可以逆转左心室重构,改善心力衰竭临床症状,降低血浆脑钠肽水平,改善肾功能[5]。但健心颗粒改善心肌重构过程中的调控机制仍有待阐明。本研究拟通过构建心力衰竭动物模型,分析健心颗粒对心力衰竭心肌代谢重构的作用及机制。
1 资料与方法
1.1 实验动物
选择30只健康SD大鼠作为研究对象,大鼠体重(200±20)g,动物许可证号SYXK(闽2009-0001),所有大鼠均置于SPF级动物房适应性饲养1周,恒温恒湿,自由饮食、饮水及采光。大鼠均购买自南京青龙山动物繁育场。本研究方案经小动物伦理委员会审议并批准。
1.2 分组及造模
将所有大鼠依照体重编号并采用随机数字表法分为对照组、模型组及治疗组,每组各10只。模型组及治疗组大鼠利用腹主动脉缩窄法制备心力衰竭模型,使用地西泮(国药集团容生制药有限公司,批准文号:H41020638)2.5 mg/kg、氯胺酮(浙江九旭药业有限公司,批准文号:H20023609)20 mg/kg腹腔注射,大鼠麻醉后,腹部正中切口,创面使用生理盐水浸泡后的纱布进行遮盖,后分离膈肌下肾动脉分支上小段腹主动脉,腹主动脉上放置1 mm软导管,将导管与动脉使用棉线一同结扎阻断血流,后将导管取出,结扎后导管直径即为腹主动脉内径。将手术创面缝合并消毒,使用青霉素10万U/kg腿部肌内注射,注重术后保暖,后送至动物房,常规饲养,自由饮食、饮水及采光。治疗组依照1.8 g/kg剂量使用健心颗粒(院内制剂,批准文号:闽药制号Z20100010)进行灌胃治疗,使用蒸馏水2 ml溶解药物后灌胃给药,每天给药1次,对照组与模型组使用等体积蒸馏水灌胃干预,持续干预4周。
1.3 观察指标
本研究中,在大鼠清醒状态下使用MRB-ⅢA型大鼠血压心率测定仪(上海高血压研究所监制)对大鼠尾动脉收缩压(systolic blood pressure,SBP)及心率进行检测,利用高分辨率小动物超声影像系统(意大利百胜医疗)行超声心动图测定大鼠治疗后左心室收缩末期内径(left ventricular endsystolic dimension,LVESD)、左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)。给药4周后,对大鼠进行麻醉,采集腹主动脉血并观察大鼠胸腔内脏器形状及充血情况,取心脏保留左心室及左心室间隔,使用电子天平称重,以左心室重量/体重的比值计算左心室重量指数(left ventricular mass index,LVMI)。取 大 鼠 左心室心肌组织,采用差速离心法体外分离线粒体,采用蛋白浓度测定试剂盒对线粒体蛋白(OD)浓度进行检测,并计算Na+-K+-ATP酶和Ca2+-ATP酶活性。采用免疫放射法检测大鼠血浆中血管紧张素Ⅱ(angiotensin Ⅱ,ANGⅡ)、脑钠肽(brain natriuretic peptide,BNP)及心钠素(atrial natriuretic polypeptide,ANP)。
1.4 统计学方法
采用SPSS 20.0统计学软件行统计学分析,以均数±标准差()表示符合正态分布的计量资料,采用方差检验分析多组间计量资料差异,采用t检验分析两组间计量资料差异,P< 0.05为差异有统计学意义。
2 结果
2.1 三组大鼠SBP及心率比较
三组大鼠SBP及心率存在明显差异,模型组SBP最低、心率最高,差异有统计学意义(P< 0.05)。两组间比较结果显示,治疗组大鼠SBP明显高于模型组,心率明显低于模型组,差异有统计学意义(P< 0.05)。见表1。
表1 三组大鼠SBP及心率比较(±s)

表1 三组大鼠SBP及心率比较(±s)
注 SBP:收缩压;1 mmHg=0.133 kPa;与对照组比较,aP < 0.05;与模型组比较,bP<0.05
组别 n SBP(mmHg) 心率(次/min)对照组 10 194.38±8.49 329.83±10.94模型组 10 130.21±9.10a 387.59±15.84a治疗组 10 163.19±10.05ab 335.49±9.38ab F值 5.483 6.122 P值 0.010 0.006
2.2 三组大鼠LVEDD及LVESD水平比较
三组大鼠LVEDD及LVESD水平存在明显差异,模型组LVEDD及LVESD最高,差异有统计学意义(P< 0.05)。两组间比较结果显示,治疗组大鼠LVEDD及LVESD均明显低于模型组,差异有统计学意义(P< 0.05)。见表2。
表2 三组大鼠LVEDD及LVESD水平比较(mm,±s)
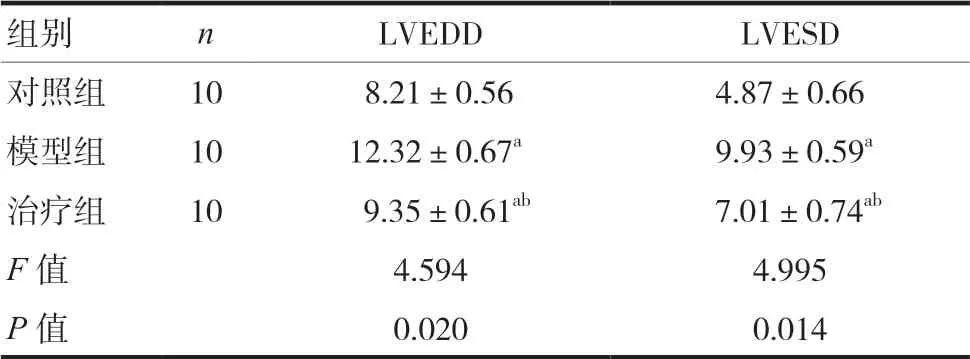
表2 三组大鼠LVEDD及LVESD水平比较(mm,±s)
注 LVEDD:左心室舒张末期内径;LVESD:左心室收缩末期内径;与对照组比较,aP < 0.05;与模型组比较,bP<0.05
组别 n LVEDD LVESD对照组 10 8.21±0.56 4.87±0.66模型组 10 12.32±0.67a 9.93±0.59a治疗组 10 9.35±0.61ab 7.01±0.74ab F值 4.594 4.995 P值 0.020 0.014
2.3 三组大鼠体重、左心室重量及LVMI水平比较
三组大鼠体重、左心室重量及LVMI水平存在明显差异,模型组体重、左心室重量及LVMI水平最低,差异有统计学意义(P< 0.05)。两组间比较结果显示,治疗组大鼠体重、左心室重量及LVMI均明显高于模型组,差异有统计学意义(P< 0.05)。见表3。
表3 三组大鼠体重、左心室重量及LVMI水平比较(±s)
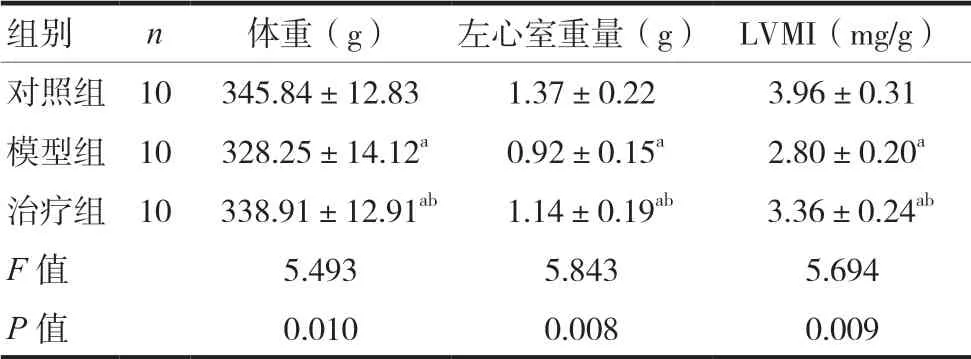
表3 三组大鼠体重、左心室重量及LVMI水平比较(±s)
注 LVMI:左心室重量分数;与对照组比较,aP < 0.05;与模型组比较,bP<0.05
组别 n 体重(g) 左心室重量(g) LVMI(mg/g)对照组 10 345.84±12.83 1.37±0.22 3.96±0.31模型组 10 328.25±14.12a 0.92±0.15a 2.80±0.20a治疗组 10 338.91±12.91ab 1.14±0.19ab 3.36±0.24ab F值 5.493 5.843 5.694 P值 0.010 0.008 0.009
2.4 三组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性比较
三组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性存在明显差异,模型组OD、Na+-K+-ATP酶和Ca2+-ATP酶活性水平最低,差异有统计学意义(P< 0.05)。两组间比较结果显示,治疗组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性均明显高于模型组,差异有统计学意义(P< 0.05)。见表4。
表4 三组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性比较( ±s)
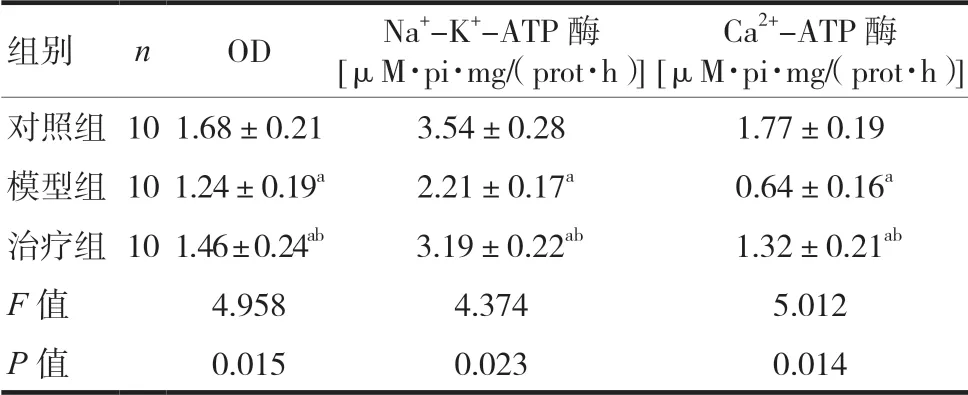
表4 三组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性比较( ±s)
注 OD:线粒体蛋白;与对照组比较,aP < 0.05;与模型组比较,bP<0.05
组别 n OD Na+-K+-ATP酶[μM·pi·mg/(prot·h)]Ca2+-ATP酶[μM·pi·mg/(prot·h)]对照组101.68±0.21 3.54±0.28 1.77±0.19模型组101.24±0.19a 2.21±0.17a 0.64±0.16a治疗组101.46±0.24ab 3.19±0.22ab 1.32±0.21ab F值 4.958 4.374 5.012 P值 0.015 0.023 0.014
2.5 三组大鼠心肌标志物比较
三组大鼠ANGⅡ、BNP、ANP存在明显差异,模型组ANGⅡ、BNP、ANP水平最低,差异有统计学意义(P< 0.05)。两组间比较结果显示,治疗组大鼠ANGⅡ、BNP、ANP均明显高于模型组,差异有统计学意义(P< 0.05)。见表5。
表5 三组大鼠心肌标志物比较(pg/ml,±s)
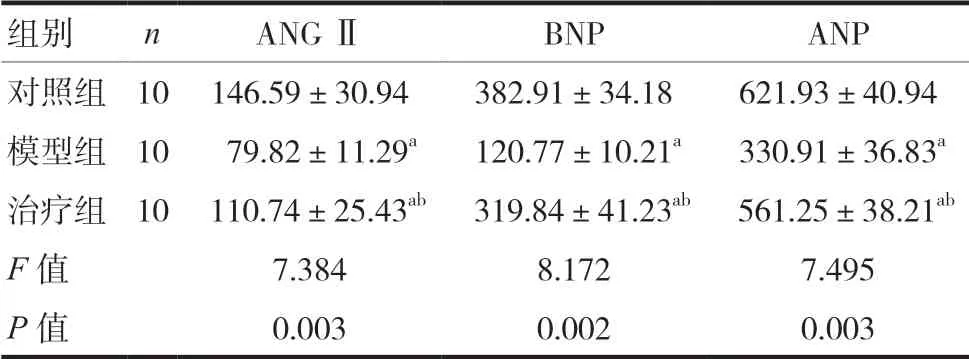
表5 三组大鼠心肌标志物比较(pg/ml,±s)
注 ANGⅡ:血管紧张素Ⅱ;BNP:脑钠肽;ANP:心钠素;与对照组比较,aP < 0.05;与模型组比较,bP<0.05
组别 n ANGⅡ BNP ANP对照组 10 146.59±30.94 382.91±34.18 621.93±40.94模型组 10 79.82±11.29a 120.77±10.21a 330.91±36.83a治疗组 10 110.74±25.43ab 319.84±41.23ab 561.25±38.21ab F值 7.384 8.172 7.495 P值 0.003 0.002 0.003
3 讨论
心力衰竭患者常伴随出现不同程度的心肌结构和功能重构,心脏重构的病理改变包括心肌细胞增大、细胞外基质沉积增加、心肌内冠状动脉血管中层增厚、心肌间质和血管周围胶原纤维堆积,可引起异常纤维化[6]。心脏重构是心血管事件的独立危险因素,可显著增加心源性猝死、室性心律失常等恶性心血管事件的发生率和病死率,严重影响心力衰竭患者的预后[7]。血流动力学超负荷不是引起心脏重构的唯一因素,非血流动力学因素在心脏重构的发展过程中也起着重要作用[8]。神经体液等非血流动力学因素通过与G蛋白耦联的膜受体结合激活细胞内信号转导通路,这些信号转导通路位于细胞质的信号效应器可激活多种转录因子,转录因子进入细胞核与DNA结合改变基因表达,激活胚胎基因,如使β-肌球蛋白重链、骨骼肌α-肌动蛋白、心房利钠因子基因的表达上调,而α-肌球蛋白重链、肌浆网钙ATP酶基因的表达下调,引起心脏肥厚性生长[9]。
研究证明,能量代谢异常在心力衰竭心脏损伤过程中扮演重要角色[10]。肥大或衰竭心脏处于一种能量缺乏状态,衰竭心脏中ATP的浓度下降约30%,此时,心肌的主要代谢底物也由脂肪酸转变为葡萄糖,以适应在缺氧状态下ATP的需求[11]。伴随代谢底物改变,心肌细胞内脂质累积以及糖酵解增多,总ATP水平下降。过多的脂肪酸可直接损伤心肌细胞胶原纤维功能,导致心肌纤维变形。随着心肌利用脂肪酸供能降低,脂质中间代谢产物大量堆积,产生过多活性氧,影响线粒体供能,从而引起心脏收缩或舒张功能障碍[12]。
健心颗粒是全国名老中医陈美华、林求诚主任医师临床治疗心力衰竭的经验处方,治疗心力衰竭疗效确切。健心颗粒对心脏保护功能主要作用于哪些关键靶点等问题还有待阐明,目前缺乏有效的试验依据和理论基础[13]。临床研究结果表明健心颗粒可逆转左心室重构,改善心力衰竭临床症状,降低BNP水平,改善肾功能[14]。相关动物实验研究从神经内分泌细胞因子调节、细胞凋亡基因及蛋白表达、左心室纤维化、一氧化氮合成酶系统的调节等多个方面进行研究,同样提示健心颗粒可改善心肌重构、改善心功能[15]。
本研究结果显示,采用健心颗粒对心力衰竭大鼠模型干预后,治疗组大鼠SBP明显高于模型组,心率、LVEDD及LVESD均明显低于模型组(P< 0.05)。进一步分析显示,治疗组大鼠体重、左心室重量及LVMI均明显高于模型组(P< 0.05)。对大鼠心肌代谢水平进行检测,结果显示治疗组大鼠OD、Na+-K+-ATP酶和Ca2+-ATP酶活性均明显高于模型组(P< 0.05)。对大鼠血浆中心肌标志物进行检测,结果显示治疗组大鼠ANGⅡ、BNP、ANP均明显高于模型组(P< 0.05)。健心颗粒由黄芪、红参、生蒲黄、丹参、猪苓、白术、桂枝、葶苈子组成。以黄芪、红参为君,益气通阳以治其本;以生蒲黄、丹参为臣,活血化瘀,通利血脉;佐以猪苓、桂枝通阳化饮利水;葶苈子宣肺利水为使。诸药相伍,共奏益气活血、通阳利水之功。健心颗粒治疗心力衰竭可能与调控脂质代谢途径的靶蛋白进而调控心肌代谢重构存在关联,因而起到有效的治疗效果。
综上所述,对心力衰竭大鼠模型采用健心颗粒干预后可有效提升其心肌代谢能力,改善心肌重构,提高疗效。但本研究并未采取临床相关研究数据进行复核,并未探讨健心颗粒的实际临床应用价值,有待后续持续研究和追踪。

