非酒精性脂肪肝与心血管疾病相关性的研究
屠燕,杨婵娟,黄莹,李世超,曾庆春†
①南方医科大学 南方医院心内科,广州 510515; ②南方医科大学 南方医院肿瘤科,广州 510515
非酒精性脂肪性肝病是临床发病率较高的一类肝脏疾病,可由多种因素促发,且可能导致多种疾病,尤以冠心病最为常见。非酒精性脂肪肝(NAFLD)常与动脉粥样硬化性心脏病(ASCVD)同时发生,是由于NAFLD与胰岛素抵抗、肥胖、氧化应激和代谢综合征密切相关,是代谢综合征在肝脏的表现,而已知氧化应激、代谢综合征与心血管疾病(如亚临床动脉粥样硬化)有关[1-2]。多项研究均支持NAFLD和ASCVD之间存在关联。有研究报道,NAFLD患者发生冠心病的风险明显高于其他人群,NAFLD患者最常见的死亡原因是心血管疾病(CVD)[1-2]。尽管传统危险因素是CVD负担的主要贡献,但10%~15%的CVD患者没有明显的传统危险因素。越来越多的证据表明NAFLD与CVD有亚临床相关性,而NAFLD作为一种潜在的独立心血管危险因素,现已逐渐引起关注。本文旨在介绍NAFLD与心血管疾病相关的最新研究证据,以及就两者关联的潜在机制进行讨论综述。
1 NAFLD与ASCVD的关系
1.1 NAFLD与ASCVD密切关联的流行病学证据
根据最新统计,NAFLD的患病率正在急剧上升,全球NAFLD患病率约为25%,我国成人NAFLD患病率高达20%,造成日趋严重的社会经济负担。NAFLD是一种异质性疾病,它是肝功能障碍的主要原因。NAFLD被定义为在没有过量饮酒的情况下,肝脏脂肪堆积或肝脏脂肪变性。它代表一系列肝脏疾病,范围从脂肪变性和非酒精性脂肪性肝炎(NASH)到晚期纤维化和肝硬化,最终可发展为肝细胞癌(HCC)。在少数患者中,NAFLD伴纤维化可直接进展为HCC,而没有中间期肝硬化。NAFLD与2型糖尿病(T2DM)和肥胖在流行病学和病理生理学方面的研究具有高度一致性,可将其视为代谢综合征和T2DM的肝脏受累部分[3]。值得注意的是,NAFLD也与ASCVD(如高血压)有很强的相关性。
前瞻性研究[4]表明,NAFLD的发生和严重程度,特别是脂肪性肝炎和纤维化,与CVD风险增加有关。罹患NASH或晚期NAFLD相关纤维化的患者比单纯脂肪变性的患者合并ASCVD的风险更高。事实上,ASCVD被认为是NAFLD患者死亡的首要原因。近期Wu等[5]进行了荟萃分析研究,这项荟萃分析纳入了34项研究,包括21项横断面研究及13项队列研究,涉及研究对象164 494人,旨在评估NAFLD是否以及在多大程度上增加了心血管疾病的额外风险。结果显示ASCVD死亡率在NAFLD人群和非NAFLD人群之间存在显著差异,这表明尽管NAFLD与全因死亡率无关,但NAFLD的存在与主要不良心血管事件的风险增加明显相关。因此,临床医生对NAFLD患者定期评估心血管风险显得尤为重要。
1.2 遗传学研究
NAFLD和ASCVD都是多因素参与的疾病,且都具有胰岛素抵抗、血脂异常、高血压等代谢综合征的特征,因此,很难分析NAFLD对ASCVD的潜在直接影响。有研究表明,NAFLD可能通过混合型高脂血症导致动脉粥样硬化,基因方面的研究为这一观点提供了一定程度的支持。
国内外研究表明,遗传易感性在NAFLD的发生发展中起重要作用。已知一些基因变异会加速NAFLD的发展,而其中一些同时会引发ASCVD的风险。全基因组关联分析提示,patatin样磷脂酶结构域蛋白3(patatinlike phospholipase domain-containing protein 3,PNPLA3)与NAFLD有密切关系[6]。PNPLA3错义突变I148M(rs738409: C>G) 与NAFLD的发生、发展密切相关。PNPLA3属于patatin样磷脂酶家族,编码由481个氨基酸组成的一种跨膜多肽链,在甘油三酯代谢中起水解酶的作用。该基因研究最多的位点为rs738409。此位点野生型为C,突变位点为G,这将导致148位的异亮氨酸变为蛋氨酸,从而影响脂肪合成和水解作用,造成甘油三酯的沉积。有研究表明[7],I148M与肝脏脂肪的沉积增加显著相关,基因型为GG型的人群其肝脏脂肪含量显著升高。I148M与脂肪肝和NAFLD发生风险的增加密切相关。在体外实验中,I148M变异已被证明可降低脂滴中的甘油三酯水解酶活性,是肝细胞和肝星状细胞中脂滴的关键调节因子。然而,截至目前,I148M参与肝脏脂质堆积的直接机制尚未建立。Lauridsen等[8]在对哥本哈根城市心脏研究中的279 013人进行荟萃分析时发现,I148M携带者的肝脏脂肪含量较高(OR=2.03,P=3×10-7),NAFLD分期也较严重(OR=3.28,P=4×10-12)。然而,这种由基因决定的较高的肝脏脂肪含量与血脂水平之间未见相关性,也没有增加罹患缺血性心肌病(IHD)的风险(OR=0.95,P=0.46)。尽管上述研究证实了既往报道的结论,即肝脏脂肪含量或NAFLD与IHD相关,但并未发现与遗传有关的高肝脏脂肪含量与IHD的风险之间存在因果关系。
Kozlitina等[9]的研究表明,跨膜6超家族2(TM6SF2)是另一个与NAFLD易感和进展相关的基因。TM6SF2是一个位于19p12位点的基因,已经被证实具有调节血脂的功能。TM6SF2 E167K突变可降低介导脂肪变性的极低密度脂蛋白(VLDL)的分泌,同时降低血浆中载脂蛋白B的含量和心血管风险。Li等[10]的研究表明,TM6SF2可能是血脂水平的重要调节因子,或可成为心血管疾病的治疗靶点。
近期Brouwers等[11]的研究结果显示,60 801例冠心病患者和123 504例正常对照者中12个NAFLD易感基因与冠心病(CAD)并无关联(OR=1.0,95%CI=0.99~1.00)。然而,在排除了由于VLDL分泌受阻而与NAFLD存在相关的基因后,剩下的基因组确实显示出与CAD呈负相关(OR=0.97,95%CI=0.96~0.99)。这表明NAFLD易感基因本身不会引起CAD,这些基因与CAD的关系似乎在很大程度上取决于血脂。这些研究结果提示我们,在设计针对NAFLD的新药时,应充分考虑血脂因素的影响。
尽管研究结果的具体细节不完全一致,但国内相关研究均支持NAFLD和ASCVD之间存在一定的关联,尤其是涉及VLDL分泌异常和混合性高脂血症所介导的机制。有学者认为影响NAFLD肝脏脂肪含量和血浆脂质水平的基因变异会对ASCVD风险产生影响,一部分会导致VLDL过剩,而另一部分则会导致VLDL滞留,从而对脂质产生截然相反的影响。全基因组关联研究有望在未来提供新的NAFLD基因位点,或可进一步阐明NAFLD、ASCVD、血脂及其他代谢因素之间的关系。
2 NAFLD与亚临床动脉粥样硬化标志物的相关研究
冠状动脉钙化(CAC)评分常用来评估冠状动脉粥样硬化的程度。一些横断面研究显示,NAFLD与CAC相关。然而,NAFLD本身是否影响CAC的发展仍存在争议。Eun等[12]的纵向队列研究纳入了846名NAFLD患者和886名非NAFLD正常对照者,结果显示,在基线CAC评分为0的受试者中,NAFLD影响钙化的发展(OR=1.49,95%CI=1.01~2.21,P=0.045)。然而,在基线CAC评分>0的受试者中,NAFLD对病情进展未见显著影响(P=0.734)。此外,NAFLD的严重程度与CAC的发展呈剂量依赖关系(P=0.043),并且独立于传统危险因素。这表明,NAFLD可能在CAC的早期发展中发挥了一定的作用,但与CAC的进展关联性不大。
另外一项回顾性分析研究了1 173名无症状中年韩国人NAFLD、代谢综合征和CAC进展之间的关系。虽然基线CAC评分没有显著差异,但与对照组相比,不合并代谢综合征的NAFLD患者其CAC进展的风险更高。此乃首次证明NAFLD为CAC进展的独立危险因素的研究[13]。此研究说明,在临床上我们应该着重关注NAFLD而非代谢综合征患者,因为前者罹患CVD的风险更高。
一项基于瑞典人口的研究显示[14],在调整混杂因素和代谢危险因素后,NAFLD与CAC评分显著相关。在代谢危险因素较少的受试者中,NAFLD和CAC的相关性最强。在该队列中,NAFLD与冠状动脉钙化独立相关,但与颈动脉粥样硬化指标无关。NAFLD和CAC之间的关联在代谢健康的受试者中最为显著。这提示NAFLD可能是CAD的危险因素。
多种研究方法评估NAFLD是否与亚临床动脉粥样硬化相关,但结果仍存在一定争议,这可能是由诊断方法、研究对象种族、样本量大小和统计学偏倚造成的。此外,NAFLD和CVD的危险因素大多交叉重叠,故难以评估每种疾病的独立风险。最近的几项研究表明NAFLD是CAC的独立危险因素,这或许产生了不同的分层方法,即将每个NAFLD患者划分为CAD、亚临床和临床。这种分层方法有望在研究NAFLD新疗法的同时为预防心血管病提供新的思路。
3 引起NAFLD和ASCVD的相关临床因素
3.1 混合型高脂血症
研究人员普遍认为载脂蛋白B是ASCVD的重要病因。这种低密度脂蛋白(LDL)假说得到了众多国内外研究的支持。过多的低密度脂蛋白颗粒在动脉血管壁中被氧化,引起巨噬细胞聚积,继而形成泡沫细胞,导致斑块形成。任何引起低密度脂蛋白胆固醇(LDL-C)水平升高的原因都会诱导动脉粥样硬化发生,包括基因和生活方式等。如上所述,NAFLD与ASCVD之间的关系在很大程度上取决于是否合并混合型高脂血症,而混合型高脂血症又常常与NAFLD并存。一项心脏研究提示[15],60%的混合型高脂血症患者存在肝脏脂肪样变性。
3.2 高凝状态
NAFLD-NASH直接导致ASCVD和动脉粥样硬化血栓事件的另一种机制是肝脏分泌促凝因子,特别是纤维蛋白原和纤溶酶原激活物抑制剂-1,这通常与促炎因子如TNF-α和IL-6共同介导[16]。NASH患者的促凝因子高于单纯脂肪样变性患者,并且这种关系独立于肥胖或其他潜在代谢异常因素。但目前缺乏大规模的前瞻性研究,期待进一步的研究能深入阐明二者之间的关系及机制。
3.3 胰岛素抵抗
胰岛素抵抗被认为是NAFLD的最基础的病理生理学改变之一。它可以导致高血糖,通过多种方式影响微血管和大血管稳态,促进动脉粥样硬化发生。高血糖又可进一步降低一氧化氮的释放,上调血管细胞黏附分子的表达,并刺激巨噬细胞摄取氧化的LDL。另外,已有研究证实,血糖及糖化血红蛋白的升高会使血管内皮细胞受损,刺激平滑肌细胞增殖,提高血小板活性,诱导氧自由基产生,从而促进动脉粥样硬化形成[17]。
3.4 高血压
高血压是ASCVD事件公认的危险因素之一。肾素-血管紧张素-醛固酮系统活性的增加也与NAFLD的发病有关,因为它本身可能加重胰岛素抵抗,并可能激活肝星状细胞,刺激肝纤维化。Kumar等[18]的研究表明,醛固酮水平与肝衰竭显著相关。当校正了体重、年龄、酒精摄入量和胰岛素抵抗等参数后,研究人员发现这种关联仅在女性中具有统计学意义。其研究结果提示非裔美国女性的醛固酮水平与脂肪肝呈正相关关系。
3.5 阻塞性睡眠呼吸暂停综合征
伴有代谢综合征和NAFLD的肥胖患者也常并发阻塞性睡眠呼吸暂停综合征(OSAS)。流行病学研究表明[19],OSAS与冠心病、心力衰竭、中风和心房颤动的发生发展有关。OSAS的周期性缺氧也被认为是NAFLD的促发因素之一。一项综合了18项研究的大型荟萃分析表明[20],OSAS与NAFLD、NASH和肝脏纤维化的风险增加相关,且独立于年龄、性别和身体质量指数(body mass index, BMI)。这提示我们对OSAS患者应筛查NAFLD。
3.6 肠道生态失调和慢性低度炎症
肠道微生态失调在NAFLD的发生发展中可能发挥着关键作用。研究表明,肠道微生态失调通过损伤肠上皮,增加肠黏膜通透性,将肝脏暴露于有害细菌代谢产物之中,从而加重肝脏炎症发展。肥胖和T2DM患者常出现小肠细菌过度生长和肠道通透性增加的情况。有研究表明[21-22],细菌及其代谢物可能在促进肝脏的低度炎症中发挥作用,并可能导致动脉粥样硬化。Wang等[23]的研究发现,除了传统危险因素外,肠道菌群代谢产物氧化三甲胺与CVD的发生具有相关性。氧化三甲胺通过上调巨噬细胞清道夫受体、细胞热休克蛋白、促炎症细胞因子表达以及提高血浆胆固醇水平等机制促进CVD的发生与发展。
4 NAFLD和动脉粥样硬化间的发病机制
最近的研究表明,NAFLD和全身炎症在动脉粥样硬化发展中具有重要作用。Kim等[24]的研究针对1 575名受试者进行了4年的随访分析,结果发现在NAFLD和超敏C反应蛋白(hs-CRP)水平偏高的人中,CAC最为严重。这表明合并NAFLD和全身炎症会增加CAC发生的风险。NAFLD和动脉粥样硬化相关的可能机制如下:①氧化应激和炎症反应。NAFLD患者会产生过量的活性氧簇(ROS),ROS生成增加可介导脂质过氧化,从而通过活化肝星状细胞导致炎症和纤维化。此外,ROS可抑制肝细胞分泌极低密度脂蛋白,从而导致肝脏脂肪累积。ROS过量产生会导致LDL氧化,随之促进巨噬细胞转化为泡沫细胞,而泡沫细胞代表着动脉粥样硬化病变形成的关键步骤,继而通过多种途径促使动脉粥样硬化进展,包括导致内皮细胞功能失调、血管平滑肌细胞增殖等。②免疫反应。血管粥样硬化斑块患者体内往往存在肝炎病毒、巨细胞病毒、支原体等多种感染,而感染的病原体通过多种方式导致血管原位免疫反应加剧,最终促进粥样斑块形成。此外,各种免疫因素通过调控多种黏附分子表达,也可对细胞免疫功能产生影响,进而促进病变进展。③肝细胞功能改变、胰岛素抵抗及脂肪源性激素等因素,也可促使NAFLD患者发生动脉粥样硬化。
5 问题与展望
综上所述,我们讨论了近年评估NAFLD与ASCVD关联的研究及其局限(表1)。众多研究表明,NAFLD与ASCVD存在较强的相关性,二者具有许多共同的危险因素。NAFLD患者合并肝纤维化越严重,发生心血管事件的风险就越大。然而,由于NAFLD诊断标准和疾病严重程度分层的异质性,以及其他多种混杂因素的存在,相关研究受到了一定的限制。此外,易诱发NAFLD的基因变异如I148M,与心血管事件的风险之间的关系尚存争议。尚无直接证据显示NAFLD可作为改善心血管危险分层和优化治疗的参考指标。因此,目前还无法确认NAFLD与CVD之间存在直接因果关系。针对以上问题,未来的研究应阐明预防或治疗NAFLD是否会对动脉血管壁产生附加影响。另外,关于NAFLD的特异性治疗方法正在研究当中,今后须完善前瞻性试验研究,借此明确相关治疗是否既可改善肝脏疾病又能改善CVD的发生和发展,并探讨NAFLD是否确为动脉粥样硬化的一个新的致病机理。
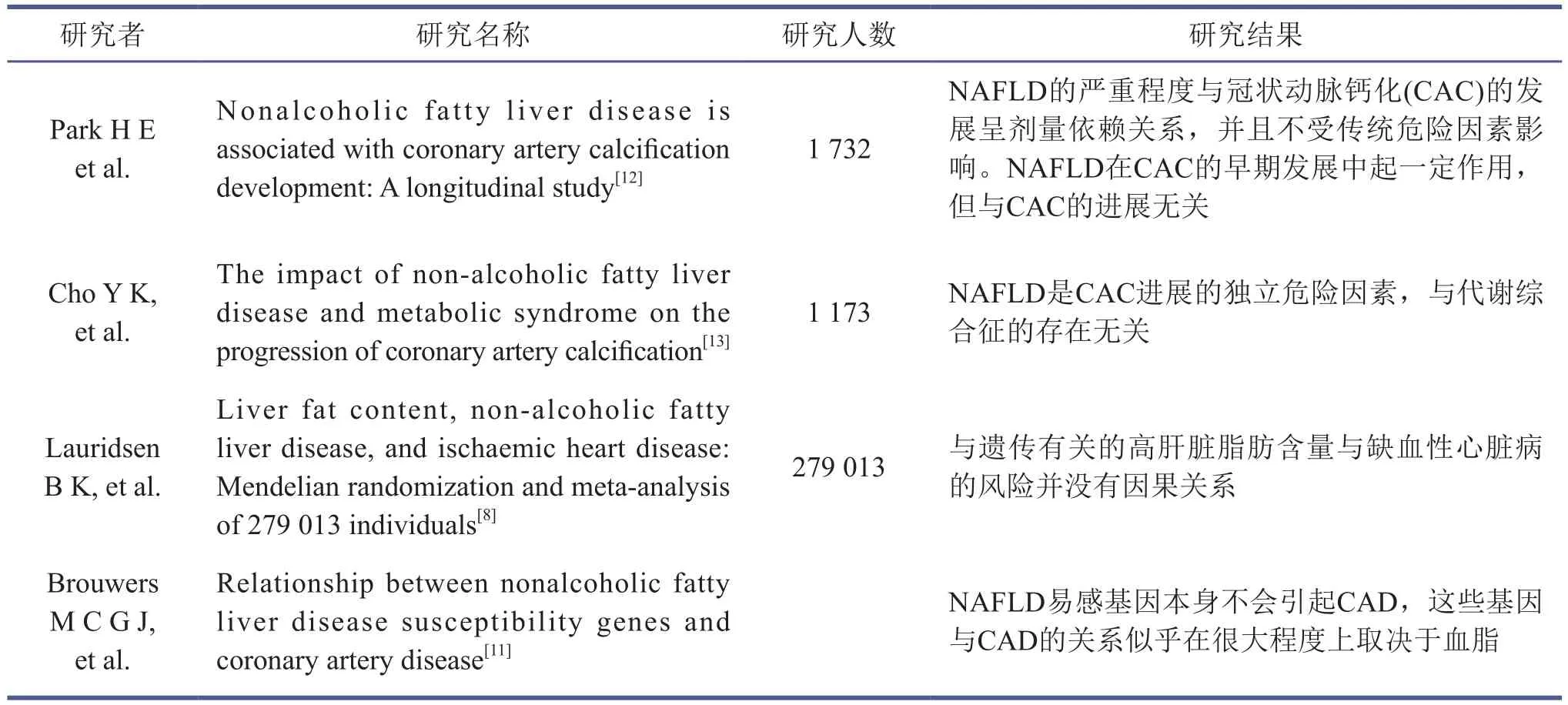
表1 NAFLD与ASCVD的临床研究结果

