免疫检查点抑制剂引起的心血管动脉粥样硬化事件及中西医防治策略
刘文静,张晓雨,韩松洁,代倩倩,商洪才
北京中医药大学东直门医院,中医内科学教育部和北京市重点实验室,北京 100700
近年来,免疫检查点抑制剂(ICIs)在肿瘤治疗中的临床应用日益广泛,对肿瘤患者的预后有明显改善,但其引起的药物毒性也逐渐凸显[1-3]。由于肿瘤具有免疫逃逸的特点,肿瘤细胞可以通过阻断T细胞激活、抑制T细胞免疫检查点蛋白表达等方式,妨碍免疫系统的激活[4]。其中,细胞毒性T淋巴细胞相关蛋白4(CTLA4)是T细胞启动和激活的重要调节因子[5],可与抗原呈递细胞上的CD80和CD86结合,减少活化的特异性抗原T细胞,导致T细胞的免疫应答能力下降。程序性细胞死亡蛋白(PD-1)及其配体(PD-L1)可以调节肿瘤及外周组织的免疫激活水平。PD1在激活的T细胞中表达上调,但与其配体 PDL1的相互作用会降低T细胞的增殖、活化和反应,与T细胞免疫应答功能的降低相关。因此,阻断这些免疫检查点可以再次激活T细胞的免疫应答能力,增强抗肿瘤作用。这种作用机制,促使了免疫检查点抑制剂 (ICIs) 的开发,并在肿瘤的治疗中发挥重要作用[6]。临床上使用的ICIs包括针对抑制性免疫检查点蛋白CTLA4、PD-1和PD-L1的单克隆抗体。如今,ICIs已被批准用于50多个适应症,符合ICIs治疗条件的癌症患者比例从2011年的1.54%增加到2018年的43.63%,并继续快速增长[7]。虽然ICIs最初只被批准用于转移性恶性肿瘤患者,但在过去10年里,它们已经成为癌症治疗的基石,ICIs疗法越来越多地与其他治疗方式相结合,如化疗、放射治疗和小分子抑制剂的靶向治疗等[8-12]。免疫相关不良事件(IRAEs)是众所周知的ICIs毒性,是由于丧失自我耐受性而导致的,这会触发可能影响每个器官的急性自身免疫性炎症反应[3],包括心血管系统[13-14]。最初,动脉血栓形成、冠状动脉疾病(CAD)、急性冠状动脉综合征(ACS)、心肌梗死(MI)和缺血性卒中等动脉粥样硬化血管事件(AVEs)并未被明确视为IRAEs,因此通常不被视为ICIs可能存在的毒性。然而,现在越来越多的证据表明ICIs和AVEs之间可能存在相关性。本文将讨论ICIs治疗对肿瘤患者心血管动脉粥样硬化的影响,产生这种心脏毒性的风险因素及风险评估,以及潜在的发生机制和中西医防治策略。
1 ICIs的心脏毒性与心血管动脉粥样硬化相关
关于ICIs引起心血管动脉粥样硬化的临床研究主要集中于案例报告和回顾性研究[15-16]。2017年的一项案例报道显示,4名肿瘤患者在接受PD-l抗体治疗后出现动脉血栓形成。对其中一名患者的血栓的组织学检查显示,血栓碎片中存在大量白细胞,包括中性粒细胞、单核细胞和巨噬细胞,还有罕见的CD3+T淋巴细胞和CD20+B淋巴细胞,未检测到肿瘤细胞的表达[17]。这些数据表明,PD-1阻断可能诱导加速的动脉粥样硬化斑块发育和炎症。这可能与PD-1受到抑制会影响T细胞的反应,从而增加血脂异常、血管炎症和动脉粥样硬化的风险有关[18]。在对一名使用ICIs成功治疗转移性骨巨细胞肿瘤患者的研究中发现,接受ICIs治疗一年后,患者发生了2次非ST段抬高型心肌梗死,左回旋支动脉的狭窄程度在2个月内迅速进展[19]。还有研究报道一名黑色素瘤患者在使用ICIs治疗后出现复发性心肌梗死,心导管检查显示支架内出现快速进展的再狭窄和弥漫性冠状动脉疾病,需要搭桥手术并停止ICIs治疗[20]。而ICIs引起的T细胞活性增强与冠状动脉疾病相关,因此对接受ICIs治疗的患者应密切监测动脉粥样硬化疾病的进展。
在一项关于“暴露于ICIs是否与心血管动脉粥样硬化事件相关”的研究中,对2 462名癌症患者,按照年龄、心血管病史和癌症类型匹配2 462个对照进行队列研究和病例交叉分析。结果显示,在包含已知的心血管危险因素的多变量(男性、年龄、体重指数、高血压、糖尿病、慢性肾病、吸烟、心血管事件史、使用他汀类药物、使用阿司匹林、血红蛋白和低密度脂蛋白) 模型中,ICIs治疗后复合心血管事件发生的风险增加了3倍(HR:3.3,[95% CI,2.0~5.5],P<0.001)。在该研究中,对接受 ICIs 治疗患者的病例交叉分析显示,与治疗前2年间的情况相比,ICIs治疗后2年间AVEs的发生率显著增加(66名AVEs患者(2.32%)对119名AVEs患者(4.2%);HR:4.78,[95% CI,3.50~6.53],P<0.001)。影像学研究结果显示,主动脉斑块的进展速度从之前的每年2.1%增长为每年6.7%,ICIs治疗后增长3倍以上[21]。在另一项回顾性研究中,1 215名患者接受了ICIs治疗。在治疗启动后的6个月内发生急性心血管事件的患者占2.6%[95% CI,1.8~3.6],他们的生存率明显低于没有发生急性心血管事件的癌症患者[22]。最近的一项系统评价分析了癌症患者接受ICIs治疗后AVEs的发生率。对符合纳入标准的17项研究结果分析显示,使用ICIs治疗的患者AVEs发生率是1.1%。其中,3个随机试验的结果分析显示,ICIs治疗与其他治疗相比,AVEs发生的相对风险是1.86。这提示ICIs相关的AVEs风险虽低但是不可忽略的,这种风险与单独或联合使用ICIs治疗没有显著相关性,可能与具有血栓形成风险的癌症类型相关,例如泌尿系肿瘤、妇科肿瘤、胰腺癌等[23]。然而由于回顾性研究可能存在选择偏倚,同时缺少样本量较大的前瞻性研究,对于与ICIs治疗相关的AVEs发生率的系统评价存在一定的局限性。在Kalyan等进行的一项关于ICIs治疗的肺癌患者发生AVEs的队列研究中,多变量的回归分析显示使用ICIs治疗的患者表现出血清肌钙蛋白I(TnI)和B型利钠肽(BNP)水平的升高,分别是TnI> 0.01 ng/mL(HR:7.27,[95% CI,2.72~19.43],P<0.001)和BNP>100 pg/mL(HR:2.65,[95% CI,1.01~6.92],P=0.047),增加了发生AVEs的风险[24]。
此外,动脉粥样硬化是一种慢性炎症性疾病[25],其炎症程度可以通过PET成像进行量化。18F-氟脱氧葡萄糖(FDG)是最常用的PET示踪剂,在动脉粥样硬化成像中具有公认的作用[26]。在对10例黑色素瘤患者进行短期ICIs治疗的研究中,治疗前后胸主动脉与颈动脉中18F-FDG摄取没有增加,提示ICIs短期治疗没有影响黑色素瘤患者的血管炎症。同一研究的动物实验结果显示,ICIs治疗不会影响高脂血症小鼠中的骨髓驱动的血管炎症,而ICIs对CTLA-4和PD-1的抑制加剧了动脉粥样硬化斑块中T细胞介导的炎症,从而加剧斑块向临床不利的表型进展[27]。这可能与人动脉粥样硬化斑块的形成是慢性过程有关,因而需要更广泛的研究来阐明抑制免疫检查点对人动脉粥样硬化的长期影响。
这些研究表明,ICIs治疗不仅引发了动脉壁的炎症,还增加了ICIs治疗患者动脉粥样硬化的进展速率,从而可能导致这些患者的AVEs发生率增加。然而关于ICIs对心血管动脉粥样硬化事件的临床数据仍然稀缺。到目前为止,ICIs对心血管动脉粥样硬化事件的影响很可能被低估了,可能有亚临床动脉粥样硬化,以及患有心血管疾病史的患者被排除在大多数临床试验之外,对于研究ICIs对肿瘤患者心血管动脉粥样硬化的影响产生了干扰。
2 ICIs治疗与心血管动脉粥样硬化事件的危险因素及风险评估
ICIs的广泛临床应用增加了心血管系统免疫相关不良事件的风险。在癌症患者中,ICIs对动脉粥样硬化相关心血管疾病的不利影响,可能导致心肌梗死等急性心血管事件[28]。因此,进行预测研究,通过风险分层,增加临床医生对ICIs引起的AVEs的认识,是预防这些不良事件的重要一步。
有研究认为,某些传统的心血管疾病风险因素在评估ICIs引起的AVEs方面具有一定作用。在对1 215名肺癌患者的研究中发现,高血压、高脂血症或心血管病史会增加接受ICIs治疗患者发生AVEs的风险(表1)[22]。通过CT 成像对76名接受过ICIs治疗的癌症患者进行冠状动脉和主动脉钙化的定性评估,以分析血管钙化与 ICIs治疗后心血管事件之间的关联性。结果显示,在发生心血管事件的患者中,在治疗前CT成像上观察到更严重的冠状动脉和主动脉钙化,发生AVEs的患者冠状动脉严重钙化的发生率是未发生AVEs患者的两倍多(35% vs. 15%),主动脉钙化的发生率则将近两倍(50% vs. 30%),表明亚临床动脉粥样硬化的存在与ICIs引起的AVEs有关[29]。相比之下,也有一些研究发现心血管疾病的常规风险因素对ICIs治疗引起的AVEs没有显著影响。在一项研究的亚组分析中发现,与高血压患者相比,无高血压患者在接受ICIs治疗后发生AVEs的相对风险更高(HR:10.7 [95%CI,6.1~18.8] vs. HR:3.4 [95% CI,2.4~4.9]),而体重指数、年龄、糖尿病等对增加ICIs引起的AVEs风险没有明显差异[21]。Walter等的研究也证实,除年龄外,吸烟、高血压、高脂血症、糖尿病等心血管疾病的风险因素对ICIs引起的AVEs没有显著影响[29]。这些研究结果表明,传统的心血管疾病风险因素和ICIs治疗引起AVEs的风险因素之间的关联性存在偏倚,与ICIs引起动脉粥样硬化血管疾病的临床数据仍然比较稀缺有关。此外,由于接受ICIs治疗的患者在接受治疗时可能具有潜在的心血管疾病风险因素,如合并高血压或高脂血症,在使用ICIs治疗的同时与降压药或他汀类药物联用,降低了心血管疾病的风险,从而导致传统风险因素与ICIs引起AVEs之间的关联性减弱。因此,为了能正确评估ICIs引起AVEs的风险因素,未来的研究应该侧重于避免在回顾性研究中可能发生的偏倚,或进行前瞻性队列研究。此外,ICIs的联合使用使其抗肿瘤作用增加的同时对动脉粥样硬化的风险也随之增加。在接受联合免疫治疗的非小细胞肺癌患者中,心肌梗死的发生率高于接受单一免疫治疗的患者(3.4% vs. 0.5%,P=0.001)[30]。
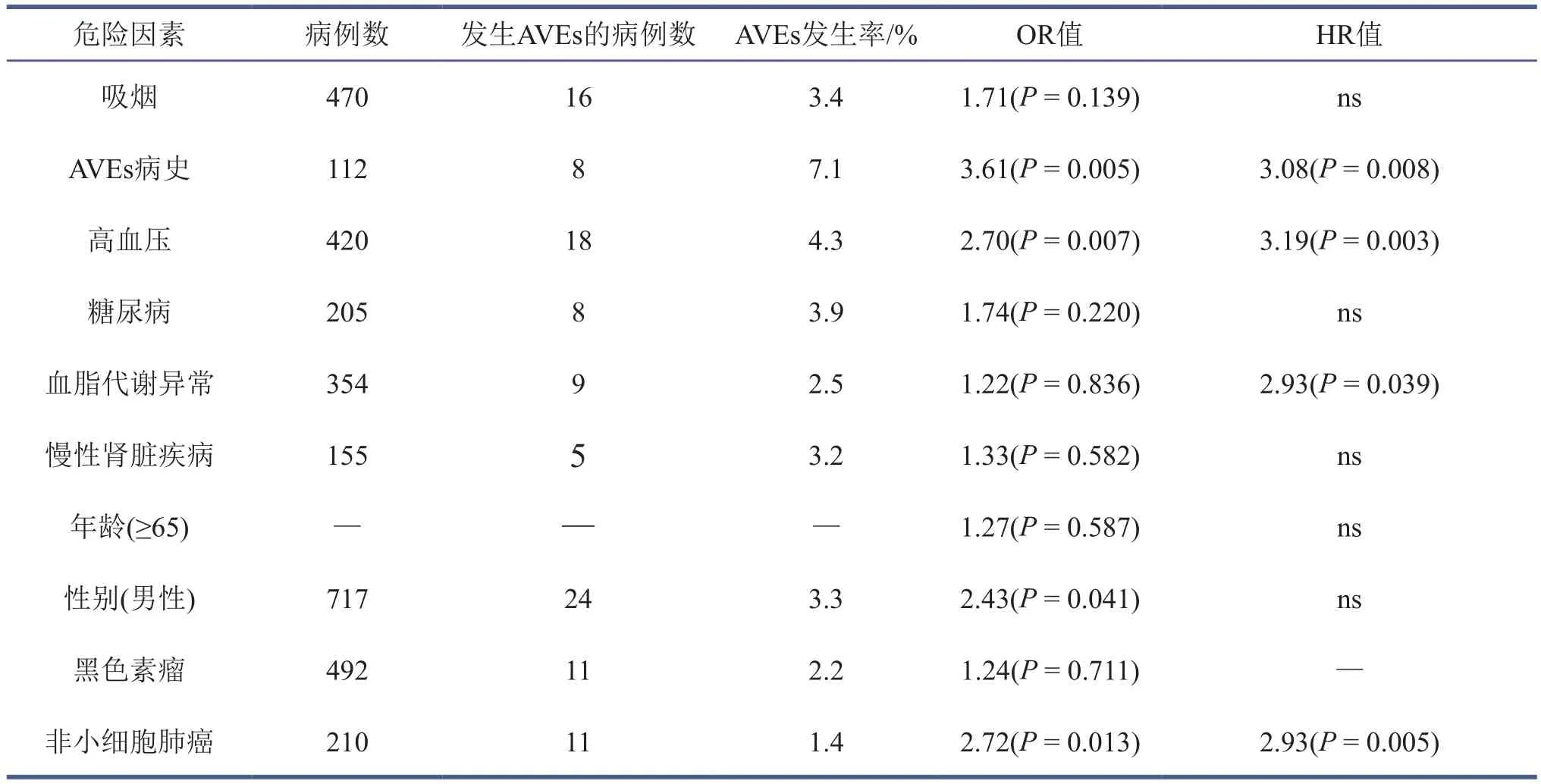
表1 接受ICIs治疗患者发生AVEs的风险因素[22]
研究者通过研究治疗前高敏肌钙蛋白T(hs-TnT)水平,判断对ICIs治疗引发心脏毒性的预后价值,结果发现只有在基线时(hs-TnT ≥ 14 ng/L)患者才会发生卒中或新发心力衰竭。此外,在13名心脏病受累程度发生进展的患者中有9名患者的基线hs-TnT ≥ 14 ng/L (P=0.012),提示在接受ICIs治疗的患者中,基线 hs-TnT可预测复合心血管终点和3个月时心脏受累的进展,而14 ng/L 可作为最佳临界值[31]。针对接受 ICIs 治疗的肺癌患者发生的包括心梗在内的心血管不良事件,进行病史、实验室值、ICIs前心电图和超声心动图结果分析,结果显示发生心血管不良事件的患者,其中性粒淋巴细胞比率和C反应蛋白水平与基线相比显著升高。然而,研究者仍需要更大的数据集来验证并确定这些指标用于ICIs引发心血管动脉粥样硬化不良事件预测因子的准确性。
3 与ICIs治疗相关的心血管动脉粥样硬化事件的潜在机制
动脉粥样硬化是一种慢性炎症性疾病。不同免疫细胞之间的相互作用可以通过炎症介质的分泌促进动脉壁的动脉粥样硬化[32]。免疫检查点是具有调节T细胞活化作用的膜蛋白。在初始T细胞受体介导的激活信号发出后,在抗原呈递细胞(APC)和T细胞上表达的免疫检查点蛋白提供对细胞激活至关重要的次级信号,然后再由细胞因子等提供T细胞激活的第三个信号,它们在一定程度上也受免疫检查点蛋白的调节[33]。同时,免疫检查点还促进免疫细胞和非免疫细胞之间的相互作用,从而协调细胞因子、趋化因子等与炎症反应相关因子的分泌、存活、增殖和细胞极化等[34-35]。免疫检查点蛋白通过促进这些免疫细胞相互作用在动脉粥样硬化形成中发挥核心作用,因此,通过ICIs阻断免疫检查点可能会影响动脉粥样硬化的进展[36]。ICIs可以在已有的冠状动脉粥样硬化斑块中激活炎症,并引发纤维帽破裂,引起急性冠状动脉血栓形成和心肌梗死[14]。在正常生理条件下,免疫检查点对于维持自身免疫以及在免疫系统对病原体感染作出反应时保护组织免受损伤至关重要。免疫检查点蛋白作为免疫系统中的重要因子,可以防止T细胞过度活化而导致机体产生炎症损伤。肿瘤细胞会利用免疫应答系统的这一特点,模拟过表达免疫检查点因子的现象,从而减轻机体的免疫系统对肿瘤细胞的免疫应答和清除能力,促进肿瘤细胞的增长[6]。当这些免疫检查点被抑制时,与ICIs相关的全身促炎状态可能增加血栓栓塞的风险[37]。
另一种说法是在没有动脉粥样硬化的情况下,ICIs可以直接激活T细胞介导的冠状动脉炎。研究发现,PD-1-/-的小鼠表现出更大的动脉粥样硬化病变的形成,存在大量的CD4+和CD8+T细胞和巨噬细胞,并伴有更高水平的血清TNF-α值。给予阻断性抗PD-1抗体会引起病灶T细胞增多,增加病灶炎症。PD-1在下调促动脉粥样硬化T细胞反应方面具有重要作用,而作为ICIs的PD-1抗体可以反过来加剧动脉粥样硬化的炎症性病变,因此阻断该分子用于治疗病毒感染或癌症可能会增加心血管并发症的风险[38],其潜在机制可能与增加了炎症反应有关。另外,ICIs可能通过激活凝血和血小板以及破坏纤维蛋白溶解来增强血栓前状态[37]。ICIs抑制剂可通过调节巨噬细胞极化进而发挥抗肿瘤作用,但动物研究发现其心脏损伤效应与促进巨噬细胞极化有关,其中PD-1抑制剂通过调节miR 34a/KLF4信号通路增加炎症反应,促进巨噬细胞M1极化和心脏损伤的作用[39]。这些发现可能有助于我们了解ICIs治疗过程中心脏损伤的发病机制,并为改善ICIs治疗的癌症患者的心脏损伤提供新的靶点(图1)。

图1 ICIs治疗相关的动脉粥样硬化性心血管事件的潜在机制
4 与ICIs治疗相关的心血管动脉粥样硬化事件的中西医治疗策略
目前阿司匹林和他汀类药物被认为是肿瘤治疗引起的动脉粥样硬化相关心脏毒性的备选药物。动脉粥样硬化且有血栓形成高风险的患者应被认为是用阿司匹林和他汀类药物治疗的候选者。虽然用抗血小板药物加上口服抗凝血剂的治疗不会降低患者心血管事件的风险,但对于有血管内皮功能障碍的肿瘤患者来说,使用具有抗血小板活性的阿司匹林联合他汀类药物来预防血管内皮功能障碍是相对安全的[40]。但考虑到肿瘤患者其抗血栓形成的管理效果有限,因此,通过长期抗血栓治疗以减少血栓形成和出血的风险也应纳入考量[41]。此外,研究发现通过改变ICIs治疗使用的剂量和联用方式,可以减轻ICIs相关的不良反应。在对晚期黑色素瘤患者的治疗随访中,采用NIVO3+IPI1治疗方案的患者其3~5级不良反应的发生率为34%,而采用NIVO1+IPI3治疗方案的发生率为48% (P= 0.006)[42]。因此,使用低剂量ICIs联合治疗,可能减少相关的心血管不良事件,但仍需进一步的研究验证。对于有急性冠脉综合征症状和心电图结果的患者,应予以标准护理并接受冠状动脉造影检查,必要时行经皮冠状动脉介入治疗。总之,针对ICIs引起的心血管动脉粥样硬化事件,目前仍没有规范的西医治疗方案(表2)。

表2 西医治疗ICIs引起的心血管动脉粥样硬化事件的潜在策略
中医药作为中国传统文化的瑰宝,具有多活性成分、多靶点、多途径的特点,在防治动脉粥样硬化、恶性肿瘤等方面均具有良好的治疗作用[43-44]。研究发现,多种中药复方可以通过胆固醇逆转运,减少泡沫细胞内的甘油三酯含量,促进胆固醇外排,减少脂质沉积,从而减少动脉粥样硬化[45-46]。包括银丹心脑通在内的多种中药复方可通过调控不同信号通路,降低TNF-α等相关炎症因子表达[47-48],诱导M2型巨噬细胞的标志物在巨噬细胞中高表达,阻止巨噬细胞向分泌促炎因子的M1型转化,使巨噬细胞向分泌抑炎因子的M2型转化[49],抑制炎症反应,延缓动脉粥样硬化进展。中医理论指出“心与小肠相表里”。中药复方还可通过改变或调节肠道菌群组成,进而改变肠道功能,影响与动脉粥样硬化关系密切的肠道菌群代谢物,调节肠道代谢相关通路,来发挥抗动脉粥样硬化的作用[50-51]。临床研究显示,在乳腺癌使用化疗药物序贯治疗的基础上增加使用中药注射剂治疗后,治疗组患者全血高、中、低切黏度和血浆黏度均低于单纯化疗药物组,且中医症状积分及TNF-α等炎症因子表达均有所降低,从而通过促进血液循环、抑制炎性因子等作用减轻化疗药物的心脏毒性[52]。上述研究显示,中医药可通过多成分、多靶点、多途径发挥多重治疗作用。对于ICIs引起的心血管动脉粥样硬化事件,其治疗策略的核心为增效减毒,增加药物的抗肿瘤活性,降低ICIs引起的动脉粥样硬化。因此,中医药及有效成分可作为ICIs引起的心血管动脉粥样硬化事件的潜在治疗策略进行研究和探索。中医药及有效成分可通过自噬、抗炎等途径发挥对动脉粥样硬化的治疗作用[53],促进胆固醇流出,减少脂质沉积[45],显著减少斑块面积和胆固醇积累。通过提高CD4+T细胞比例,恢复免疫平衡,调节脂质代谢,调节炎症因子水平,抑制炎症反应,增强斑块稳定性[54],并能通过影响脂质代谢和血液循环,改善血管内皮功能,发挥对心肌梗死的二级预防作用[55]。具有抗肿瘤活性的中药成分则能通过促进体内CD8+T细胞中糖酵解基因的表达,逆转效应CD8+T细胞功能障碍并增强T细胞识别作用,改善肿瘤微环境,显著抑制肿瘤生长[56]。此外,现代药理研究表明,单一的中药成分也具有多种药理活性,如丹参的有效成分丹参酮IIA具有抗炎和抗氧化活性。因其具有显著的心脏保护作用,同时还具有广泛的免疫调节作用,通过调节免疫细胞的功能和激活,减少炎症介质的产生,从而使其具有抗炎、抗凝、抗血栓形成等心血管保护作用,还能通过诱导分化和凋亡发挥抗肿瘤作用[57]。因此,探索和开发具有促进ICIs抗肿瘤作用、降低动脉粥样硬化不良反应的中医药治疗策略,具有广阔的发展前景。
5 结论和展望
在本综述中,我们通过对已发表研究的讨论,证明了接受ICIs治疗的患者心血管动脉粥样硬化的发病率增加。随着ICIs使用范围的日益增加,ICIs相关动脉粥样硬化不良事件患者的数量预计也将在未来几年有所增加。因此,了解ICIs引起患者发生动脉粥样硬化改变的机制至关重要。另外,应研究探索使用常规的心血管治疗药物来减轻ICIs的不利影响。截至目前,常规的心血管疾病危险因素尚未能够与ICIs引起的心血管动脉粥样硬化不良事件的风险紧密关联,而通过冠状动脉CT以及C反应蛋白等辅助检查,以评估和预测具有动脉粥样硬化不良事件风险的患者也需要发展和验证。为了使ICIs治疗患者能及时发现潜在的动脉粥样硬化不良事件风险,密切的临床监测和相关不良事件前期症状的自我监测,从现阶段来说是降低ICIs治疗患者的动脉粥样硬化不良事件的发生率和死亡率的重要环节。加强医生之间的合作交流,发现能够有效减少ICIs引起的心血管动脉粥样硬化事件的发生的治疗策略,发挥中医药多成分、多效应的优势,在未来值得进一步探索研究。

