普渡大学团队成功解析苯甲醛在植物中的合成途径无任何有毒有害副产物,还可作为苯甲醇的潜在生产方式
早在19世纪中叶,人们就认识到芳香化合物单体在香气贡献中的重要作用,并开始采用化学法进行合成,从而代替一些稀有的或者昂贵的天然香料,但是直到20世纪才实现合成香料的大规模生产。苯甲醛是最早合成的重要芳香物质之一。
苯甲醛是自然界存在的结构最简单的,同时也是工业上最常用的芳香醛,常常被形容为具有特殊的杏仁香气或者樱桃香味。它广泛存在于多个科属植物的花、果实和叶片中,具有吸引昆虫授粉者和抑制真菌生长等作用。
尽管被广泛用作商业食品调味品和工业溶剂,苯甲醛的主要用途仍是用于合成从医药品到塑料添加剂的各种其他化合物,也是生产香水、香料和合成某些苯胺染料的重要中间产物。
一般来说,苯甲醛主要通过化学合成和天然提取获得,天然提取又包括植物和动物来源。当前主要的制备途径为甲苯的液态氯化或氧化。已经被淘汰的制备方法包括苯甲醇的不完全氧化、苯甲酰氯的碱解和苯与一氧化碳的加成。化学合成具有环境不友好、反应条件复杂等很多缺点。
“苯甲醛也可由昆虫、非昆虫节肢动物和微生物产生,而相对于动物来源,植物生产苯甲醛的优势在于潜在的产量巨大,生产过程相对便利,对生产条件要求不高,容易实现绿色环保生产,且植物提取产品直接用于食品工业的安全性和附加价值较高,消费者非常容易接受。”黄惺祺表示。

多年以来,研究者只知道植物中的苯甲醛由苯丙氨酸合成而来,但是直接合成苯甲醛的酶基因一直没有被克隆到。不少研究组从多组织、多时间点的转录组入手进行相关性分析,试图筛选到一些候选基因并验证功能,但是都没有成功。
2022年2月,发表在《自然·通讯》期刊上的一项研究成功解析了苯甲醛在植物中的生物合成途径。
文章的第一作者黄惺祺博士2007年考入南京大学,本科毕业后,继续在南大生科院卢山教授实验室进行研究生学习,并于2018年获得博士学位。之后他前往普渡大学从事博士后研究工作,在农学院生化系娜塔丽娅·都达瑞娃教授的领导下,研究植物挥发物次生代谢及调控。

黄惺祺
01 解析苯甲醛在植物中的合成途径
为了吸引传粉者,矮牵牛花会在夜间合成并释放大量含有苯环的挥发性有机化合物,其中,苯甲醛的含量为第二高。目前一般认为苯甲醛可以通过肉桂酸的β氧化或者非β氧化途径合成而来,黄惺祺和合作者首先利用同位素标记法,证明了在矮牵牛中苯甲醛通过肉桂酸的β氧化途径合成。
“理论上,通过β氧化机理合成苯甲醛最简单的方式是直接将苯甲酰辅酶A还原成苯甲醛,于是我们尝试用矮牵牛花瓣蛋白粗提物检测苯甲醛合酶的活性。幸运的是,我们测试的第一种辅酶NADPH正是苯甲醛合酶利用的还原剂,这样一来,就确定了矮牵牛苯甲醛合酶的两个底物是苯甲酰辅酶A和还原型辅酶II。”黄惺祺表示。
尽管相关性分析在过去五到十年中帮助鉴定到了大量的次生代谢基因,依然存在很多代谢步骤尚未得到解析。黄惺祺他们决定利用团队发现的底物和反应条件进行酶纯化。

矮牵牛花中天然PhBS的部分纯化
黄惺祺指出,酶纯化正是该研究中阻力最大的一步。这个酶在前期实验中表现出了极高的体外酶活,因此尽管苯甲醛是矮牵牛花香中含量第二高的化合物,但与其他花香合成酶不同,直接负责合成苯甲醛的酶在总蛋白中的比例却很低,因此前期的几次纯化都没有鉴定到正确的基因。“我们通过不断提高起始植物材料的用量并优化纯化方法,才能在蛋白胶上看到对应的条带。”
“最终我们从大约400朵矮牵牛花花瓣中纯化到多个具有苯甲醛合酶活性的组分,并通过蛋白质谱鉴定,最终锁定两个具有NADPH结合结构域的候选蛋白。由于这两个蛋白的分子量之和刚好接近于矮牵牛花瓣苯甲醛合酶的表观分子量(通过凝胶阻滞色谱测定),拿到这个结果时我们高度怀疑这两个蛋白就是我们要找的酶,它们可能通过形成异源二聚体发挥功能。”黄惺祺说道。
后续的体外和体内实验进一步验证了他们的猜想,即这两个蛋白单独存在时没有苯甲醛合酶活性,只有在形成异源二聚体时才具有酶活,并且这个异源二聚体酶负责了矮牵牛花中主要的苯甲醛合成通量。
另外,团队还通过体外酶活证明,这两个亚基在其他物种中的同源蛋白,包括拟南芥、番茄和扁桃,同样通过组成异源二聚体形成有活性的苯甲醛合酶,并且物种间的α和β亚基之间绝大多数也能形成有功能的异源二聚体,说明异源二聚体酶可能是进化过程中相对保守的合成苯甲醛的方式。
植物细胞中绝大多数生化反应都由单基因编码的酶催化,异源二聚体酶参与代谢的情况屈指可数。“本工作鉴定到的异源二聚体苯甲醛合酶,很可能是第一个鉴定到的参与植物挥发物次生代谢的酶,这提示我们植物的次生代谢很可能比我们之前预想的要更加复杂。”
黄惺祺从中得到的启示是,未来遇到任何难以通过相关性分析鉴定的代谢步骤,思路不能局限在单基因这个层面,很有可能再次出现异源二聚体甚至多酶复合体的情境。
针对这一研究,限于文章的篇幅和侧重点,仍然留有不少疑问,例如两个亚基是否都有催化活性?还是只有其中一个亚基具有催化活性?亦或是两个亚基共同组成酶活性中心?两个亚基形成二聚体的结构基础是什么?有哪些关键氨基酸参与了蛋白之间的相互作用?
对此,黄惺祺表示,“这些疑问只能通过结构生物学的数据来揭示。目前正在与合作实验室共同解析矮牵牛苯甲醛合酶的蛋白晶体结构。”
02 在实际生产中意义重大
目前食品香精行业使用的苯甲醛主要由半化学合成方法生产,天然来源的苯甲醛在实际应用中的占比很低。传统的天然来源苯甲醛主要通过苦杏仁苷水解产生,但这种方法获得的苯甲醛通常有少量有毒化合物氢氰酸污染,很难去除干净。
植物合成苯甲醛也存在类似的困难或者劣势。较高浓度的苯甲醛对细胞存在明显的毒性,很难在胞内积累到很高的浓度。植物细胞会将苯甲醛氧化成苯甲酸或者还原成苯甲醇以降低细胞毒性,苯甲酸和苯甲醇则可以很容易发生糖基化衍生储存起来并进一步降低毒性。此外由于苯甲醛本身的挥发性较高,当合成代谢非常旺盛时也可能通过挥发逸散发生损失。
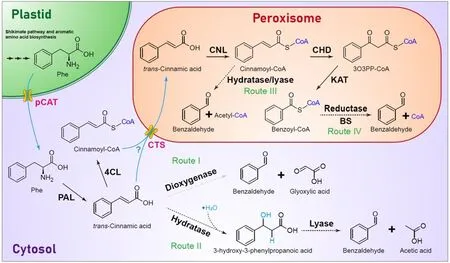
植物中苯甲醛的生物合成途径
据黄惺祺介绍,“通过异源二聚体苯甲醛合酶合成苯甲醛,没有任何有毒有害副产物生成,可以放心地用作食品工业的风味添加剂,该生物合成途径还可能通过基因转移到酵母或其他微生物中,成为广泛用于食品和饮料生产的发酵过程。”
同时,该研究还有一个重要的潜在利用方向。鉴于植物细胞中很容易发生苯甲醛的还原反应生成苯甲醇,且苯甲醇可以进一步糖基化衍生后大量存储在细胞中,该方法也可以作为天然来源苯甲醇的生产方法。
“事实上本项研究中,仅仅通过验证性质地在烟草叶片中瞬时转化矮牵牛苯甲醛合成通路基因,并联合伺喂苯丙氨酸底物,就可以轻松获得大约140微克/克鲜重的苯甲醇产量,如果以产量为首要目标进行深度合成生物学优化,完全可能在烟草叶片中获得更高的产量。”

