双硫仑联合用药抗肿瘤机制研究进展*
何 越,孙一鸣,涂明洁,张红丽,崇殿龙
(1.蚌埠医学院临床医学院,安徽 蚌埠 233000;2.蚌埠医学院第一附属医院药剂科)
双硫仑(DSF)作为已经使用了数十余年的抗酒精成瘾药物,其药物动力学已得到了充分的研究,对于新医学应用而言,探索研究新的抗肿瘤药物一直是药物研发者们的重要课题。但由于新药研发成本高、周期长,近年来老药新用成为了肿瘤治疗领域的研究热点之一,老药新用较开发新药更快,更便宜,风险更低 。随着近年来科研工作者对DSF研究的不断深入,已有越来越多的证据表明DSF具有较好的抗肿瘤活性,并且在与其他抗肿瘤药物联合使用时显示出较好的协同抗肿瘤效果。本文着重简述DSF的抗肿瘤机制,并对DSF近年来联合其他抗肿瘤药物的研究进展进行总结,以期为DSF治疗肿瘤的基础研究和临床治疗提供参考。
1 DSF抗肿瘤机制
众多研究发现,DSF需要与铜、锌等金属离子螯合形成稳定的络合物才能发挥其抗肿瘤作用。DSF-金属络合物能够通过抑制蛋白酶体的活性、调节乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)的活性、诱导活性氧(reactive oxygen species,ROS)的产生、抑制核因子κB(nuclear factor,NF-κB)通路、激活氨基末端激酶(c-Jun N-terminal kinase,JNK)通路和抑制P-糖蛋白(P-glycoprotein,P-gp)的活性等多种机制抑制肿瘤细胞生长。随着研究者对其进一步研究发现,DSF还能通过阻滞细胞周期、抑制线粒体功能和增强抗肿瘤免疫诱导肿瘤细胞凋亡(图1)。
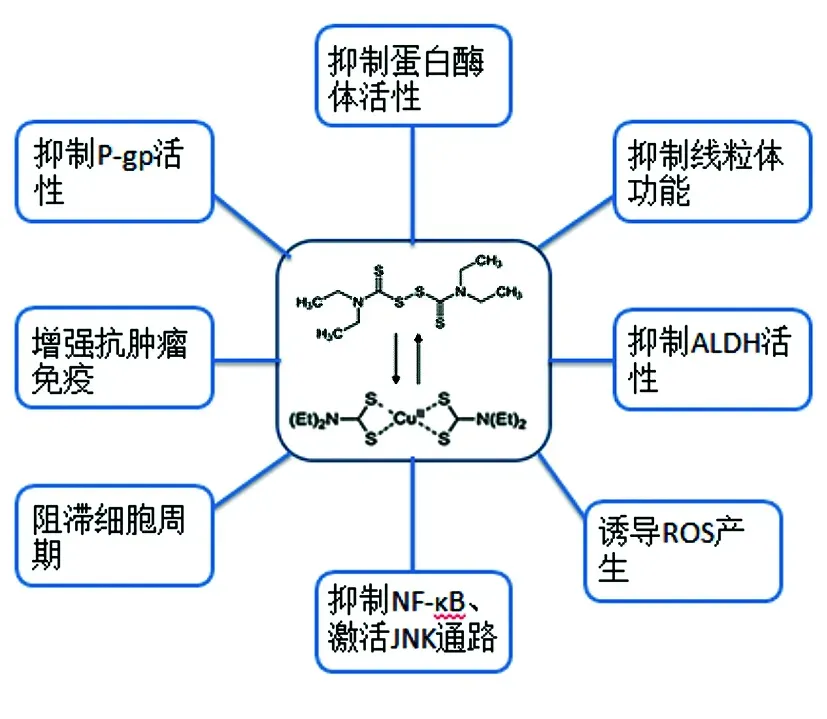
图1 双硫仑抗肿瘤作用机制
1.1抑制蛋白酶体活性 泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径。肿瘤细胞具有高水平的蛋白酶体活性,而蛋白酶体抑制剂能够抑制蛋白酶体的活性,选择性诱导蛋白质稳态破坏,使泛素化蛋白和毒性蛋白在细胞内蓄积,从而促进肿瘤细胞凋亡。有研究发现,在肝细胞癌[1]和食管鳞状癌[2]等多种癌细胞中,DSF均能抑制蛋白酶体的活性,抑制肿瘤细胞的生长。
1.2抑制ALDH活性 ALDH在肿瘤干细胞(Cancer Stem Cells,CSCs)中高度表达,与肿瘤的发生和发展、转移和复发以及耐药性的产生密切相关。近期有研究报道,DSF能够抑制ALDH+CSCs,从而抑制急性髓细胞性白血病[3]和多发性骨髓瘤[4]细胞的生长和复发。还有研究发现,DSF能通过抑制ALDH的活性,逆转ALDH+细胞的耐药性,增强顺铂[5]和吉西他滨[6]的细胞毒作用。
1.3诱导ROS产生 ROS蓄积会对DNA、蛋白质和生物膜等造成损害,导致细胞死亡。与正常细胞相比,肿瘤细胞内具有较高浓度的ROS。已有相关研究证明,在乳腺癌[7-8]、鼻咽癌[9]、头颈部鳞状细胞癌[10]和急性髓细胞性白血病[11-12]等多种癌细胞中,DSF均能诱导ROS产生,进一步增加肿瘤细胞内的ROS,从而破坏细胞氧化平衡状态,诱导肿瘤细胞凋亡。此外,DSF还能够诱导ALDH+乳腺癌细胞产生ROS,增加癌细胞对顺铂的敏感性,增强顺铂对乳腺癌细胞的毒性作用[7]。
1.4抑制NF-κB通路 核转录因子NF-κB能够促进癌基因的表达,抑制细胞凋亡。肿瘤细胞中NF-κB通路持续激活,促进了肿瘤的生长和转移,并诱导耐药性的产生。DSF能通过抑制NF-κB的表达,抑制乳腺癌[8]和急性髓细胞性白血病[12]细胞的生长和转移。研究发现,DSF/Cu还能通过抑制NF-κB的活性增强紫杉醇[8]和5-氟尿嘧啶[13]对肿瘤细胞的细胞毒作用。
1.5激活JNK通路 JNK信号通路能够通过调节凋亡蛋白的表达和Bcl-2家族蛋白的活性调控细胞凋亡。在乳腺癌[8]、头颈部鳞状细胞癌[10]、急性髓细胞性白血病[12]和骨髓瘤细胞[14]的研究中发现,DSF能够通过激活JNK通路抑制肿瘤细胞的生长:肿瘤细胞经DSF处理后,胞内磷酸-JNK,磷酸-CJUN和磷酸-P38的水平升高,增加肿瘤细胞凋亡。
1.6抑制P-gp活性 P-gp能主动外排抗肿瘤药物,直接或间接调控细胞凋亡。肿瘤细胞高度表达P-gp,从而导致耐药性的产生。研究发现,DSF能通过抑制P-gp的活性,逆转肿瘤细胞的耐药性,有效增强紫杉醇[15]和阿霉素[16]对肿瘤细胞的杀伤作用。
1.7阻滞细胞周期 细胞周期阻滞是多种抗癌药物的作用机制之一,已有研究证明DSF/Cu也可通过阻滞细胞周期进程有效诱导肿瘤细胞生长抑制和凋亡。在急性髓细胞性白血病中,DSF/Cu能够增强抑癌基因FOXO的表达,抑制癌基因MYC的表达,诱导G0/G1细胞周期阻滞和肿瘤细胞凋亡[11]。DSF最终代谢产物DDC-Cu可以轻松穿过A549细胞的细胞膜,并长时间在细胞内积累,导致细胞周期停滞在G0/G1期,从而诱导肿瘤细胞凋亡[17]。在肝细胞癌体外模型Hep3B细胞系中,DSF使细胞周期蛋白D1表达减少,引起G0-G1期细胞周期停滞,从而触发了凋亡途径的激活,导致肿瘤细胞死亡[18]。DSF/Cu还能诱导多发性骨髓瘤细胞[14]和人低分化性鼻咽癌细胞[19]的G2/M细胞周期停滞和凋亡。
1.8抑制线粒体功能 DSF-Cu能削弱线粒体功能,在肿瘤治疗中具有潜在的抗肿瘤活性:DSF-Cu能降低乳腺癌MCF-7细胞的线粒体膜电位,从而通过线粒体依赖性凋亡途径诱导肿瘤细胞凋亡[7]。在人低分化性鼻咽癌细胞中,DSF-Cu会使线粒体膜发生改变,导致线粒体膜电位降低,从而通过影响细胞骨架和线粒体功能触发线粒体依赖性凋亡途径,诱导肿瘤细胞凋亡[19]。
1.9增强抗肿瘤免疫 免疫原性细胞死亡(immungentic cell death,ICD)可以增强抗肿瘤免疫应答,有效提高抗肿瘤免疫治疗效果。在结直肠癌细胞中,DSF能诱导肿瘤细胞凋亡,且ICD信号分子:钙网蛋白、热休克蛋白70的表达增加,说明DSF可能是通过诱导免疫原性细胞死亡来发挥抗肿瘤作用[20]。肿瘤微环境相关巨噬细胞影响肿瘤进展和免疫治疗效果。趋化因子信号调节因子FROUNT是控制肿瘤相关巨噬细胞的靶点,FROUNT的低水平表达与较好的临床结果相关。DSF能直接与FROUNT结合并干扰FROUNT-趋化因子-受体的相互作用,降低巨噬细胞促肿瘤活性,减缓肿瘤进展[21]。
1.10其他 DSF可以通过抑制EGFR/Src/ VEGF通路抑制肿瘤的生长。DSF能抑制胶质母细胞瘤细胞中表皮生长因子受体(epidermal growth factor receptor,EGFR)磷酸化,进而抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)分泌,抑制血管生成[22]。DSF还能通过抑制金属蛋白酶10的活性抑制可溶性MHC I类多肽相关序列A(MHC class I polypeptide related sequence A,MICA)产生并选择性上调膜结合MICA,抑制肝癌细胞的增殖和迁移[23]。
Kim等[24]研究发现,DSF能通过抑制HER2/Akt通路,消除癌细胞干性,诱导阳性HER2乳腺癌细胞凋亡。DSF可通过抑制STAT3通路抑制肿瘤:用DSF处理三阴性乳腺癌细胞后,磷酸化STAT3水平下降,CSCs生长受到抑制[25]。此外,DSF还能通过激活钙蛋白酶抑制三阴性乳腺癌细胞的生长和侵袭[26]。
2 联合用药
目前临床上常用的抗肿瘤药物主要通过干扰核酸代谢、破坏DNA结构和功能、影响转录过程、抑制蛋白质合成等方式发挥作用。联合用药能针对并抑制肿瘤细胞的不同代谢途径,有效提高抗肿瘤作用。DSF已被证明在与其他抗肿瘤药物联合使用时可有效逆转肿瘤细胞的耐药性,增强药物的细胞毒作用,且能减少用药剂量、降低毒副作用,在肿瘤治疗方面有望成为一种抗肿瘤佐剂。
2.1干扰核酸代谢的代表药物
2.1.1氟尿嘧啶(5-氟尿嘧啶,5-fluorouracil,5-FU) 由于早期诊断的困难和对放化疗的高度耐药性,胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)的治疗效果极差。但近期有研究发现,DSF与5-FU联合使用时,DSF可以通过抑制NF-κB活性明显增强5-FU的细胞毒作用,协同诱导肿瘤细胞凋亡,并显著提高患者的总体存活率[13]。
2.1.2阿糖胞苷(cytarabine,Ara-C) 阿糖胞苷在临床上主要用于急性髓细胞性白血病(acute myelogenous leukemia,AML)的治疗。目前,白血病干细胞(leukemia stem cells, LSCs)已被确定为AML复发的主要原因。而LSCs中ALDH活性的增加使AML对阿糖胞苷耐药,但DSF可以通过抑制ALDH的活性增强LSCs对阿糖胞苷的敏感性,有效诱导LSCs凋亡,对复发性AML有一定的治疗作用[3]。
2.1.3吉西他滨(gemcitabine,GEM) GEM在临床上广泛用于治疗多种癌症,但当前存在部分患者对其产生耐药性,导致疗效不佳。而DSF能增强GEM的细胞毒作用,其机制可能与诱导ROS及抑制ALDH和NF-κB途径等有关。Kim等[6]研究发现,ALDH+胰腺癌细胞对GEM具有高度耐药性,而DSF可以有效消除ALDH+细胞,增强GEM的细胞毒作用,协同抑制肿瘤生长。此外,Tesson等[27]发现在神经母细胞瘤和胶质瘤细胞系中,DSF-Cu能抑制DNA的合成,引起细胞周期停滞于G2期,导致S期肿瘤细胞对放疗具有抵抗性;但GEM作为S期特异性细胞毒药物与DSF-Cu联合使用能有效增强电离辐射对S期细胞的杀伤,达到放疗增敏作用。
2.2破坏DNA结构和功能代表药物
2.2.1铂类 顺铂是目前最常用的化疗药物。已有研究证明DSF与顺铂联合使用具有协同抗肿瘤作用,还能通过减少氧化应激和炎症减轻顺铂的急性肾毒性[28]。肿瘤细胞高度表达ALDH,与ALDH-细胞相比,ALDH+细胞具有较低的基础ROS水平,DSF能通过抑制ALDH的活性,增加细胞内ROS水平,逆转ALDH+细胞对顺铂的耐药性,诱导肿瘤细胞凋亡[5,29]。在与顺铂联合使用时,DSF能通过ROS/MAPK途径协同促进鼻咽癌细胞凋亡,并且具有良好的耐受性[9];DSF还能降低细胞内谷胱甘肽的水平,抑制NF-κB活性,并调节凋亡相关蛋白Bcl-2和Bax的表达,从而增强顺铂在耐药细胞系中的细胞毒作用[30];DSF还能影响顺铂外排转运蛋白ATP7A的细胞定位, 增强膀胱癌细胞对顺铂的敏感性[31]。
卡铂是第二代铂类配合物,与顺铂作用相似。Falls-Hubert等[32]研究发现DSF与卡铂联合使用时,能增强肿瘤细胞的氧化应激,降低非小细胞型肺癌对放化疗的耐药性,有效抑制体内异种移植肿瘤的生长。
2.2.2烷化剂 6-氧-甲基鸟嘌呤-DNA甲基转移酶(O-6-methylguanine-DNA methyltransferase,MGMT)能修复烷基化损伤引起的链间DNA交叉联结。脑肿瘤细胞因高度表达MGMT,对烷化剂耐药。DSF能透过血脑屏障,抑制脑肿瘤细胞中的MGMT活性,增强烷化剂对DNA的损伤,且毒性低且耐受性良好,在治疗中枢神经系统肿瘤方面具有潜在能力。替莫唑胺(Temozolomide,TMZ)是一种新型烷化剂类抗肿瘤药物,主要用于治疗胶质母细胞瘤,但大多数情况下会产生耐药性。近期有研究发现,DSF/Cu可以抑制蛋白酶体活性,下调有关DNA修复途径基因的表达,从而逆转肿瘤细胞对TMZ的耐药性,增强TMZ在体外临床前模型中的DNA损伤作用;在体内模型中,DSF/Cu与TMZ联用能延长新诊断、复发性和TMZ耐药患者的生存期[2,33-34]。
2.3转录抑制代表药物 多柔比星(doxorubicin,DOX;阿霉素,Adriamycin,ADM) DOX是临床上应用比较广泛的一种抗癌药物,但会对心脏产生严重的毒性。Rolle等[16]研究发现,DSF能通过诱导P-gp巯基化及泛素化而抑制其外排功能,使DOX在细胞内蓄积,逆转乳腺癌细胞对DOX的耐药性,促进乳腺癌细胞凋亡。DSF/Cu与DOX联合使用还可对高度转移性的骨肉瘤细胞产生有效且持久的细胞毒作用,改善DOX的治疗效果[35]。DSF与DOX联合使用能使DOX的用量减少,从而减轻其对心脏的毒性作用,对治疗伴有心脏疾病的肿瘤患者具有重要意义[35]。
2.4蛋白质合成抑制代表药物
2.4.1长春新碱(vincristin,VCR) VCR通过抑制微管蛋白的活性发挥抗肿瘤作用,有研究报道,DSF能够通过抑制ALDH的活性,逆转肿瘤细胞对微管抑制剂的抵抗力,增强耐药肿瘤细胞对VCR的敏感性,有效抑制肿瘤生长[36]。
2.4.2紫杉醇(paclitaxel,PTX) 已有研究证明,DSF能够通过诱导ROS产生、抑制NF-B通路,有效消除CSCs,增强PTX对乳腺癌细胞的细胞毒性,逆转PTX耐药[8]。DSF/Cu还能使ALDH的活性降低、P-gp和干细胞转录因子的表达下调,从而增加肿瘤细胞对PTX的敏感性[15,36]。此外,DSF还能通过降低细胞内的ATP水平和GST活性,逆转多药耐药性,增强PTX对肿瘤细胞的杀伤作用[37]。Swetha等[38]研究发现自噬在降低PTX治疗敏感性方面起着至关重要的作用:DSF联合PTX治疗可通过增加ROS的产生,有效地诱导癌细胞自噬,通过自噬调节使乳腺癌细胞对PTX治疗敏感,有望成为未来癌症治疗的一种策略。
2.5生物治疗代表药物
2.5.1酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI) TKI通过抑制细胞信号转导抑制肿瘤生长,但不能彻底消除肿瘤,因此采用联合疗法可能会取得更好的疗效。在小鼠肾癌细胞中,DSF合用舒尼替尼在肿瘤抑制和迁移方面具有显著的协同效应,其抗肿瘤作用可能是通过下调丝氨酸生物合成和醛糖还原酶来实现的;DSF还可以减少舒尼替尼的剂量,从而降低毒性并减少不良反应发生[39]。董博文等[40]发现,DSF/Cu还能增强耐药肝癌细胞对乐伐替尼的敏感性,明显抑制肿瘤细胞增殖,其机制与抑制PI3K/Akt通路、促进caspase-9蛋白的表达有关。Hassan等[41]联合使用DSF与伊马替尼处理MCF-7,MBA-MD-231,HepG2和HEK-293细胞系,发现与单药相比,联合用药能够更有效地诱导细胞凋亡,增强抗肿瘤作用。在大鼠肝细胞癌模型中,DSF/Cu还能通过下调促炎细胞因子和转录因子、升高促凋亡因子来增强格列卫的抗肿瘤活性[42]。
2.5.2MEK抑制剂 MEK抑制剂通过抑制MEK影响MAPK信号通路,从而抑制细胞增殖,是治疗黑色素瘤的主要药物。已有研究证实,DSF与MEK抑制剂联合使用能增强MEK抑制剂对黑色素瘤的抗肿瘤作用[43]。
2.5.3磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂 3-甲基腺嘌呤(3-methyladenine,3-MA)是PI3K的抑制剂,能够通过抑制Ⅲ型PI3K而广泛用于抑制自噬。Wu等[44]研究发现,DSF/Cu能够诱导非小细胞肺癌细胞自噬,并且证明了当使用3-MA抑制细胞自噬时,DSF/Cu诱导的肿瘤细胞凋亡能够明显增强。
BKM120是一种选择性PI3K抑制剂。与单药相比,无论是在体内还是体外,DSF/Cu与BKM120联合使用均能显著抑制三阴性乳腺癌细胞生长,延迟肿瘤复发[45]。
2.5.4程序性死亡受体-1抗体(programmed cell death-1抗体,PD-1抗体) PD-1抗体是一种有效的肿瘤免疫治疗药物,能够通过增强自身免疫应答反应,大量激活T细胞,从而有效杀伤肿瘤细胞。DSF能降低巨噬细胞促肿瘤活性,与PD-1抗体联合治疗时能够明显增加肿瘤细胞中细胞毒性CD8+ T细胞的数量,增强抗肿瘤免疫反应,协同抑制肿瘤细胞的生长和转移[21]。Zhou等[46]研究发现,DSF/Cu还能通过抑制PARP1的活性,促进GSK3β磷酸化,来上调PD-L1的表达,最终抑制T细胞浸润,从而诱导肿瘤免疫抑制,使肝癌细胞逃脱T细胞介导的杀伤;但DSF/Cu与PD-1抗体联合应用可提高肝癌小鼠模型的抗肿瘤免疫力,产生更好的抗肿瘤活性,具有潜在的肝癌治疗作用。
2.5.5蛋白酶体抑制剂 硼替佐米(bortezomib,BTZ)是一种蛋白酶体抑制剂,已被证明对多种类型癌细胞均具有细胞毒性。Salem等[47]研究发现,BTZ会上调肿瘤细胞中的抗氧化物质的表达,增强对氧化应激的抵抗,从而导致耐药性的产生;而DSF能够通过抑制铜锌超氧化物歧化酶的活性,破坏氧化平衡状态,有效逆转多发性骨髓瘤细胞系对BTZ的耐药性。
2.6其他类代表药物
2.6.1金诺芬(Auranofin,Aur) Aur作为一种抗风湿药物被人们所熟知,但近年来越来越多的研究发现它在肿瘤治疗方面也具有重要作用。Papaioannou等[48]发现,DSF与Aur联用对于治疗耐药的复发性卵巢癌具有重要意义:DSF可以增加卵巢癌细胞的氧化应激,诱导热休克蛋白表达,从而产生不可逆的细胞损伤;Aur能够通过抑制硫氧还蛋白还原酶的活性导致细胞氧化应激进一步增加,增强DSF的细胞毒作用。此外,在肝癌的体内、外实验中,DSF和Aur联合使用也具有协同抗肿瘤作用:DSF和Aur能共同抑制蛋白酶体的活性、增加ROS的产生、诱导Caspase活化和内质网应激,从而增强细胞毒作用,协同诱导肝癌细胞凋亡[1]。
2.6.2二十二碳六烯酸(Docosahexaenoic acid,DHA) DHA是一种人体必需氨基酸,在脑发育过程中具有重要作用。近年来已有研究证明其对多种肿瘤均有抑制作用。Jiao等[49]研究发现,DSF与DHA联合使用具有协同抗肿瘤作用:DSF能增强DHA诱导的血红素加氧酶-1表达;DHA能增强DSF诱导的肿瘤干细胞抑制,从而更有效地诱导肿瘤细胞凋亡,抑制肿瘤生长。
2.6.3二甲双胍(Metformin,MET) MET是治疗2型糖尿病的一线药物,但最近有研究发现其在抗肿瘤方面具有潜在作用。DSF与MET联合使用能显著抑制食道鳞状细胞癌的生长:MET处理过的肿瘤细胞内铜水平更高,能进一步增强DSF作为蛋白酶体抑制剂的作用[2]。DSF和Met二者联合应用能上调bax、p53、caspase-3的表达,下调抗凋亡蛋白bcl-2的表达,诱导细胞凋亡,明显抑制肿瘤细胞生长,从而对胶质母细胞瘤细胞有协同细胞毒作用,使其对辐射敏感[50]。
3 展望
DSF安全高效且经济,近几年的进一步研究已经证实DSF是有效的抗癌药物。但DSF作为抗肿瘤药物的研究尚处于初级阶段,还有很多问题急需解决。其中一个至关重要的任务,是如何将这种高效的抗肿瘤药物与其他抗肿瘤药物联合应用于临床治疗各种癌症。虽然诸多研究已发现DSF与其他抗肿瘤药物联合使用展现较好的协同抗肿瘤效果,但其作用机制尚未完全阐明,相信随着对DSF的药效、机制和临床研究的不断深入,探索合理有效的联合用药方案,能使DSF尽早作为一种抗肿瘤药物投入临床使用。

