壳聚糖涂覆磁性纳米颗粒对纤维素酶的固定化
王 琳,刘容旭,刘丹怡,王语聪,韩建春,
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.黑龙江省绿色食品研究院,黑龙江哈尔滨 150028)
纤维素酶常用于水解纤维素晶体的β-1,4 糖苷键以产生葡萄糖[1-2],广泛应用于食品、化工、洗涤剂、化妆品、纸浆、造纸和制药等行业。然而,纤维素酶的应用经济成本高,容易失活,且难以重复使用。这些缺点限制了其在工业中的应用,因此如何降低成本、减少酶的使用量、增加酶活性成为固定化酶领域的研究重点[3]。
近几年,选用合适的功能化磁性纳米颗粒固定酶被认为是降低成本的可行性办法[4]。功能化磁性纳米颗粒表面可以涂覆许多活性官能团,如-COOH、-NH2和-OH 等,具备与酶高效结合的能力[5]。目前,已有研究者对此展开研究,孙俊[6]以羧甲基壳聚糖为表面壳体材料制备了功能性的超顺磁性纳米颗粒,用于分离纯化蛋清中溶菌酶,效果优于传统溶菌酶分离纯化技术。董剑[7]将四臂型聚乙二醇树枝状聚合物修饰在四氧化三铁纳米颗粒固定纤维素酶,与游离纤维素酶相比,固定化后的纤维素酶在热稳定性、重复使用稳定性等方面均得到了明显的提高。此类研究表明,改性磁性纳米颗粒有利于简化操作工艺,使用其作为载体固定酶具有研究意义及广泛的应用前景。
如何提高酶的稳定性是固定化酶领域研究的重点。壳聚糖是一种可生物降解,具有生物活性、无毒的聚合物,在食品、化妆品、制药和生物技术领域被广泛应用[8-10]。磁性纳米颗粒与壳聚糖的结合后,其表面的-COOH,-NH2、-OH 等基团具有与纤维素酶的N-末端共价结合的能力,多点共价连接促进了固定化酶结构的加固,从而减少外界环境的变化引起酶构象的变化,提高酶的稳定性[11-15]。因此,本实验采用壳聚糖涂覆磁性纳米颗粒,作为载体固定纤维素酶,得到的固定化纤维素酶具有更好的酸碱适应范围、热稳定性以及重复利用性。本文提出的酶固定化方式及壳聚糖涂覆的方法条件温和、简便快速,丰富了酶的固定化方式。为纤维素酶的广泛应用提供新的技术和方法。
1 材料与方法
1.1 材料与仪器
纤维素酶(30 U/mg)杰凯生物科技有限公司;四水合氯化亚铁、六水合氯化亚铁、环氧氯丙烷、3,5-二硝基水杨酸、壳聚糖等化学试剂 均为分析纯,盛达生物科技有限公司。
FTIR-8400 傅里叶变化红外光谱仪、ZEISS-SUP RA55 型高分辨率场发射扫描电镜显微镜 德国Bruker 公司;Zetasizer NanoZS90 电位分析仪 德国蔡司公司;恒温摇床 盛达生物科技有限公司。
1.2 实验方法
1.2.1 Fe3O4磁性纳米颗粒的制备 将FeCl3·6H2O和FeCl2·4H2O(Fe2+与Fe3+摩尔比为1:1.75)充分溶解至250 mL 纯净水中,500 r/min 搅拌溶解,通入N2排氧气10~15 min,氨水调节pH>10,搅拌10 min,80 ℃水域保温30 min。分别用乙醇和去离子水清洗3 次,之后加入柠檬酸1 mg/mL 于95 ℃搅拌90 min,冷冻干燥24 h,4 ℃保存。
1.2.2 Fe3O4-壳聚糖磁性纳米颗粒的制备及表征
1.2.2.1 Fe3O4-壳聚糖磁性纳米颗粒的制备 将制备的Fe3O4磁性纳米颗粒超声处理8000 r/min 30 min,取1.00 g Fe3O4磁性纳米颗粒置于1.5 mL 环氧氯丙烷和2 mL 磷酸盐缓冲溶液(pH7.0)中,25 ℃,250 r/min摇动3 h。将活化的Fe3O4磁性纳米颗粒在50 ℃,400 r/min 下继续超声处理30 min 后,加入壳聚糖2 mg/mL,摇床摇动12 h,在外加磁场的作用下回收Fe3O4-壳聚糖磁性纳米颗粒,并用去离子水洗涤数次,在4 ℃下储存备用。
1.2.2.2 SEM 扫描电子显微镜 经干燥过筛后的Fe3O4、Fe3O4-壳聚糖磁性纳米颗粒样品置于载物台上,真空条件下喷金处理,将处理好的样品放入观察室,拍摄颗粒形貌照片[16]。
1.2.2.3 VSM 磁性能分析 采用振动样品磁强计(VSM)表征Fe3O4-壳聚糖磁性纳米颗粒的磁性能。
1.2.2.4 FTIR 红外光谱分析 将Fe3O4、Fe3O4-壳聚糖磁性纳米颗粒样品在105 ℃干燥2 h 后,采用KBr 压片法,按照1%的比例与KBr 充分混合、研磨、压片后置于红外光谱仪上测试。扫描范围为400~4000 cm-1,分辨率为4 cm-1,采用DTGS 检测器,以空气为空白,扫描64 次后取平均值得到样品的红外光谱图[17]。
1.2.2.5 Fe3O4-壳聚糖磁性纳米颗粒循环利用实验通过吸附、水洗、解吸等步骤,考察Fe3O4-壳聚糖磁性纳米颗粒循环利用对固定化纤维素酶的影响,吸附条件设为:溶液体积100 mL,Fe3O4-壳聚糖磁性纳米颗粒添加量为1 g,纤维素酶初始浓度为0.5 mg/mL,温度50 ℃,pH6,固定化时间3.5 h。固定化完成后在外加磁场的作用下将磁性纳米颗粒分离,对上清液测定蛋白质含量,用去离子水对固定纤维素酶的磁性纳米颗粒进行水洗,然后直接进行解析。解吸液(0.5 mol/L NaCl 溶液,pH6 的PBS 缓冲液5 mL,解析时间为2 h。解析完成后对磁性纳米颗粒用去离子水进行反复水洗,将其放入与上一组实验相同的纤维素酶溶液中,进行第二次吸附,重复进行此实验10 次[16]。
1.2.3 固定化纤维素酶复合体系的制备及表征
1.2.3.1 固定化纤维素酶复合体系的制备 将1 g Fe3O4-壳聚糖磁性纳米颗粒500 W 超声处理 30 min 后与100 mL(0.5 mg/mL)纤维素酶缓冲溶液(PBS,pH6)混合,在一定温度(45 ℃)摇床中摇动3 h 直到吸附平衡,吸附完成后,在外加磁场的作用下回收纤维素酶复合体系[18],并分析红外光谱。
1.2.3.2 电位分析 用Mastersizer 2000 分析仪测量Fe3O4、Fe3O4-壳聚糖磁性纳米颗粒、固定化纤维素酶复合体系的粒径和电势,将样品分散于蒸馏水中,稀释后至1 mg/L,500 W 超声处理30 min 后进行测试[6]。
1.2.3.3 磁场辅助分离测试 将制备的固定化纤维素酶复合体系置于透明玻璃器皿中,加入一定量水,在外在磁场的作用下进行测试。
1.2.4 固定化纤维素酶酶学性质研究
1.2.4.1 固定化纤维素酶及游离纤维素酶酸碱稳定性 试验在不同pH(2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0)下进行羧甲基纤维素水解,将5 mg 游离纤维素酶以及0.1 g 固定化纤维素酶分别加入到不同pH 的缓冲溶液中,50 ℃条件下保温15 min 后,测定固定化纤维素酶和游离纤维素酶酶活[19]。
1.2.4.2 固定化纤维素酶及游离纤维素酶温度稳定性 根据Sánchez-Ramírez 等[20]的方法,将游离纤维素酶和固定化纤维素酶分别置于60 和70 ℃条件下4 h,每小时检测其活性,比较游离纤维素酶和固定化纤维素酶的热稳定性。
1.2.4.3 固定化纤维素酶的循环利用实验 根据Jiang 等[21]的方法测定固定化纤维素酶的可循环利用率。取一定量固定化纤维素酶于100 mL 羧甲基纤维素(CMC)水溶液(浓度为1%)中进行水解,水解完成后在外加磁场的作用下对固定化纤维素酶后的Fe3O4-壳聚糖磁性纳米颗粒进行分离,并用PBS冲洗干净,将其重新置于新鲜的100 mL 羧甲基纤维素(CMC)水溶液(浓度为1%)开始另一个循环,共循环10 次,计算固定化纤维素酶在每个循环的相对活性,设定固定化纤维素酶的初始活性为100%,将每轮获得的活性与首轮活性进行比较。
1.2.5 酶活性测定 为了评估游离酶和固定化酶的酶活性,设定游离纤维素酶最大酶活力为100%。固定化纤维素酶活力测定:将4 mL 缓冲溶液加入含有0.05 g 固定化纤维素酶的锥形瓶中。然后,将1 mL羧甲基纤维素钠溶液(溶解在100 mL 缓冲溶液中的1.0 g 羧甲基纤维素钠溶液)加入上述锥形瓶中,并将混合物在50 ℃下振荡30 min。纤维素酶会将羧甲基纤维素钠催化分解成葡萄糖。随后,将固定纤维素酶的Fe3O4-壳聚糖磁性纳米颗粒在外加磁场的作用下进行移除,回收没有纤维素酶的溶液。然后,在溶液中加入1.5 mL DNS 试剂溶液,在沸水中加热5 min,得到有色产物,测定540 nm 处的溶液吸光度。制备不含纤维素酶的平行羧甲基纤维素钠溶液样品作为空白对照[22]。根据标准工作曲线计算产生葡萄糖的量。
1.3 数据处理
实验结果采用SPSS 19.0 统计学软件进行分析,所得数据以平均值±标准误表示,均数组件比较采用单因素方差分析,进行组间的两两比较。
2 结果与分析
2.1 Fe3O4-壳聚糖磁性纳米颗粒结构表征
2.1.1 Fe3O4-壳聚糖磁性纳米颗粒SEM 扫描电镜分析 根据扫描电镜结果图1a、图1b 可知,Fe3O4磁性纳米颗粒分散性较好,大小均一,外表形状不规则,大致呈椭圆形图1b。从图1c 可知,涂覆壳聚糖后,其粒径、表面形态并未发生明显变化,但Fe3O4-壳聚糖纳米颗粒分散性有所提高图1c。当用壳聚糖涂覆后,由于表面含有带正电荷的氨基,静电作用使Fe3O4-壳聚糖的分散性提高,有利于固定化酶充分与底物进行接触[22]。

图1 Fe3O4(a、b)、Fe3O4-壳聚糖(c)的扫描电镜图Fig.1 SEM images of Fe3O4 (a,b),Fe3O4-chitosan magnetic nanoparticles(c)
2.1.2 Fe3O4-壳聚糖磁性纳米颗粒VSM 分析 图2显示了室温下壳聚糖涂覆之前和之后的磁性纳米颗粒的磁滞回线,Fe3O4的饱和磁化强度为6.16 emu/g,Fe3O4-壳聚糖的饱和磁化强度为5.17 emu/g,壳聚糖的涂覆并没有影响磁性纳米颗粒的磁性,图中显示磁性纳米颗粒的起始磁化曲线与退磁曲线重合,没有磁滞坏现象出现,即两条曲线的矫顽力(Hc)和剩磁(Mr)均趋向于零,这是超顺磁性纳米材料的特殊性质[23]。表明Fe3O4、Fe3O4-壳聚糖具有超顺磁性,能够在外加磁场的作用下进行固液分离,外磁场消失后磁性纳米颗粒不会有剩磁,能够重新分散在溶液中,这种性质也使得磁性纳米颗粒在进行定向靶药的过程中不会出现堵塞血管的问题[24]。
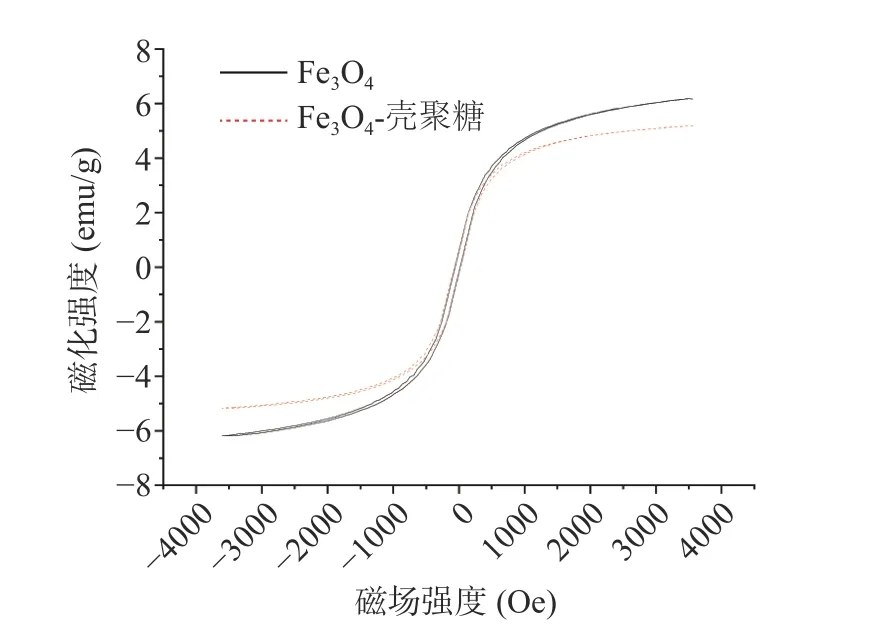
图2 Fe3O4 磁性纳米颗粒、Fe3O4-壳聚糖磁性纳米颗粒的磁滞回线Fig.2 Magnetization hysteresis loops for Fe3O4,Fe3O4-chitosan magnetic nanparticles
2.1.3 Fe3O4-壳聚糖磁性纳米颗粒FTIR 分析 图3为Fe3O4,Fe3O4-壳聚糖磁性纳米颗粒的FTIR 谱图,用于表述壳聚糖涂覆磁性纳米颗粒的机理。Fe3O4磁性纳米颗粒光谱图在583 cm-1处出现了Fe-O 的特征吸收峰。Fe3O4-壳聚糖磁性纳米颗粒光谱图与磁性纳米颗粒的光谱图相似,但是在3500 cm-1处出现-OH 特征吸收峰,1386 cm-1处出现壳聚糖中-COOH的特征吸收峰,1078 cm-1处出现C-O-C 的特征吸收峰,1650 cm-1处出现的吸收峰归因于N-H 的弯曲振动。此外,Fe3O4-壳聚糖磁性纳米颗粒光谱图在3500 cm-1处出现的-OH 特征吸收峰峰宽有所减少,可能是磁性纳米颗粒表面上的-OH 基团与壳聚糖表面的基团相互作用的结果[25]。上述试验表明,壳聚糖与磁性纳米颗粒实现了有效结合。
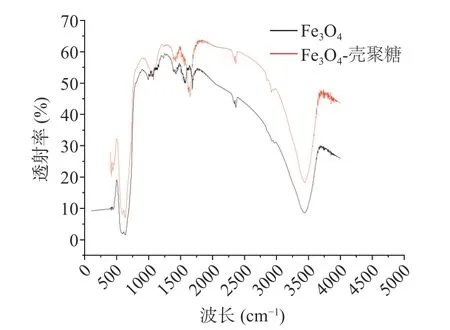
图3 Fe3O4,Fe3O4-壳聚糖磁性纳米颗粒FTIR 谱图Fig.3 FTIR spectra of Fe3O4,Fe3O4-chitosan magnetic nanparticles
2.1.4 Fe3O4-壳聚糖磁性纳米颗粒的循环利用实验解析液(0.5 mol/L NaCl 溶液,pH=6 的PBS 缓冲溶液),随着循环利用次数的增多,Fe3O4-壳聚糖对纤维素酶的固载量逐渐下降。在循环利用的开始阶段,Fe3O4-壳聚糖磁性纳米颗粒对纤维素酶的固载量下降幅度较小,在进行第6 次循环利用试验时,仍然能够达到38.1 mg/g 的固载量。从第7 次循环利用试验开始,固载能力下降明显,但是在10 次重复试验时仍然能达到15.7 mg/g 的固载量(图4)。
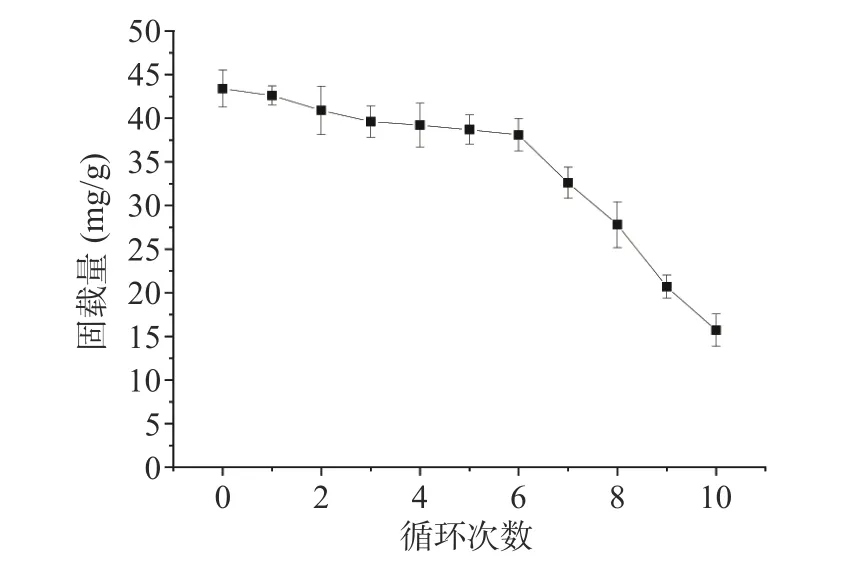
图4 Fe3O4-壳聚糖磁性纳米颗粒循环利用次数对纤维素酶固载量的影响Fig.4 Effect of recycling times of Fe3O4-chitosan magnetic nanoparticles on the amount of cellulase immobilized
纤维素酶在磁性纳米颗粒上固载量的下降可能是因为每一次的重复利用,Fe3O4-壳聚糖表面都会有吸附位点仍然被纤维素酶所占用,因此,可以发生作用的吸附位点减少,吸附量下降。此外,解吸后溶液中的Na+和Cl-可能部分残留在吸附剂表面,从而影响到下一次循环中的吸附效果[26]。Fe3O4-壳聚糖磁性纳米颗粒的可重复利用性为工业应用节约成本提供了新方法。
2.2 固定化纤维素酶复合体系表征
2.2.1 FTIR 红外图谱 如图5 所示,固定了纤维素酶的Fe3O4-壳聚糖磁性纳米颗粒在1635 cm-1处出现的N-H 键的弯曲振动吸收峰强度减弱,可能是Fe3O4-壳聚糖通过静电相互作用以及离子键结合,使其表面的-COOH 和纤维素酶N-末端(-NH2)之间形成了酰胺键(特别是 C-O 转换成C-N)。1035 cm-1处吸收峰的出现可能由于纤维素酶蛋白链的羰基与壳聚糖涂覆的纳米颗粒的羟基之间的相互作用,3500 cm-1处吸收峰由于Fe3O4的-OH 与纤维素酶中的-OH、N-H 的吸收峰的叠加而变宽[27]。结合Fe3O4-壳聚糖以及固定化纤维素酶磁性纳米颗粒的FTIR 图谱,发现衍射峰强度发生了变化,说明纤维素酶与Fe3O4-壳聚糖之间存在着相互作用力,该结果表明纤维素酶固定化成功。
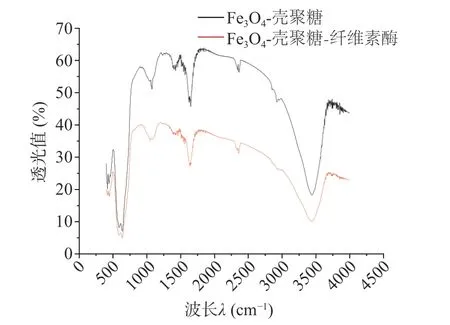
图5 Fe3O4-壳聚糖磁性纳米颗粒、纤维素酶复合体系的FTIR 光谱图Fig.5 FTIR spectra of Fe3O4-chitosan magnetic nanoparticles,cellulase complex system
2.2.2 Zeta 电位及粒径分析 磁性纳米颗粒本身具有比表面积大,表面能高等性质,因此比较容易团聚。从结果上看,在其表面涂覆壳聚糖之后,其粒径有所增加。吸附酶后表面粒径进一步增加,可能是由于纳米颗粒表面电势以及颗粒间排斥力降低,没有外力的作用下更容易团聚[28]。
通过电位分析,Fe3O4磁性纳米颗粒表面上存在很多负电荷,电势为-32.2 mV。涂覆壳聚糖和固定化纤维素酶之后电势有所上升,分别为-15.2 和0.36 mV(表1)。这可能是由于磁性纳米颗粒依次与壳聚糖、纤维素酶结合,使得Fe3O4磁性纳米颗粒表面的-COOH、-OH 等带电基团减少,从而导致电势上升。该结果进一步证明了Fe3O4磁性纳米颗粒与壳聚糖、纤维素酶之间存在相互作用[29]。
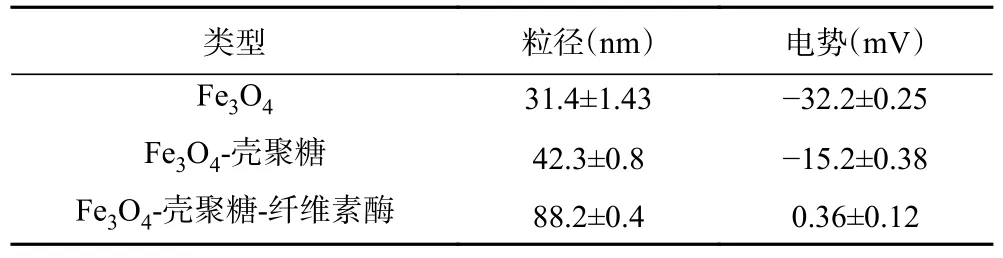
表1 Fe3O4、Fe3O4-壳聚糖磁性纳米颗粒、纤维素酶复合体系的粒径和电势Table 1 Potential and Particle size of Fe3O4,Fe3O4-chitosan magnetic nanoparticles,cellulase complex system
2.2.3 磁场辅助纳米颗粒分离情况 在从图6 可以看出,固定纤维素酶前后的Fe3O4-壳聚糖磁性纳米颗粒在水溶液中分散均匀,在外加磁场的作用下,可以快速向磁场方向聚集图7a、图7b,显示出较强的磁响应性。经过对Fe3O4,Fe3O4-壳聚糖磁性纳米颗粒,纤维素酶复合体系的磁回收时间进行测试,结果分别为5.5、5.8、20.3 s,表明Fe3O4磁性纳米颗粒具有较好的磁响应性能,能够在外加磁场的作用下实现快速回收,涂覆壳聚糖后,对其磁性能几乎没有影响,而在固定化纤维素酶后Fe3O4-壳聚糖磁性纳米颗粒的回收时间显著增加,但是仍然能够在混合体系中实现快速分离,符合固定化酶载体的要求,可以为工业应用节约大量时间。
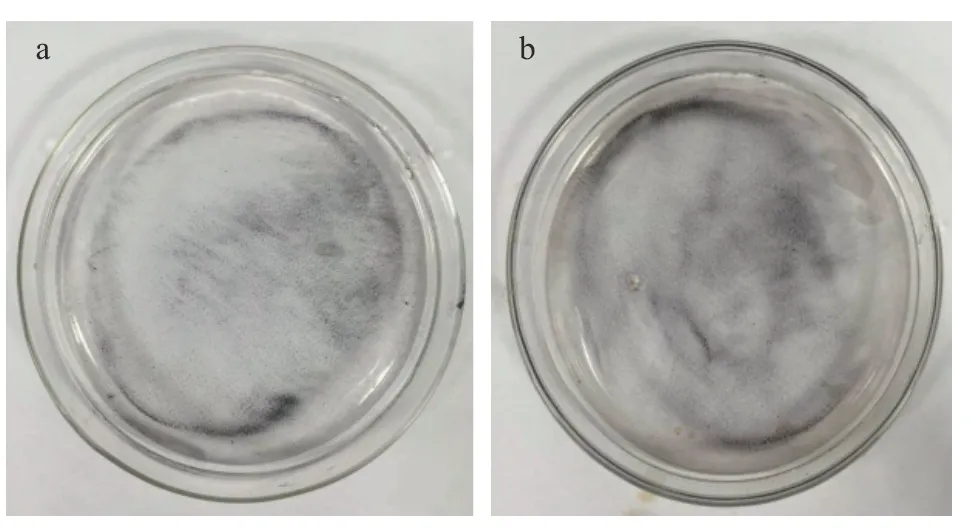
图6 Fe3O4-壳聚糖磁性纳米颗粒(a)、纤维素酶复合体系(b)在水溶液中的分散稳定性Fig.6 Dispersion stability of Fe3O4-chitosan magnetic nanoparticles(a),cellulase complex system(b) in water solution

图7 磁场辅助分离水溶液中固定化纤维素酶的Fe3O4-壳聚糖纳米颗粒的示意图Fig.7 Schematic diagram of magnetic field assisted separation of Fe3O4-chitosan nanoparticles immobilized with cellulase in aqueous solution
2.3 固定化纤维素酶酶学性质研究
2.3.1 固定化纤维素酶及游离纤维素酶酸碱稳定性分析 稳定性对于工业应用非常的重要,图8 显示的是pH 对游离和固定纤维素酶活性的影响,与游离纤维素酶相比较,固定纤维素酶在强酸性环境和强碱性环境中均表现出较高的活性。游离纤维素酶在pH 为3~7 范围内有较好的活性,固定纤维素酶在pH 为2~9 范围内均有较好的活性。当pH 为2 时,固定化酶活性下降程度低于游离纤维素酶,pH 为10 时,游离纤维素酶几乎丧失全部活性,而固定化纤维素酶活性为33.84%,仍表现出一定的活性。

图8 pH 对游离纤维素酶和固定化纤维素酶的影响Fig.8 Effects of pH on free cellulase and immobilized cellulase
总体来看,在不同pH 条件下,与游离纤维素酶相比,固定化纤维素酶稳定性得到了提高,适用范围更广泛,这可能是由于酶与磁性纳米颗粒结合引起净电荷增加[30],同时磁性纳米颗粒涂覆后,有利于保护酶表面的水化层,避免了酶的失活,在固定化后,酶的结构更加稳定[31]。试验结果与Ying 等[32]研究结果一致,结果表明使用磁性纳米颗粒固定化后增强了纤维素酶的酸碱稳定性。
2.3.2 固定化纤维素酶及游离纤维素酶温度稳定性分析 图9 表示固定纤维素酶和游离纤维素酶的热失活(在60 和70 ℃)的情况,结果表明,固定化酶比游离纤维素酶更加稳定,通过温度效应,固定化纤维素酶更加不容易失活,在放置于60 ℃条件下4 h 后,游离纤维素酶活性连续降低,最终仅达到初始活性的40%,并且放置于70 ℃条件下3 h 后因为变性而几乎完全失去活性。而固定化纤维素酶在60 和70 ℃下4 h 后,仍然能保持将近50%的活性。

图9 游离纤维素酶和固定化纤维素酶的温度稳定性Fig.9 Thermal stability of free cellulase and immobilized cellulase
固定化纤维素酶的高稳定性可归因于其与磁性纳米颗粒载体的共价连接导致自由度的降低,因此避免了分子间的聚集,其结构获得了更高的刚性,致使在更高温度下运行稳定性的提高[33]。
2.3.3 固定化纤维素酶的可循环利用性 游离纤维素酶只能够用一次,酶固定化的优点之一就是重复使用性,在固定化纤维素酶的可循环利用性实验中,经过10 次循环使用后,纤维素酶仍然保持在52.6%的高活性,表明固定在磁性纳米颗粒上的纤维素酶的储存稳定性明显高于游离酶的稳定性。酶活性的下降可能是由于纤维素酶复合体系组成的损失,终产物抑制和蛋白质降解[27]。另外固定化纤维素酶可能在搅拌过程中从纳米颗粒上脱落,在刚开始的7 次循环利用中,酶活性相对稳定,活性可达83.1%,从第八个循环开始,纤维素酶活性开始大幅度下降(图10),可能是由于磁性纳米颗粒物理吸附纤维素酶出现部分解吸。Alahakoon 等[34]使用固定在磁性纳米颗粒上的酶在进行10 个循环羧甲基纤维素水解后得到了高达30%的初始纤维素酶活性。与先前报道的结果相比,本研究中测试的酶制剂具有更好的重复使用性。从结果中观察到,固定化纤维素酶的长期稳定性和可重复使用性使其更适用于工业中。

图10 循环利用次数对纤维素酶活性的影响Fig.10 Effect of recycle number on cellulase activity
3 结论
本研究利用扫描电镜观察磁性纳米颗粒在涂覆壳聚糖前后的变化,利用振动磁场计检测磁性纳米颗粒涂覆壳聚糖前后磁性变化情况,Fe3O4、Fe3O4-壳聚糖磁性纳米颗粒均具有较好的磁响应性,矫顽力(Hc)和剩磁(Mr)趋向于零,符合超顺磁性纳米材料的特殊性质。运用红外光谱仪检测磁性纳米颗粒表面化学基团的变化,以证明涂覆过程中接枝成功。运用Zeta-电位检测壳聚糖前后颗粒表面的电荷变化情况。检测了Fe3O4-壳聚糖磁性纳米颗粒的可重复利用性,在进行第6 次循环利用试验时,仍然能够达到38.1 mg/g 的固载量。同时研究发现,相比游离纤维素酶,固定化酶表现出更高的酸碱稳定性,在pH2~9范围内均有较好的活性。热稳定性也更好,在60和70 ℃下4 h 后,仍然能保持将近50%的活性。固定化酶经过10 次循环使用后,仍然保持在52.6%的高活性。以上试验结果表明,以壳聚糖涂覆磁性纳米颗粒作为载体固定化纤维素酶,明显提高了酶的使用效率和稳定性,实现纤维素酶的循环使用,为固定化酶技术的进一步改良和发展提供了理论依据及实际应用前景。

