人参皂苷Rg3和大黄酸纳米乳的制备及其联合aPD-L1治疗三阴性乳腺癌的药效学研究
张翡峰,钱 柯, 2#,马莉莎, 2,赵 悦, 2,施经斌, 2,许淑君, 2,熊 阳, 2*
·药剂与工艺·
人参皂苷Rg3和大黄酸纳米乳的制备及其联合aPD-L1治疗三阴性乳腺癌的药效学研究
张翡峰1,钱 柯1, 2#,马莉莎1, 2,赵 悦1, 2,施经斌1, 2,许淑君1, 2,熊 阳1, 2*
1. 浙江中医药大学药学院,杭州 浙江 311402 2. 浙江中医药大学中医药科学院,杭州 浙江 310053
根据中医治疗肿瘤时提倡的“扶正祛邪”治则,选用中药人参和大黄的主要成分人参皂苷Rg3(ginsenoside Rg3,G-Rg3)和大黄酸(rhein,Rhe)进行组合,制备G-Rg3/Rhe纳米乳(G-Rg3/Rhe NE),同时提高G-Rg3和Rhe溶解度以利于注射给药,并利用该纳米乳联合程序性死亡受体配体1单抗(anti-programmed cell death ligand 1,aPD-L1)治疗三阴性乳腺癌(triple negative breast cancer,TNBC)。采用紫外分光光度法分别测定G-Rg3和Rhe在不同辅料中的溶解能力,筛选出合适的乳化剂、助乳化剂和油相。利用伪三元相图考察乳化剂与助乳化剂质量比(m值)对纳米乳体系的影响,根据形成纳米乳区域面积大小选择适宜的m值,优选G-Rg3/Rhe NE的处方,并对其进行表征和稳定性评价。选用4T1Fluc原位乳腺肿瘤小鼠模型,评价G-Rg3/Rhe NE联合aPD-L1抗TNBC的效果。G-Rg3/Rhe NE的优化组分比为聚氧乙烯氢化蓖麻油EL35-聚乙二醇400-辛癸酸甘油酯-水,其质量比为1.33∶2.67∶2.80∶12.50,m值为1∶2,G-Rg3/Rhe NE的平均粒径为(84.8±1.1)nm,多分散性系数(polydispersity index,PDI)为0.21±0.02,ζ电位为(−11.30±0.43)mV。载药纳米乳中G-Rg3、Rhe的包封率分别为96.51%、97.47%,两药共载的载药量为0.75%。G-Rg3/Rhe NE联合aPD-L1,能显著抑制荷4T1Fluc小鼠的肿瘤生长。G-Rg3/Rhe NE粒径均一、稳定性好,可联合aPD-L1增强其抗TNBC的效果。
人参皂苷Rg3;大黄酸;纳米乳;三阴性乳腺癌;aPD-L1
乳腺癌是全球范围内女性最常见的恶性肿瘤[1],其中三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌的一个亚型,其特点是用于治疗“靶点”的雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)均为阴性表达,占所有乳腺癌病理类型的10%~20%[2],具有侵袭性强、易复发转移和预后差等特点[3]。目前常采用的化疗手段存在耐药性和毒副作用问题[4]。
近年来,研究发现使用程序性死亡受体配体1单抗(anti-programmed cell death ligand 1,aPD-L1)能提高肿瘤微环境中的细胞毒性T细胞活性,恢复免疫细胞功能来消除癌细胞的免疫疗法,应用于多种类型癌症的治疗[5],如非小细胞肺癌[6]、肾细胞癌[7]。而在2018年,Atezolizumab也被批准用于治疗PD-L1表达的TNBC患者[8]。然而,单独使用aPD-L1对超80%的TNBC患者治疗无效[9]。因此人们开始探索aPD-L1的联合疗法,如2019年,PD-L1单抗阿替利珠获FDA批准与紫杉醇联用治疗晚期或转移性三阴性乳腺癌患者[10]。中药治疗调控免疫抗乳腺癌由来已久,早前便提出治疗时需将扶正固本放在首位,强调从整体层面调节机体的免疫功能,这和肿瘤免疫治疗的观念非常吻合[11]。同时传统中医认为实体瘤的发生是人体正气不足,痰瘀互结形成的有形肿块,病理因素为毒、痰、湿、瘀互结为“瘤”,属于正虚邪实,治法宜扶正祛邪[12-14],这也与现代医学对肿瘤免疫的认识非常类似。此外,中药抗肿瘤具有多方位、多靶点、多效性、不易产生耐药性等优点[15]。因此,将传统中药联合aPD-L1进行肿瘤免疫治疗有望取得较好的效果。
本实验根据中医治疗肿瘤时提倡的“扶正祛邪”治则,选用中药人参和大黄的主要有效成分人参皂苷Rg3(ginsenoside Rg3,G-Rg3)和大黄酸(rhein,Rhe)进行组合。人参和大黄为药中四维[16],两者常配伍扶正祛邪治疗肿瘤[17-18]。如徐灵胎所云“如大黄与人参同用。大黄必然逐去坚积,决不反伤正气,人参自然充盈正气,决不反补邪气”[19]。这与肿瘤正虚邪实、需要扶正祛邪治法非常吻合,两者配伍有攻补兼施之妙[20]。因此,将G-Rg3/Rhe配伍或可联合aPD-L1增强抗TNBC的效果。但是,G- Rg3和Rhe溶解性差,生物利用度低,不利于注射给药[21-22]。而纳米载体技术被认为是提高难溶性药物的溶解度和生物利用度最有前途的方法之一[23]。目前,已有多种纳米载体系统在肿瘤免疫治疗领域得到开发,包括基于聚合物的纳米粒和胶束,基于脂质成分的脂质体、纳米乳等[24-25]。纳米乳(nanoemulsion,NE)能极大提高难溶性药物在水中的溶解性及稳定性[26],由于其粒径小、黏度低、使药物在其中有较好的分散性,有利于机体迅速吸收,从而提高其生物利用度[27-28]。本研究拟将G-Rg3和Rhe共载制备成G-Rg3/Rhe纳米乳(G-Rg3/Rhe NE),解决溶解性差等不利于注射给药的问题,并对其联合aPD-L1的体内抗肿瘤药效进行初步评价。
1 仪器与材料
1.1 仪器
UV-2550型紫外可见分光光度仪,岛津企业管理(中国)有限公司;马尔文Zetasizer Nano激光粒度仪,英国Malvern公司;MSE125P-100-DU型分析天平,北京赛多利斯科学仪器有限公司;VORTEX3涡旋混匀器,德国IKA集团;85-2型数显恒温磁力搅拌器,上海江星仪器有限公司;TS-200型脱色摇床数显,海门市其林贝尔仪器制造有限公司;CS601型超级恒温水浴槽,上海博迅实业有限公司医疗设备厂;JY88-II型液晶超声波细胞粉碎机,宁波新芝生物科技有限公司;D3024型台式高速微量离心机,北京创誉科技有限公司。
1.2 药物与试剂
G-Rg3,质量分数≥98%,批号ZL20201216YY,南京泽朗医药科技有限公司;Rhe,质量分数≥98%,批号20200319,中国食品药品检定研究院;InVivoMab anti-mouse PD-L1(B7-H1),美国Bio X Cell公司;油酸山梨坦,上海泰坦科技股份有限公司;聚山梨酯80,聚氧乙烯氢化蓖麻油EL35(polyoxyethylene hydrogenated castor oil EL35,PHCO EL35)、聚乙二醇400,源叶生物科技有限公司;大豆油,阿拉丁试剂有限公司;油酸乙酯、辛癸酸甘油酯,广东翁江化学试剂有限公司;肉豆蔻酸异丙酯,上海麦克林生化科技有限公司;正丁醇、无水乙醇、1,2-丙二醇,上海沪试化工有限公司;75%乙醇、PBS、胰蛋白酶,杭州诺森德生物技术有限公司;高氯酸、冰乙酸,浙江汉诺化工科技有限公司;香草醛、氢氧化钠,杭州萧山化学试剂厂。试剂均为分析纯。
1.3 供试瘤株与实验动物
鼠源乳腺癌4T1细胞,由浙江中医药大学高建莉老师馈赠,4T1Fluc细胞由慢病毒转染技术转染所得。6~8周龄健康雌性SPF级BALC/C小鼠,体质量18~22 g,由上海斯莱克实验动物有限公司提供。所有小鼠实验期间全程饲养于浙江中医药大学动物实验研究中心SPF级环境中,在25 ℃和50%~60%湿度下,每12小时进行光照/黑暗交替,并允许自由获取水和食物。实验动物使用许可证号为SYXK(浙)2018-0012。所有动物实验遵循浙江中医药大学实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 G-Rg3/Rhe NE含量测定方法的建立
2.1.1 溶液的配制
(1)5%香草醛冰乙酸溶液:精密称取5.0 g香草醛,加适量冰乙酸使其溶解,置于100 mL量瓶中,继续滴加冰乙酸定容至刻度,摇匀,即得。
(2)0.5%氢氧化钠溶液:精密称取0.50 g氢氧化钠固体,加适量水使其溶解,置于100 mL量瓶中,继续滴加水定容至刻度,摇匀,即得。
2.1.2 对照品溶液的配制 精密称取G-Rg3对照品10.20 mg,加适量75%乙醇溶解,置于10 mL量瓶中,继续滴加75%乙醇定容至刻度,摇匀,即得质量浓度为1.02 mg/mL的G-Rg3对照品溶液。精密称取Rhe对照品10.40 mg,加适量0.5%氢氧化钠溶液溶解,置于10 mL量瓶中,继续滴加0.5%氢氧化钠溶液定容至刻度,摇匀,即得1.04 mg/mL的Rhe对照品溶液。
2.1.3 检测波长的选择 精密吸取G-Rg3对照品储备液0.10 mL于试管中,水浴蒸干。然后,依次加入0.2 mL 5%香草醛冰乙酸溶液和0.8 mL高氯酸,混匀,于60 ℃水浴锅中加热15 min,取出,迅速冰浴10 min,再加入冰乙酸定容至10 mL。将其在200~800 nm进行全波长扫描,选取吸收峰较大的波长。同时将各种辅料按上述方法分别配制成相应的溶液在200~800 nm进行全波长扫描,观察在选定波长下有无吸收,确定测定G-Rg3的最佳波长为550 nm。精密吸取Rhe对照品储备液0.10 mL,将其在200~800 nm进行全波长扫描,选取吸收峰较大的波长。同时将各种辅料用0.5%氢氧化钠溶液分别配制成相应的溶液,在200~800 nm进行全波长扫描,确定测定Rhe的最佳波长为241 nm。
2.1.4 线性关系考察 精密吸取0.20、0.30、0.40、0.50、0.60、0.70 mL的G-Rg3对照品储备液,置于10 mL量瓶中,水浴蒸干后精确加入0.2 mL 5%香草醛冰乙酸溶液,再加入0.8 mL高氯酸,混匀,于60 ℃水浴锅上加热15 min,取出,迅速冰浴10 min,加入冰乙酸定容至刻度,混匀,配制成质量浓度分别20.40、30.60、40.80、51.00、61.20、71.40 μg/mL的G-Rg3对照品溶液。以空白为参比,分别在550 nm波长处测定吸光度()值。精密吸取0.10、0.12、0.14、0.16、0.18、0.20 mL的Rhe对照品储备液,置于10 mL量瓶中,加入0.5%氢氧化钠溶液定容至刻度,混匀,配制成质量浓度分别为10.40、12.48、14.56、16.64、18.72、20.80 μg/mL的Rhe对照品溶液。以空白为参比,分别在241 nm波长处测定值。以值为纵坐标,标准溶液质量浓度()为横坐标绘制标准曲线,进行线性回归。结果G-Rg3的标准曲线方程为=0.012 1+0.033 4,2=0.999 3,结果表明G-Rg3在20.40~71.40 μg/mL线性关系良好。Rhe的标准曲线方程为=0.030 6-0.004 9,2=0.999 4,结果表明Rhe在10.40~20.80 μg/mL线性关系良好。
2.1.5 精密度试验 精密吸取适量的G-Rg3、Rhe对照品储备液,按“2.1.4”项下方法分别制得20 μg/mL的对照品溶液,于550、241 nm波长处测定值,重复6次。结果G-Rg3值的RSD值为0.48%,Rhe值的RSD值为0.38%,表明仪器精密度良好。
2.1.6 稳定性试验 精密吸取适量的G-Rg3、Rhe对照品储备液,各1份,按“2.1.4”项下方法分别制得40、14 μg/mL的对照品溶液。分别于室温下放置0、5、10、15、20、25 min时测定值。结果G-Rg3值的RSD值为1.25%,Rhe值的RSD值为0.66%,表明G-Rg3对照品溶液、Rhe对照品溶液在25 min内稳定性良好。
2.1.7 重复性试验 精密吸取适量的G-Rg3、Rhe对照品储备液,按“2.1.4”项下方法分别制得40、14 μg/mL的对照品溶液,各6份,分别于550、241 nm波长处测定值。结果G-Rg3值的RSD值为0.41%,Rhe值的RSD值为0.63%,表明该方法重复性良好。
2.1.8 加样回收率试验 称取3.0 mg已测定含量的G-Rg3,共6份,分别精密加入G-Rg3对照品储备液1.0 mL,置于10 mL量瓶中,加入75%乙醇溶解并稀释至刻度。按“2.1.4”项下方法显色后于550 nm波长处测定值。称取1.0 mg已知含量的Rhe,共6份,分别精密加入Rhe对照品储备液0.4 mL,置于100 mL量瓶中,加入0.5%氢氧化钠溶液定容至刻度,于241 nm波长处测定值。结果G-Rg3的平均加样回收率为98.89%,RSD值为0.71%,Rhe的平均加样回收率为97.87%,RSD值为0.94%,表明该方法具有较好的加样回收率。
2.2 G-Rg3/Rhe NE处方的确定及制备
2.2.1 辅料的选择 亲水亲油平衡(hydrophile- lipophile balance,HLB)是选择乳化剂和助乳化剂的一个重要依据。G-Rg3、Rhe溶解性差的问题可通过制备成O/W纳米乳而改善,HLB值介于8~18可用于制备O/W纳米乳,故选择油酸山梨坦、聚山梨酯80、PHCO EL35作为侯选乳化剂,选择正丁醇、乙醇、1,2-丙二醇、聚乙二醇400作为候选助乳化剂。油相[29]是脂溶性和难溶性药物的主要载体,一般选择成分较纯、性质稳定、黏度低的油类,故选择药用纳米乳中常用的大豆油、油酸乙酯、肉豆蔻酸异丙酯、辛癸酸甘油酯作为候选油相。
2.2.2 G-Rg3和Rhe在各辅料中溶解能力的考察 量取各辅料2 mL置于具塞锥形瓶中,加入过饱和的G-Rg3或Rhe,涡旋5 min,超声20 min,置于(37.0±0.5)℃恒温水浴24 h后,4000 r/min离心10 min,精密吸取适量上清液,按照紫外分光光度法测定并计算G-Rg3或Rhe在不同辅料中的溶解度(表1)。结合G-Rg3和Rhe两者的溶解度情况,在各乳化剂中的溶解度为PHCO EL35>油酸山梨坦>聚山梨酯80,在各助乳化剂中的溶解度为聚乙二醇400>1,2-丙二醇>乙醇>正丁醇,在各油相中的溶解度为辛癸酸甘油酯>大豆油>肉豆蔻酸异丙酯>油酸乙酯。因此,选择乳化剂PHCO EL35、助乳化剂聚乙二醇400、油相辛癸酸甘油酯这3种辅料作为G-Rg3/Rhe NE的处方组成。
表1 G-Rg3和Rhe在不同辅料中的溶解度
Table 1 Solubility of G-Rg3 and Rhe in different excipients
辅料类别辅料名称G-Rg3/(μg∙mL−1)Rhe/(μg∙mL−1) 乳化剂油酸山梨坦747.06±0.13193.66±0.11 聚山梨酯80502.12±0.22157.21±0.27 PHCO EL35773.85±0.051 580.83±0.40 助乳化剂正丁醇326.46±0.0723.23±0.15 乙醇403.65±0.3133.14±0.21 1,2-丙二醇695.40±0.5794.50±0.34 聚乙二醇4001 806.61±0.323 318.88±0.51 油相大豆油768.11±0.09322.18±0.13 油酸乙酯442.80±0.24133.92±0.11 肉豆蔻酸异丙酯509.78±0.17107.48±0.05 辛癸酸甘油酯1 367.06±0.32207.61±0.02
2.2.3 乳化剂与助乳化剂的质量比(m值)对纳米乳体系形成的影响 采用滴加水相法绘制伪三元相图。室温条件下,首先将m值分别为1∶1、1∶2、1∶4的乳化剂与助乳化剂混匀得到混合乳化剂(S),再将油相和混合乳化剂分别按1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1混合得到油相混合物。然后在所得的油相混合物中缓慢滴加水相,滴加的同时不断地搅拌,当体系变成透明并带有淡蓝色乳光的溶液时,认定纳米乳液形成,记录临界加入水量,绘制伪三元相图。伪三元相图中,其中1条边代表乳化剂与助乳化剂组成的混合乳化剂(S),另外2条边分别代表油相(O)和水相(W),根据临界点各成分的质量分数,用Origin 9.1绘制伪三元相图,确定纳米乳区界限,以形成的纳米乳区域面积最大的体系确定最佳m值。结果显示,当m=1∶2时,所形成的纳米乳区域最大(图1)。因此,确定G-Rg3/Rhe NE的最佳处方组成为m值为1∶2的PHCO EL35-聚乙二醇400-辛癸酸甘油酯-水,其质量比为1.33∶2.67∶2.80∶12.50。
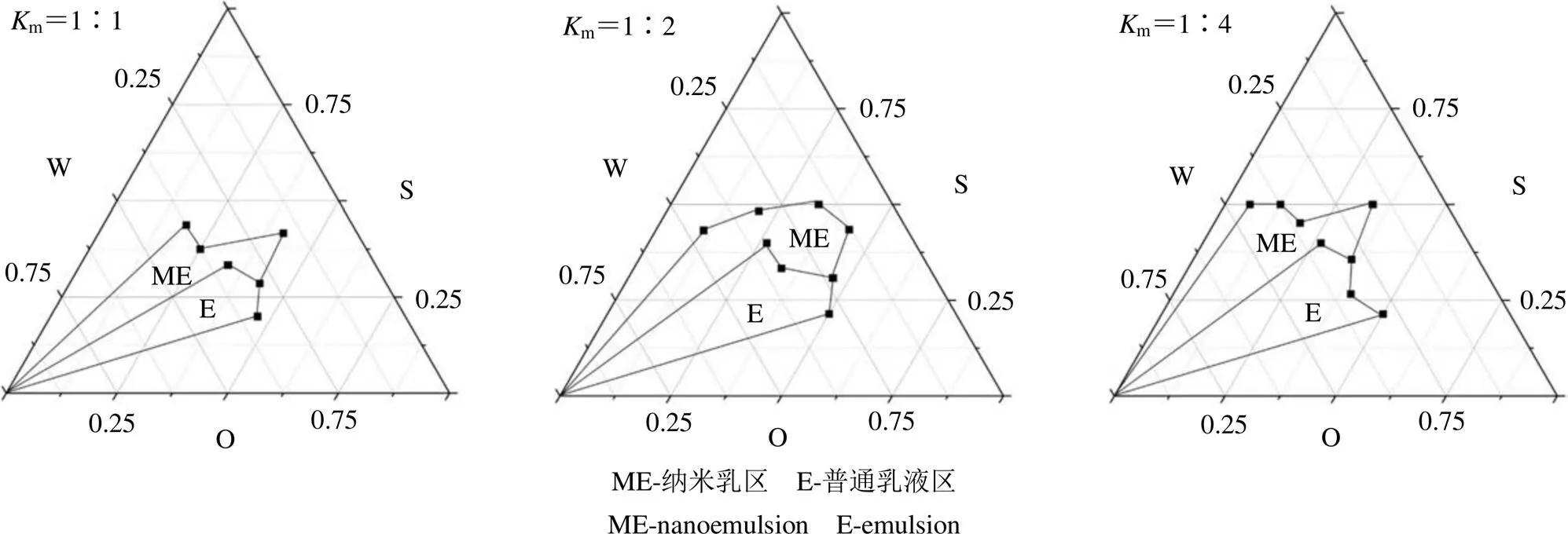
图1 Km值对PHCO EL35-聚乙二醇400-辛癸酸甘油酯-水纳米乳体系的影响
2.2.4 G-Rg3/Rhe NE的制备 精密称取1.33 g PHCO EL35、2.67 g聚乙二醇400、2.80 g辛癸酸甘油酯于50 mL烧杯中,在37 ℃下用磁力搅拌器以200 r/min的转速搅拌10 min使其充分混匀,之后少量多次地投入0.026 g G-Rg3、0.027 g Rhe,继续搅拌10 min并超声助溶30 min,最后缓慢滴加12.50 g水于混合体系中,混合均匀,即得G-Rg3/Rhe NE。
2.3 G-Rg3/Rhe NE理化性质的考察
2.3.1 粒径与电位考察 取G-Rg3/Rhe NE适量,稀释100倍后使用马尔文激光粒度仪测定G-Rg3/ Rhe NE的粒径、多分散系数(PDI)及ζ电位。根据优化处方制备的空白纳米乳澄清透明,略带淡蓝色乳光,具有一定的流动性(图2-a)。G-Rg3/Rhe NE的外观呈淡黄色、可见乳光,流动性良好(图2-b),平均粒径和PDI为(84.8±1.1)nm和0.21±0.02(图3),ζ电位为(−11.30±0.43)mV(图4)。
2.3.2 稳定性考察
(1)离心试验:将G-Rg3/Rhe NE以4000 r/min离心20 min后,纳米乳未出现分层、浑浊、药物沉淀等现象。

图2 空白纳米乳(a)与载药纳米乳(b)的外观图
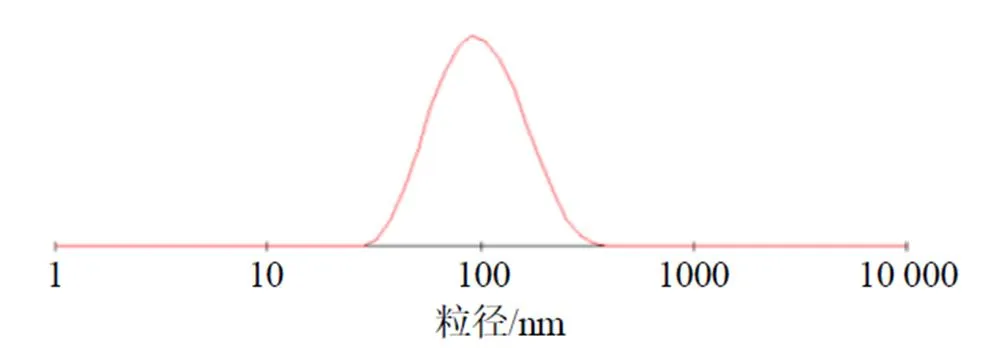
图3 G-Rg3/Rhe NE的粒径分布
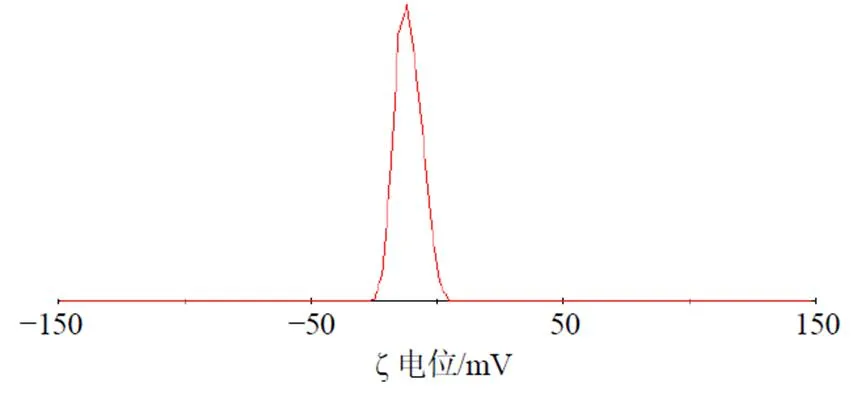
图4 G-Rg3/Rhe NE的ζ电位
(2)温度试验:将G-Rg3/Rhe NE放置于高温(40、60 ℃)、低温(4 ℃)下,于3、7 d取样观察,仍为黄色澄清均一体系,纳米乳未出现分层、浑浊、药物沉淀等现象。表明该纳米乳具有良好的稳定性。
2.3.3 包封率和载药量 取适量稀释后的G-Rg3/ Rhe NE,按照紫外分光光度法测定G-Rg3和Rhe的含量,计算包封率和载药量。计算得出G-Rg3、Rhe的包封率分别为96.51%、97.47%,两药共载的载药量为0.75%。
包封率=包封/总
载药量=包封/(包封+载体)
包封为纳米乳中药物质量,总为投入药物总量,载体为除水的纳米乳空白载体质量
2.4 G-Rg3/Rhe NE的体内抗肿瘤药效学研究
2.4.1 荷4T1Fluc小鼠模型的建立 将约8周龄的BALB/C小鼠在动物房饲养1周,待其适应环境后进行造模实验。首先选择处于对数生长期的4T1Fluc细胞,经除去旧培养基、PBS清洗、胰蛋白酶消化、离心、弃去上清等一系列步骤后,立即加入PBS制备成单细胞悬液,调整细胞数约为5×106个/mL。用无菌注射器快速吸取0.1 mL,注射于小鼠右前肢外侧皮下的第2对乳房下,当肿瘤体积长至约60 mm3时,开始给药。
2.4.2 动物分组及给药 将20只荷瘤小鼠随机分为4组,分别为PBS(10 mg/kg)组、aPD-L1(100 µg/只)组、G-Rg3/Rhe NE(10 mg/kg)组、G-Rg3/Rhe NE+aPD-L1组,每组5只。其中PBS组和G-Rg3/Rhe NE组每天1次,连续给药12 d;aPD-L1组每2天1次,连续给药4次;G-Rg3/Rhe NE+aPD-L1组2种药物的给药方式与各自单一给药时相同,并于G-Rg3/Rhe NE给药第1天同时开始给予aPD-L1。均采用ip给药,停药1周后处死小鼠。
2.4.3 肿瘤体积变化及抑瘤效果 给药期间,用游标卡尺测量荷瘤小鼠肿瘤的最长径()与最短径(),自给药日起每2天1次连续测定直至处死。按公式=2/2记录肿瘤体积变化,绘制肿瘤生长曲线(图5)。试验结束时,剥离各试验组荷瘤小鼠的肿瘤,拍照留存(图6)。结果显示,PBS组荷瘤小鼠的肿瘤体积随着治疗时间的延长而不断增长,aPD-L1组同PBS组肿瘤大小较为接近,均没有表现出明显的肿瘤抑制作用。而G-Rg3/Rhe NE组和G-Rg3/Rhe NE+aPD-L1组的荷瘤小鼠肿瘤体积随时间延长得到明显抑制并同PBS组和aPD-L1组具有显著差异。结果表明,经G-Rg3/Rhe NE治疗后,能抑制荷瘤小鼠肿瘤增长,而联合aPD-L1能取得更加显著的治疗效果。
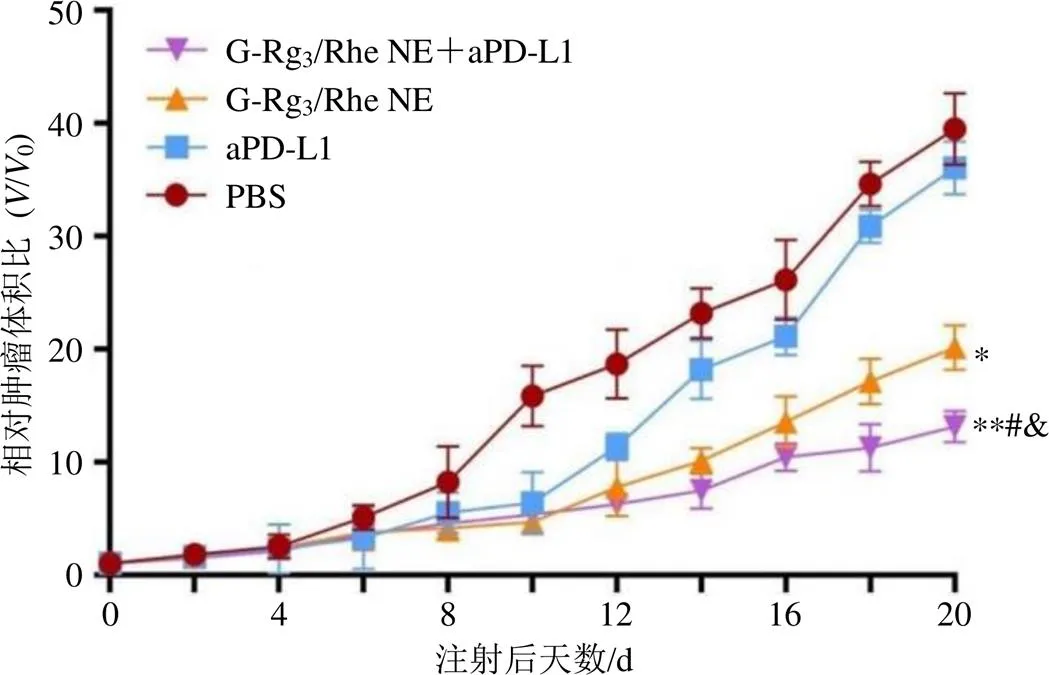
与PBS组比较:*P<0.05 **P<0.01;与aPD-L1组比较:#P<0.05;与G-Rg3/Rhe NE组比较:&P<0.05

图6 荷4T1Fluc瘤株的BALB/C小鼠肿瘤剥离图
3 讨论
G-Rg3、Rhe及其制剂的常用的含量检测方法主要有HPLC法、荧光分析法、紫外分光光度法等。其中,HPLC法的优点是灵敏度高、检测限低、精确度高,但该方法操作繁琐,不适于快速分析和现场检测。而紫外分光光度法所用仪器较普遍,操作快速简便,重现性和稳定性好,结果准确。
纳米乳因其粒径较小且均匀而优于普通乳剂,同时相比其他剂型如膏剂、凝胶剂等,纳米乳的给药途径多样,尤其适用于注射给药。纳米乳的黏度远低于普通液滴,可缓解传统的注射给药因注射液黏度大易导致人体注射部位疼痛的问题,因此,具有良好的顺应性[30]。
在纳米乳液的开发中,处方组成筛选是制备纳米乳的关键,其实质是确定油相、乳化剂和助乳化剂的种类及三者的最佳配比。若处方组成及比例不当,则不能形成纳米乳或形成纳米乳的区域太小,不能达到增溶药物的目的。因此,本实验采用紫外分光光度法建立含量分析方法学,测定G-Rg3、Rhe在不同辅料中的溶解情况来确定处方组成。最终选择辛癸酸甘油酯作为油相,PHCO EL35为乳化剂和聚乙二醇400作助乳化剂。辛癸酸甘油酯是一种中碳链脂肪酸甘油酯,可与各种溶剂互溶,它的溶解性和稳定性都优于普通油脂[31]。PHCO EL35是一种非离子型表面活性剂,HLB值为15~18,常作为 增溶剂,该乳化剂的加入可以有效降低分散体系的界面张力,并形成界面膜,从而提高乳化液的稳定性[32]。此外,有研究表明具有中等碳链长度和较高HLB值的油类在纳米乳液的生产中更可取[33-34]。但非离子型表面活性剂在温度升高时,由于水分子会逐渐脱离醚键而使水溶性降低,因此,助乳化剂的加入能使纳米乳更加稳定。其中醇类是常用的助乳化剂,与乳化剂在适宜的比例下,可在油水界面形成油-水混合膜,破坏油水界面中水相的有序排列,提高混合膜的柔韧性[35],能明显减小O/W型纳米乳的粒径,增大其溶解度。m值的确定对纳米乳体系的形成也是至关重要的。在不同的m值条件下纳米乳的粒径、载药量方面也会表现出较大的差异,进而影响药效的发挥[36]。本研究采用伪三元相图法对G-Rg3/Rhe NE的处方成分配比进行优化,该方法操作简便,结果直观可靠。
TNBC是复发转移性强、侵袭性高、预后差的难治性肿瘤,以aPD-L1为代表的肿瘤免疫疗法单用响应率极低。G-Rg3/Rhe NE的体内抗肿瘤药效学研究也证明了这一点。且这种单方面拮抗性治疗的观念缺乏整体性,可能导致免疫不平衡引发新的副作用,具有一定的局限性[37]。目前aPD-L1常联合化疗应用于TNBC但毒副作用较大,而中药调控免疫抗TNBC将扶正固本放在首位,强调从整体层面调节机体的免疫功能。目前G-Rg3在肿瘤免疫以及与aPD-L1联合抗肿瘤的研究很多,其可抑制肿瘤细胞增殖、侵袭和转移,促进肿瘤细胞凋亡,还可抑制肿瘤血管生成,影响肿瘤信号转导相关基因的表达等[38-40]。此外,G-Rg3能抑制核因子-κBp65(nuclear factor-κBp65,NF-κBp65)和蛋白激酶B(protein kinase B,Akt)表达[41],调控γ-干扰素(interferon-γ,IFN-γ),介导磷脂酰肌醇-3激酶/蛋白激酶B/哺乳动物雷帕霉素蛋白(phosphatidylinositol-3 kinase/protein kinase B/mammalian rapamycin protein,PI3K/Akt/mTOR)信号通路[42],降低化疗耐药诱导的PD-L1表达,恢复T细胞对癌细胞的细胞毒作用[41]。而Rhe能抑制肿瘤细胞增殖、迁移、逆转多药耐药、增强低氧环境中效应T细胞的抗肿瘤活性等多种途径实现抗肿瘤[43]。Shen等[44]将Rhe与阿特珠单抗联合治疗乳腺癌后发现乳腺肿瘤生长得到抑制,Rhe可增强阿特珠单抗对乳腺癌的治疗作用。此外,Rhe可通过诱导活性氧(reactiveoxygen species,ROS)的产生和激活c-Jun氨基末端激酶(C-Jun amino terminal kinase,JNK)/Jun/Caspase-3这一信号通路促使细胞凋亡[45],还可以下调缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)的表达,改善肿瘤免疫微环境[46]。本研究中G-Rg3/Rhe NE的体内抗肿瘤药效学也表明经G-Rg3/Rhe NE治疗后,能抑制荷瘤小鼠肿瘤增长,而联合aPD-L1的抑瘤效果更佳。
综上,本实验基于中医整体观及扶正祛邪治法,选择G-Rg3、Rhe配伍开展了联合aPD-L1治疗TNBC的研究,制备了包载G-Rg3和Rhe可iv的纳米乳,为改善G-Rg3和Rhe溶解度以便于临床注射给药提供了实验基础。并结合动物实验通过初步药效学研究证实了G-Rg3/Rhe NE联合aPD-L1可显著抑制荷瘤小鼠乳腺肿瘤增长,为该制剂在肿瘤免疫治疗的应用奠定了实验基础。
志谢:浙江中医药大学中医药科学院医学科研中心公共平台提供的技术协助。
利益冲突 所有作者均声明不存在利益冲突
[1] Bray F, Ferlay J, Soerjomataram I,. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2018, 68(6): 394-424.
[2] Lusho S, Durando X, Bidet Y,. PERCEPTION trial protocol: Comparison of predictive and prognostic capacities of neutrophil, lymphocyte, and platelet counts and tumor-infiltrating lymphocytes in triple negative breast cancer [J]., 2020, 99(50): e23418.
[3] An G, Lu F, Huang S,. Effects of miR-93 on epithelial-to-mesenchymal transition and vasculogenic mimicry in triple-negative breast cancer cells [J]., 2021, 23(1): 30.
[4] Nedeljković M, Damjanović A. Mechanisms of chemotherapy resistance in triple-negative breast cancer-how we can rise to the challenge [J]., 2019, 8(9): 957.
[5] Choi J, Lee H J, Yoon S,. Blockade of CCL2 expression overcomes intrinsic PD-1/PD-L1 inhibitor- resistance in transglutaminase 2-induced PD-L1 positive triple negative breast cancer [J]., 2020, 10(9): 2878-2894.
[6] Gulley J L, Rajan A, Spigel D R,. Avelumab for patients with previously treated metastatic or recurrent non-small-cell lung cancer (JAVELIN solid tumor): Dose- expansion cohort of a multicentre, open-label, phase 1b trial [J]., 2017, 18(5): 599-610.
[7] Vaishampayan U, Schöffski P, Ravaud A,. Avelumab monotherapy as first-line or second-line treatment in patients with metastatic renal cell carcinoma: phase Ib results from the JAVELIN solid tumor trial [J]., 2019, 7(1): 275.
[8] Schmid P, Adams S, Rugo H S,. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer [J]., 2018, 379(22): 2108-2121.
[9] Adams S, Loi S, Toppmeyer D,. Pembrolizumab monotherapy for previously untreated, PD-L1-positive, metastatic triple-negative breast cancer: cohort B of the phase II KEYNOTE-086 study [J]., 2019, 30(3): 405-411.
[10] Mens L A, Cruz C, Eder J P,. Long-term clinical outcomes and biomarker analyses of Atezolizumab therapy for patients with metastatic triple-negative breast cancer: A phase 1 study [J]., 2019, 5(1): 74-82.
[11] 贾喜花, 高尚璞, 郑勇, 等. 唐汉钧治疗乳腺癌经验 [J]. 中医杂志, 2003(2): 96-97.
[12] 罗毅. 胃MALT淋巴瘤的中西医结合治疗策略探讨 [J]. 新中医, 2013, 45(8): 134-136.
[13] 周迪, 朱文伟, 胡明辉, 等. 从自噬效应探讨“扶正祛邪法”治疗恶性肿瘤的作用及临床应用 [J]. 辽宁中医杂志, 2018, 45(12): 2537-2539.
[14] 熊露, 田少霞. 扶正培本治则方药调节肿瘤微环境免疫与血管正常化的思路研究 [J]. 中国中西医结合杂志, 2010, 30(2): 201-204.
[15] 谭婉燕, 熊枝繁. 中药抗肿瘤临床应用的相关思考 [J]. 山西医科大学学报, 2017, 48(9): 966-967.
[16] 明·张介宾. 景岳全书 [M]. 北京: 中国中医药出版社, 1994: 645.
[17] 彭晔, 胡志强, 韩轶超, 等. 大黄人参方联合改良DCF方案治疗晚期胃癌临床研究 [J]. 河北中医, 2015, 37(7): 1008-1011.
[18] 李炳茂, 彭晔, 王艳玲, 等. 大黄人参方缓解晚期消化道恶性肿瘤患者化疗副反应及提高疗效的临床研究 [J]. 河北中医, 2015, 37(12): 1780-1783.
[19] 张瑞贤. 徐灵胎神农本草经百种录 [M]. 北京: 华夏出版社, 1998: 1102.
[20] 郭先帅, 吴纯伟, 梁生旺, 等. 大黄与人参配伍用于治疗缺血性脑中风的探讨 [J]. 中国现代医药杂志, 2015, 17(2): 110-112.
[21] 李健莹, 栾晓娇, 王凯乾, 等. 人参皂苷Rg3固体分散体的制备及表征 [J]. 中国药学杂志, 2015, 50(10): 872-875.
[22] Xu H, Lu Y, Zhang T,. Characterization of binding interactions of anthraquinones and bovine β-lactoglobulin [J]., 2019, 281: 28-35.
[23] Crivelli B, Perteghella S, Bari E,. Silk nanoparticles: From inert supports to bioactive natural carriers for drug delivery [J]., 2018, 14(4): 546-557.
[24] Mukherjee A, Waters A K, Kalyan P,. Lipid-polymer hybrid nanoparticles as a next-generation drug delivery platform: state of the art, emerging technologies, and perspectives [J]., 2019, 14: 1937-1952.
[25] Jin X, Sun P, Tong G,. Star polymer-based unimolecular micelles and their application in bio- imaging and diagnosis [J]., 2018, 178: 738-750.
[26] Yen C C, Chen Y C, Wu M T,. Nanoemulsion as a strategy for improving the oral bioavailability and anti-inflammatory activity of andrographolide [J]., 2018, 13: 669-680.
[27] Liu G Y, Yang J Q, Wang Y X,. Protein-lipid composite nanoparticles for the oral delivery of vitamin B12: Impact of protein succinylation on nanoparticle physicochemical and biological properties [J]., 2019, 92: 189-197.
[28] Rai VK, Mishra N, Yadav KS,. Nanoemulsion as pharmaceutical carrier for dermal and transdermal drug delivery: Formulation development, stability issues, basic considerations and applications [J]., 2018, 270: 203-225.
[29] Wan J, Zhong SB, Schwarz P,. Physical properties, antifungal and mycotoxin inhibitory activities of five essential oil nanoemulsions: Impact of oil compositions and processing parameters [J]., 2019, 291: 199-206.
[30] 姚云霞, 李云, 李媛, 等. 纳米乳在药剂学中的研究及应用进展 [J]. 军事医学, 2021, 45(6): 473-478.
[31] 张万福编译. 食品乳化剂 [M]. 北京: 中国轻工业出版社, 1993: 117-135.
[32] 吴艾璟. 食用香味料常用溶剂乳化性能研究及稳定性评价 [D]. 贵州: 贵州大学, 2015.
[33] Rao SV, Shao J. Self-nanoemulsifying drug delivery systems (SNEDDS) for oral delivery of protein drugs: I. Formulation development [J].,2008, 362(1-2): 2-9.
[34] Elnaggar Y S, El-Massik M A, Abdallah O Y. Self- nanoemulsifying drug delivery systems of tamoxifen citrate: Design and optimization [J]., 2009, 380(1/2): 133-41.
[35] 王敏娟, 李惠民, 冯锁民, 等. 纳米乳载药研究进展 [J]. 化工科技, 2020, 28(1): 69-75.
[36] 罗国平, 妙苗, 白杨, 等. 伪三元相图法优化复方丁香油微乳制备工艺 [J]. 中国药业, 2020, 29(7): 87-89.
[37] 韩立炜, 果德安, 刘菊妍, 等. 2020年度中医药重大科学问题及工程技术难题 [J]. 中医杂志, 2020, 61(19): 1671-1678.
[38] Zhao L, Shou H, Chen L,. Effects of ginsenoside Rg3on epigenetic modification in ovarian cancer cells [J]., 2019, 41(6): 3209-3218.
[39] Meng L, Ji R, Dong X,. Antitumor activity of ginsenoside Rg3in melanoma through downregulation of the ERK and Akt pathways [J]., 2019, 54(6): 2069-2079.
[40] Yang X, Zou J, Cai H,. Ginsenoside Rg3inhibits colorectal tumor growth via down-regulation of C/EBPβ/ NF-κB signaling [J]., 2017, 96: 1240-1245.
[41] Jiang Z, Yang Y, Yang Y,. Ginsenoside Rg3attenuates cisplatin resistance in lung cancer by downregulating PD-L1 and resuming immune [J]., 2017, 96: 378-383.
[42] 王蔚, 王旭, 余苏云, 等. 人参皂苷Rg3调节免疫检查点PD-L1抑制肺癌Lewis细胞增殖的作用及机制研究 [J]. 中草药, 2019, 50(1): 166-171.
[43] Li G M, Chen J R, Zhang H Q,. Update on pharmacological activities, security, and pharmacokinetics of rhein [J]., 2021, 2021: 4582412.
[44] Shen Z, Zhu B, Li J,. Rhein augments antiproliferative effects of atezolizumab based on breast cancer (4T1) regression [J]., 2019, 85(14/15): 1143-1149.
[45] Wang A L, Jiang H H, Liu Y Y,. Rhein induces liver cancer cells apoptosis via activating ROS-dependent JNK/Jun/caspase-3 signaling pathway [J]., 2020, 11(2): 500-507.
[46] 袁向飞, 田文聪, 谢俊木子, 等. 大黄酸增强低氧环境中效应T细胞的抗结肠癌活性 [J]. 中国中西医结合外科杂志, 2018, 24(4): 476-481.
Preparation of ginsenoside Rg3 and rhein nanoemulsion and pharmacodynamics study of its combination with aPD-L1 in treatment of triple negative breast cancer
ZHANG Fei-feng1, QIAN Ke1, 2, MA Li-sha1, 2, ZHAO Yue1, 2,SHI Jing-bin1, 2,XU Shu-jun1, 2,XIONG Yang1, 2
1. Department of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 311402, China 2. Academy of Chinese Medical Science, Zhejiang Chinese Medical University, Hangzhou 310053, China
According to the “supporting healthy energy to eliminate evils” treatment principle advocated by traditional Chinese medicine in the treatment of tumors, the main components ginsenoside Rg3(G-Rg3) and rhein (Rhe) in ginseng and rhubarb, respectively, were selected to prepare G-Rg3/Rhe nanoemulsion. At the same time, the solubility of G-Rg3and Rhe was improved to facilitate injection administration, and the nanoemulsion combined with anti-programmed cell death ligand 1 (aPD-L1) was used to treat triple negative breast cancer (TNBC).The solubility of G-Rg3and Rhe in different excipients was determined by UV spectrophotometry, and the appropriate emulsifier, co-emulsifier and oil phase were screened out. The pseudo-ternary phase diagram was used to investigate the effect ofmvalue on the nanoemulsion system, and the appropriatemvalue was selected according to the size of the nanoemulsion area. The prescription of G-Rg3/Rhe NE was optimized, and its characterization and stability were evaluated. The 4T1Flucmammary tumor mouse model was selected to evaluate the effect of G-Rg3/Rhe NE combined with aPD-L1 on TNBC.The optimized component ratio of G-Rg3/Rhe NE was as follows: polyoxyethylene hydrogenated castor oil EL35-polyethylene glycol 400-caprylic acid glyceride-water, and the mass ratio was 1.33:2.67:2.80:12.50, themvalue was 1:2. The average particle size of G-Rg3/Rhe NE was (84.8 ± 1.1) nm, the polydispersity index (PDI) was 0.21 ± 0.02, and the ζ potential was (−11.30 ± 0.43) mV. The encapsulation rates of G-Rg3and Rhe in drug-carrying nanoemulsions were 96.51% and 97.47%, respectively, and the drug loading capacity of the two drugs was 0.75%. G-Rg3/Rhe NE combined with aPD-L1 could significantly inhibit the tumor growth in 4T1Fluc-bearing mice.The G-Rg3/Rhe NE was of uniform particle size and good stability, it could synergistically enhance the antitumor effect of aPD-L1 on TNBC.
ginsenoside Rg3; rhein; nanoemulsion; triple negative breast cancer; aPD-L1
R283.6
A
0253 - 2670(2022)16 - 4973 - 09
10.7501/j.issn.0253-2670.2022.16.006
2022-02-20
国家自然科学基金资助项目(82174095);浙江省自然科学基金重点项目(Z22H296589);浙江省医药卫生科技计划项目(2021KY813);国家级大学生创新创业训练计划(202110344032)
张翡峰,女,在读本科生。E-mail:1390923765@qq.com
熊 阳,女,博士生导师,教授,从事肿瘤免疫治疗、肿瘤联合用药及新型递送系统研究。E-mail: xyxnb@126.com
#共同第一作者:钱 柯,女,硕士研究生,研究方向为药物新剂型及新技术研究。E-mail: imqianke@163.com
[责任编辑 郑礼胜]

