1H NMR代谢组学在筛选乳腺浸润性导管癌HER2阳性表达代谢标志物中的应用*
刘影, 阳宇, 郑细闰, 刘红英, 吴云山, 郑广娟△
1广东省中医院病理科(广东广州 510120); 2广东省中医药科学院(广东广州 510006)
乳腺浸润性导管癌是乳腺癌最常见的一种亚型,高达70%以上[1-2]。人类表皮生长因子受体2(HER2)阳性乳腺癌易复发易转移生长快,是患者预后不良的重要指标[3],且HER2表达越高显示浸润性越强[4],导致患者对化疗药物和内分泌治疗药物不敏感。因此HER2的表达情况是乳腺癌常规病理检查的一项重要内容,也是精准医疗下能否使用以HER2为靶点的分子靶向药物的重要依据[5]。目前,对于HER2表达判读指南推荐使用的是免疫组织化学(IHC)与荧光原位杂交染色(FISH)相结合的方法,判读结果基本比较明确。在肿瘤的发生及发展过程中,患者体内肿瘤细胞任何微小的变化均会导致其代谢物不同寻常的改变[6]。目前,代谢组学在各种癌症的早期诊断及个性化治疗方面都显示了巨大潜力[7-12]。基于以上报道的启发,本研究尝试利用代谢组学的方法筛选出与HER2阳性表达相关的差异代谢物,或可为临床HER2表达的准确判读提供有效的参考,从而指导患者治疗和预后判断。
1 资料与方法
1.1 一般资料 选取本院2019年1月30日至2020年7月31日经乳腺穿刺活检被确诊为浸润性乳腺癌的68例女性患者作为研究对象,年龄28~80岁;所有入选患者无明显感染及其他恶性肿瘤病史,且均未接受过放、化疗及内分泌治疗、靶向药等新辅助治疗。入选患者的病理活检和病理报告全部由该院病理科完成,并由2位中级职称以上的病理医师阅片判定。根据HER2检测指南(2019版)[13],乳腺癌标本一般先做IHC检测,以IHC结果为依据,将HER2(3+)的患者作为阳性组,共26例,年龄(49.78±7.57)岁;将HER2(1+/0)的患者作为阴性组,共42例,年龄(51.03±11.38)岁,两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究得到医院医学伦理委员会批准(广东省中医院伦理委员会BE2019-013),并经患者知情同意。
1.2 样品收集及处理 采用分离胶促凝管收集所有入选患者的空腹血液3 mL,静置30 min后离心分离上层血清,置于1.5 mL Ep管,-80℃冰箱保存。
采样前,将血清取出于室温解冻,离心10 min,4℃,5 000 r/min。取300 μL上清加到5 mm核磁管中,再于每管加入150 μL磷酸盐缓冲液(PBS,pH 7.4)和100 μL重水,反复颠倒混匀。
1.3 核磁共振波谱测定 采用Bruker AVANCE Ⅲ 500 MHz 超导核磁共振波谱仪,脉冲序列为Carr-Purcell-Meiboom-Gill(CPMG)。检测参数如下:实验温度298 K,回波时间2 nτ=100 ms,延迟时间3 s,谱宽10 kHz,采集点数32 k,采集次数128次。对所有NMR图谱用AMIX (Version 2.0, Bruker Biospin, Germany) 进行自动积分并进行归一化处理,然后进行模式识别分析。
1.4 模式识别分析 采用SIMCA-P+12.0软件 (Umetrics, Sweden) 进行PCA和OPLS-DA模式识别分析。分析结果用得分图 (score plot) 和相关系数-载荷图(coefficiet-coded loading plot)表示。其中Score图可以直观地看出所有样本的自动分组,而 loading图则给出两样本间的差异代谢物。

2 结果
2.1 IHC结果对比 HER2表达阴性组表现浸润性癌细胞未见或仅见不完整的、微弱的细胞膜染色,见图1-A,而HER2表达阳性组可见大量(>10%)的浸润癌细胞呈现强、完整且均匀的细胞膜染色附着阳性染色,见图1-B。

注:A:HER2表达阴性;B:HER2表达阳性
2.2 乳腺浸润性导管癌HER2表达阴性组与阳性组患者血清的1H NMR谱比较 乳腺浸润性导管癌HER2阴性组(图2-A)与阳性组(图2-B)血清的1H CPMG谱中主要包括26种代谢物,由于个体差异,尚不能肉眼直接观察到两组之间的差异代谢物, 因此还需要运用模式识别分析方法来确定两组间的差异以及筛选差异代谢物。

注:A:HER2表达阴性组;B:HER2表达阳性组;1-低密度脂蛋白(LDL);2-极低密度脂蛋白(VLDL);3-异亮氨酸(iosleucine);4-亮氨酸(leucine);5-缬氨酸(valine);6-异丁酸盐(isobutyrate);7-3-羟基丁酸(3-HYD);8-脂质(lipid);9-乳酸(lactate);10-丙氨酸(alanine);11-醋酸(acetate);12-糖蛋白(glycoprotein);13-谷氨酰胺(glutamine);14-谷氨酸盐(glutamate);15-乙酰乙酸(acetoacetate);16-柠檬酸盐(citrate);17-肌酸(creatine);18-组氨酸(histidine);19-胆碱(choline);20-牛磺酸(taurine);21-脯氨酸(proline);22-α葡萄糖(α-glucose);23-β葡萄糖(β-glucose);24-苏氨酸(threonine);25-肌酐(creatinine);26-不饱和脂(unsaturated lipids)
2.3 模式识别分析 图3-A为乳腺浸润性导管癌HER2表达阴性组与阳性组患者血清1H CPMG谱的OPLS-DA得分图(R2X=72.7%,R2Y=85.5%,Q2=57.2%),如图3-A所示乳腺浸润性导管癌HER2表达阴性组与阳性组患者的血清在t[1]维可以完全分开,表示两者在血清代谢组学上差异明显,通过OPLS-DA 中相关系数编码的负载图(图3-B)结果可以得出对此区分有特别贡献的代谢物。如图3-B所示,与乳腺浸润性导管癌HER2表达阴性组患者相比,阳性组血清中亮氨酸/异亮氨酸、丙氨酸、醋酸、谷氨酰胺、谷氨酸盐、牛磺酸的含量是升高的;而3-羟基丁酸、脂质(主要是VLDL)、乳酸、葡萄糖的含量是下降的。
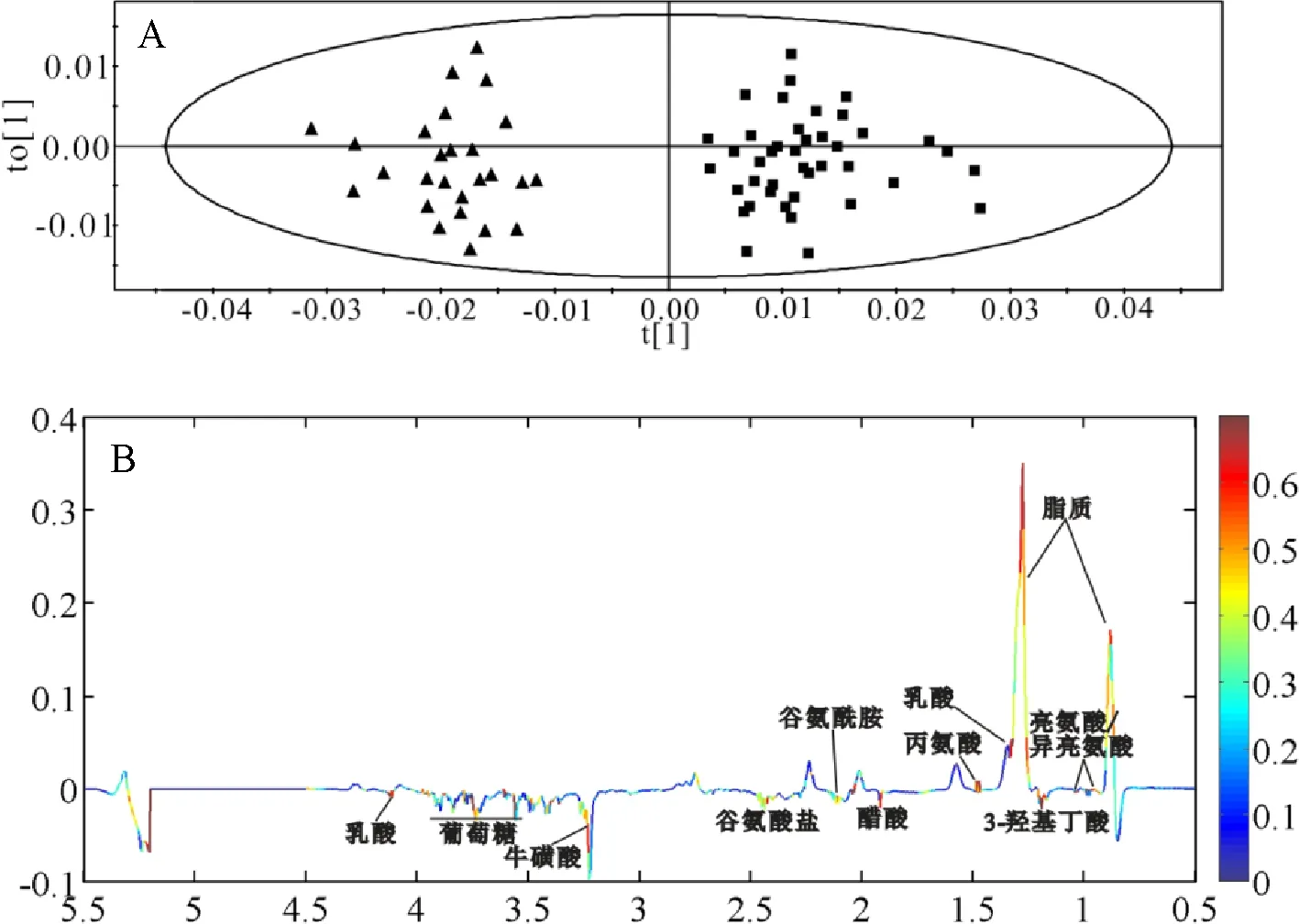
注:A:OPLS-DA模式识别分析,HER2表达阴性组(■),HER2表达阳性组(▲);B:负载图
2.4 代谢物积分值统计分析 统计结果显示脂质(主要是VLDL)、亮氨酸/异亮氨酸、乳酸、3-羟基丁酸、丙氨酸、醋酸、谷氨酸盐、牛磺酸在两组血清中有显著性差异。见表1。
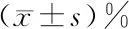
表1 差异代谢物积分值比较
3 讨论
代谢组学技术通过非靶向的研究可以全景式地观测到机体代谢轮廓的变化,而对小分子化合物进行定量靶向研究[14],能尽可能多地掌握机体内部代谢化合物的上调与下调,及其变化对疾病、基因及外界环境因子的影响[15]。本研究通过对新诊断乳腺浸润性导管癌患者的HER2表达情况进行分组,对比HER2阳性与阴性组之间血清代谢组的差异。通过模式识别及数据统计分析,可以发现乳腺浸润性导管癌HER2表达阳性患者血清中的亮氨酸/异亮氨酸、丙氨酸、醋酸、谷氨酰胺、谷氨酸盐、牛磺酸含量显著高于阴性组患者,而3-羟基丁酸、脂质(主要是VLDL)、乳酸含量显著降低,这表明HER2表达阳性组与阴性组在血清代谢组中存在明显的代谢差异,而这些差异代谢物也反映出两组在糖代谢、脂代谢以及氨基酸代谢上有着本质的不同。
葡萄糖代谢紊乱是肿瘤细胞生长增殖过程中的一个特有代谢特征[16],本研究中HER2阳性表达患者血清中的乳酸、葡萄糖含量均显示下降,说明葡萄糖代谢在两组患者体内有明显不同。Warburg[17]认为肿瘤细胞即使在氧气充足的情况下优先进行糖酵解产能,之前报道与乳腺纤维腺瘤相比,浸润性导管癌患者血清中的葡萄糖含量降低而乳酸含量增加[9],而本研究是对同是浸润性导管癌的HER2表达阴性与阳性患者血清的对比研究,与HER2表达阴性组相比,HER2表达阳性患者可能Warburg effect较弱,即糖酵解供能作用较弱。
脂质的最主要的生理功能是贮存和供给能量。VLDL的主要作用是将肝内合成的胆固醇运送到肝外,在肿瘤患者体内VLDL等与脂类转运相关的脂蛋白为了适应肿瘤高代谢的特征,其含量一般会增加[18],以增加脂肪的从头合成,从而满足肿瘤所需的高能需求。本研究HER2阳性患者血清中的VLDL降低可能是其脂肪的从头合成作用较弱。3-羟基丁酸作为脂代谢途径中酮体的一种,其利用的增加说明机体肝脏供能增多,另外酮体利用的增加也可减少糖的利用,节省蛋白质的消耗。本研究HER2阳性患者血清中的3-羟基丁酸减少说明其利用肝脏供能可能增加,而其葡萄糖仍然降低可能是因为其葡萄糖大部分进行有氧氧化供能,糖代谢作用明显于脂代谢。
本研究发现亮氨酸/异亮氨酸、丙氨酸、谷氨酰胺、谷氨酸盐等氨基酸在HER2阳性患者血清中含量升高,一方面可能是脂代谢中酮体利用的增加,另一方面可能是体内氨基酸代谢相关的酶活性减弱,使得氨基酸代谢供能减弱。牛磺酸是乳腺疾病研究中发现的一个新的代谢标志物[19],与乳腺纤维腺瘤患者相比,乳腺浸润性导管癌患者血清中牛磺酸含量显著下降[9]。牛磺酸既是一种抗氧化剂也是渗透压调节剂,其在HER2阳性患者血清中含量增加可能与体内氧化应激和渗透压调节有关。
综上所述,代谢组学方法能够通过NMR和模式识别分析给出乳腺浸润性导管癌患者HER2表达阳性与阴性组血清中的差异代谢物,这些差异代谢物或可作为代谢标志物为HER2表达的准确判读提供参考。但是由于目前临床标本收集数量相对较少,所用的分析技术平台尚不能涵盖机体内所有的代谢产物,而且所选个体间及个体内也会存在些许差异,均可能导致本文分析结果的不准确。因此我们将继续收集临床血清样本,加大样本量,以进一步寻找并且验证差异代谢物,从而验证代谢组学在辅助指导HER2准确判读的可行性。
利益相关声明:本文所有作者声明不存在利益冲突关系。
作者贡献说明:刘影是本研究的实验设计者和实验研究的执行人,完成模式识别分析及论文初稿的写作;阳宇负责本研究病例的病理诊断及入组选定;郑细闰参与免疫组化等常规病理技术的实验操作;刘红英负责本研究的数据统计分析;吴云山完成本研究所有NMR数据的检测;郑广娟负责入组病例的病理诊断并指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。

