大螟成虫性信息素生物合成和释放及求偶和交配行为的昼夜节律
郭前爽, 卓富彦, 朱景全, 陈庆华, 朱 凤, 黄德超, 杜永均,*
(1. 浙江大学农药与环境毒理研究所, 杭州 310058; 2. 全国农业技术推广服务中心, 北京 100125;3. 四川省农业科学院植物保护研究所, 农业部西南作物有害生物综合治理重点实验室, 成都 610066;4. 江苏省植物保护植物检疫站, 南京 210036; 5. 广东省农业有害生物预警防控中心, 广州 510500)
大螟Sesamiainferens(鳞翅目: 夜蛾科)幼虫是多食性害虫,寄主范围广,包括水稻、玉米、甘蔗、高粱、谷子、麦类、茭白、油菜、向日葵等农作物,以及其他禾本科和莎草科的杂草(金翠霞和吴亚, 1986)。大螟主要分布于我国34°N以南以及日本、韩国等地区(顾海南, 1985; 徐丽娜等, 2011)。近几年大螟在广东、浙江、江苏、四川等地发生危害程度上升较快,有些地区因为防控二化螟Chilosuppressalis而过度施用化学农药,导致大螟甚至比二化螟的发生还要严重,抗药性显著增强,难防治(黄诚华等, 2005),如浙江温岭县的大螟田间种群对稻丰散已经产生了一定的抗药性,局部地区大螟对多杀菌素敏感性明显下降(赵钧等, 2016)。大螟是非迁飞性害虫,因此,可以通过性信息素群集诱杀有效地控制越冬代或利用交配干扰技术减低基数(杜永均等, 2013);另一方面,则是可利用性诱监测确定下一代的发育进程,特别是下一代卵期和卵孵化盛期,从而可以准确计算施药或人工释放寄生蜂的时间范围。
鳞翅目昆虫的雌蛾在羽化后、性成熟时以一定的昼夜节律产生求偶行为,典型的表现为翅振、产卵器伸展等,性腺中合成的性信息素会释放至体外,并借助于气流扩散,引诱同种异性,从而完成交配。因此,求偶行为在昆虫繁殖中起关键作用。大螟羽化后当天就可以求偶、交配,而且交配的比例很高(Nagayamaetal., 2004)。大螟性信息素的主要成分为顺11-十六碳烯乙酸酯(Z11-16∶Ac)和顺11-十六碳烯醇(Z11-16∶OH)(Nesbittetal., 1976; Zhuetal., 1987; Nagayamaetal., 2006)。因此,对于这样没有迁飞习性的、本地虫源的害虫,利用性信息素群集诱杀或交配干扰是非常理想的。昆虫雌成虫的性信息素生物合成、释放,以及雄成虫的嗅觉反应、求偶和交配行为天生具有昼夜节律(Groot, 2014; Levi-Zada and Byers, 2021),对其机理的理解与性信息素的应用策略密切相关。水稻中除了大螟还有二化螟,甚至少数地区可能还有三化螟和台湾稻螟的危害,因此,对于作物生境中多靶标害虫,采用群集诱杀技术比较难操作,采用诱捕器的成本比较高,人工操作劳动力成本更高,而理想的方法是采用交配干扰技术。因为水稻秧苗比较细嫩,水稻中无法采用类似果园中的聚乙烯管或其他释放器,因此,我们开发了采用超剂量自动喷施信息素的方法实现交配干扰。昆虫的求偶和交配行为都有昼夜节律,在白天和夜晚的许多时间昆虫并没有求偶和交配行为,如聚乙烯(PE)塑料管一类、具基质的性信息素释放器24 h都在释放,因此,大部分时间内释放的性信息素化合物是浪费的。对于交配和求偶行为的昼夜节律的深入理解,有助于设计交配干扰技术及其田间应用方法,同时,也有助于分析诱蛾量与环境因子的关系,从而提高性诱测报的精准性。
1 材料与方法
1.1 供试昆虫
于2021年4月从宁波市东吴镇水稻田割取稻桩,带回实验室后,放置到养虫笼中,室温下饲养,待其羽化后,当日雌雄分开放置在直径28 cm、高32 cm的折叠养虫笼中,并喂食10%葡萄糖水。
1.2 大螟交配行为观察
将当晚新羽化的大螟按雌雄1∶1的数量配对,放置在500 mL的塑料杯中,用红光灯每隔20 min观察1次,并记录雌雄蛾交尾开始时间,结束时间,共观察到20对交配。
产卵器伸展行为观察:将18头未交配的雌蛾单独放置在500 mL容积的广口塑料瓶中,每隔20 min观察一次,记录开始时间及结束时间,观察时采用红光照明。
1.3 性信息素的提取、鉴定及其合成和释放昼夜节律的测定
每隔2 h提取单头、未交配雌性大螟的性信息素,采用溶剂浸提和固相微萃取(solid phase microextration, SPME) 2种方法。溶剂浸提法:轻轻挤压雌蛾腹部,使性腺暴露出来,用清洗烘干的眼科剪剪下,用滤纸吸去水分后,放置在玻璃色谱瓶中,加入50 μL色谱级正己烷,浸提1 h后,将正己烷吸出,采用微氮气流浓缩提取液备用。SPME法:性信息素释放的昼夜节律使用2日龄、未交配的雌蛾。SPME法参照文献(Hughes and Cardé, 2020),采用SPME直接吸附性信息素腺体外表的分泌物。SPME吸附纤维为(polydimethylsiloxane/divinyl benzene, PDMS/DVB; 膜厚=100 μm; Supelco Inc., Bellefonte, PA)。每个时段,测试、提取6个雌蛾的性信息素。
气质联用仪采用安捷伦6890GC-5975MS并配有DB-FastFAME毛细管柱(60 m×0.25 mm×0.25 μm)。程序升温: 60℃停留1 min,然后每分钟升温10℃至180℃,之后每分钟升温3℃ 至210℃,再每分钟升温10℃ 至250℃维持10 min。离子源温度为230℃,能压70 eV载气为氦气。 称取Z11-16∶Ac,用正己烷稀释成50, 100, 200, 500和1 000 ng/μL 的标准溶液,进样1 μL测定不同浓度的对应峰面积。制做性信息素化合物的剂量和峰面积曲线得到相应的函数,由此计算单个性信息素化合物的滴度。
1.4 田间诱蛾昼夜节律记录方法
采用宁波纽康生物技术有限公司生产的新型害虫自动监测工具“赛扑星”昆虫性诱电子智能测报系统(SPT-F-02)监测每日、每小时田间诱蛾动态。该系统利用性诱的专一性,结合电子通讯技术,田间实时自动、准确计数,无线传输至云端数据库。性诱智能测报系统每隔1 h发送1次数据。赛扑星性诱智能测报系统同时记录了当日每小时诱捕器周围的温度和湿度。监测系统设置于四川省绵阳市三台县(31.38°N, 104.91°E)、四川省泸州市叙永县(28.20°N, 105.47°E)、广东省惠州市博罗县(23.22°N, 114.04°E)、浙江省诸暨市(29.83°N, 120.39°E)、浙江省长兴县(31.00°N, 120.01°E)、浙江省吴兴区(30.67°N, 120.03°E)和江苏省姜堰区(32.53°N, 120.22°E) 7个县的水稻种植区。
1.5 数据分析
试验所得数据结果采用SPSS 17.0软件进行分析。多组比较采用 单因素方差分析(one-way ANOVA)法,显著性分析采用LSD法,两组平均数间显著性差异比较采用Student 氏t检验法。利用Pearson相关系数进行相关性分析,相关性分析的显著性用双尾t检验分析。回归分析采用线性回归法。显著性分析时P>0.05 表示差异不显著,P<0.05表示差异显著。
2 结果
2.1 大螟性信息素合成和释放的昼夜节律
经计算得到Z11-16∶AC的含量(C)与峰面积(A)的标准曲线C=1×10-6A,R2=0.997。大螟性信息素的生物合成和释放有一定的时间差异,采用溶剂浸提的方法提取单个大螟雌蛾的性信息素时(图1: A),始于暗期前1 h就可检测到性信息素化合物,然后在暗期开始后4 h性信息素含量逐渐增加,至暗期8 h,达到一个高峰,Z11-16∶Ac滴度达到平均单雌60.5±25.6 ng,Z11-16∶OH滴度为12.4±1.9 ng。之后性信息素化合物的含量略降低,但在光期后1 h,又可以检测到性信息素化合物的一个高峰,光期5 h还可以被显著检测到,Z11-16∶Ac滴度还达到平均单雌96.9±20.9 ng,Z11-16∶OH滴度为26.7±6.6 ng(图2: A)。整个暗期Z11-16∶Ac和Z11-16∶OH的比例平均为2.8±1.9,而光期Z11-16∶Ac和Z11-16∶OH的比例平均为2.5±0.9,统计上没有显著差异(P=0.770)。
同时,SPME吸附大螟分泌至腺体外的性信息素化合物(图1: B),分析结果显示,在暗期之前未能检测到性信息素化合物,到了暗期后的6 h才检测到性信息素化合物,然后,逐渐增加,到暗期后10 h达到最高峰,Z11-16∶Ac平均单雌含量30.4±9.5 ng,Z11-16∶OH则为3.2±1.0 ng。但光期后1 h,依然保持较高的量,Z11-16∶Ac平均单雌含量为28.9±10.9 ng,Z11-16∶OH的则为4.5±1.4 ng。Z11-16∶Ac/Z11-16∶OH比例显著降低(P<0.05)。光期后3-5 h也能检测到,但非常微量(图2: B)。整个暗期Z11-16∶Ac和Z11-16∶OH的比例平均为8.5±1.2,而光期Z11-16∶Ac和Z11-16∶OH的比例平均为5.7±0.6,统计上差异显著(P=0.02),同时也远高于浸提法中的比例(图2)。显然浸提代表的是腺体中的总性信息素化合物含量,体外吸附表示的是已经分泌出腺体外的量,不仅两者在量和时间上有差异,而且Z11-16∶Ac和Z11-16∶OH的比例差异也很大。

图1 大螟雌蛾性信息素化合物的气质联用离子流图Fig. 1 Ion chromatogram of sex pheromone compoundsof female moths of Sesamia inferens by GC-MSA: 溶剂浸提Solvent extract; B: SPME吸附SPME adsorption.
2.2 大螟产卵器伸展行为的昼夜节律
雌蛾在进入求偶发情期后静止不动,尾部略微抬起,将产卵器伸出体外,性腺外翻,性腺外翻的时间发生在暗期后的6-8 h (图3)。这个时间段与性信息素释放至腺体体表外的时间一致(图2: B)。

图2 大螟雌蛾性信息素合成和释放的昼夜节律Fig. 2 Circadian rhythm of the synthesis and release ofsex pheromone of female moths of Sesamia inferensA: 溶剂浸提Solvent extract; B: SPME吸附SPME adsorption. L: 光照期Photophase; D: 暗期Scotophase.下同The same below. 图中数据为平均值±标准误;柱上不同小写和大写字母分别表示Z11-16∶Ac和Z11-16∶OH滴度差异显著(P<0.05, LSD法)。Data in the figure are mean±SE. Different lowercase and capital letters above bars indicate significant difference (P<0.05) in the Z11-16∶Ac and Z11-16∶OH titers, respectively, by LSD method.
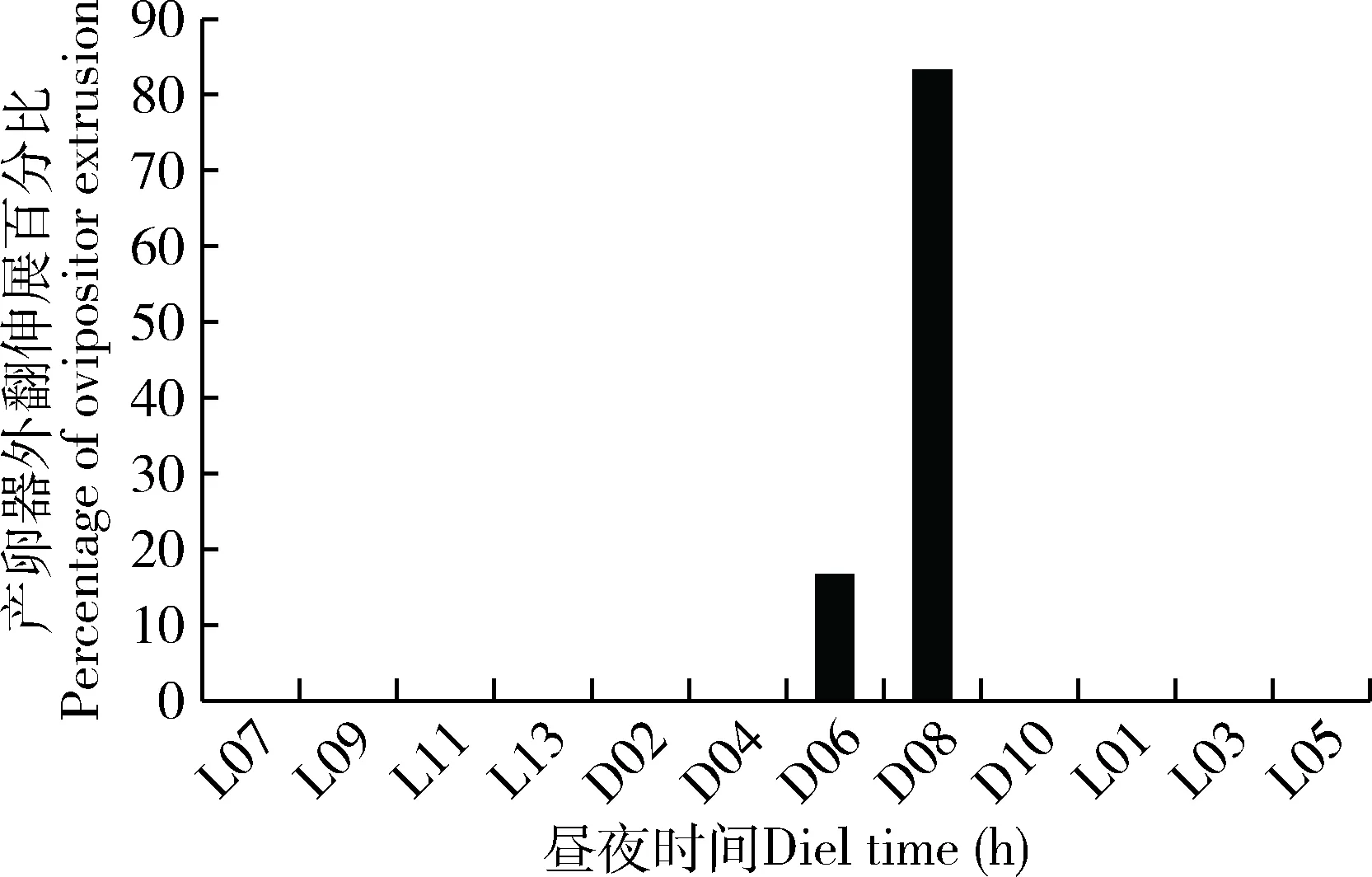
图3 大螟雌蛾产卵器外翻伸展行为的昼夜节律Fig. 3 Circadian rhythm of the extrusion behavior ofthe ovipositor of female moths of Sesamia inferens
2.3 大螟交配的昼夜节律
大螟雌雄蛾在光期未发现有交配现象,交配时间主要集中在暗期后的4-8 h内,但暗期后的8-10 h时间段只有不足5%(图4: A)。大螟雌蛾的交配平均持续时间为83.4±5.0 min(图4: B)。
未交配过的雌蛾产卵器伸出的平均持续时间为80.8±4.4 min(图4: B)。从中可以发现,大螟交配的起始时间早于性信息素释放至腺体体表外的时间1~2 h,但与性信息素在腺体内的快速合成时间(溶剂浸提的性信息素滴度变化)相吻合(图2: A, B)。
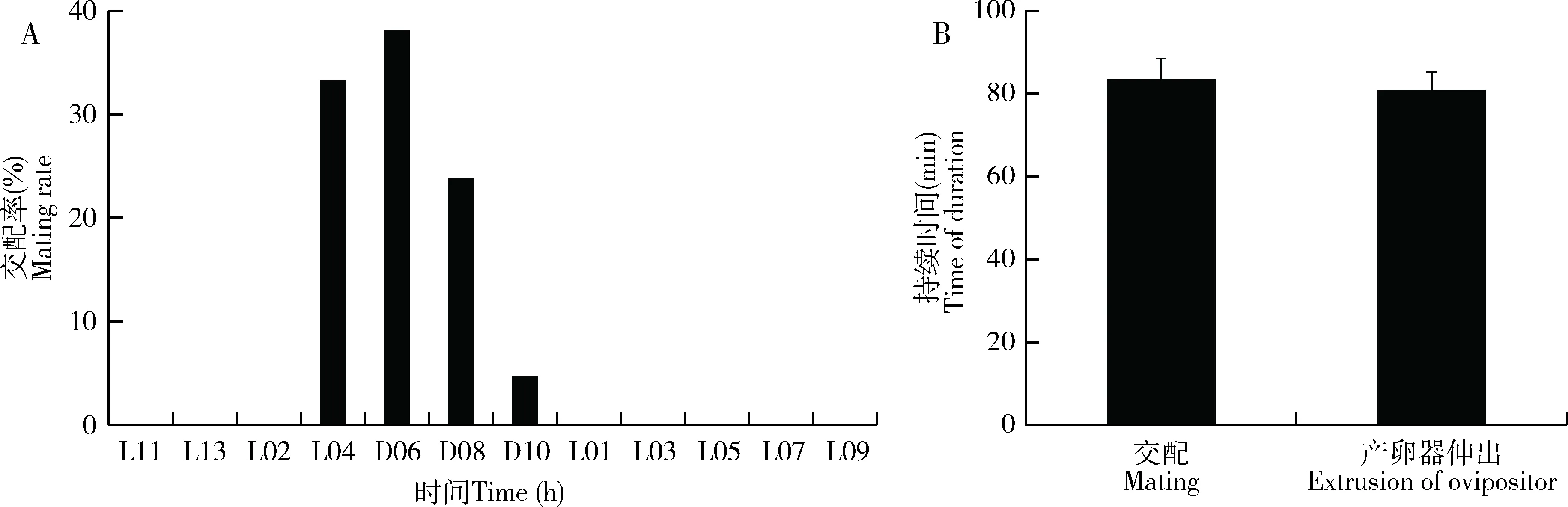
图4 大螟交配行为的昼夜节律以及交配率(A)和产卵器伸展行为的持续时间(B)Fig. 4 Circadian rhythm of mating behavior and the mating rate (A) and the durationof ovipositor extrusion behaviors (B) of Sesamia inferens
2.4 田间大螟雄蛾被性信息素诱捕的昼夜节律
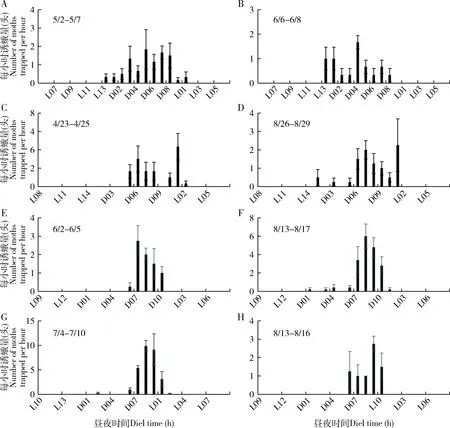
由于各地作物布局的差异,大螟又是多食性的,因此,监测系统诱捕到的雄蛾的动态在不同地点之间有较大的差异。四川省三台县测报点的大螟诱蛾量在3月下旬开始至6月上旬的越冬代较高,有明显的诱蛾高峰期,但之后到9月中旬之前,虽有一定诱蛾量,但没有明显的世代峰期(图5: A);越冬代诱蛾呈现明显的昼夜节律,从暗期2 h开始,至光期1 h, 高峰在暗期7 h(图6: A)。6月至9月诱蛾发生在黑暗后的2-10 h内,但诱蛾峰形不明显。 四川叙永县则有2个大螟的诱蛾高峰,越冬代的诱蛾昼夜节律与三台接近,但8月份诱蛾昼夜节律时间更分散(图6: C)。江苏省泰州市姜堰的2个测报点(图5: B),虽然日诱蛾高峰期不一样,但诱蛾的昼夜节律基本一致,都在暗期的6-10 h之间(图6: E, F, G, H)。越冬代蛾量不大,但第1代和2代诱蛾量较大。浙江省湖州长兴县的诱蛾高峰就在越冬代,之后诱蛾量很低(图5: C)。诱蛾的昼夜节律在暗期的6-10 h之间(图6: I, J)。6月中下旬的第一代则比较分散,从暗期1 h开始,至光期1 h,高峰在暗期9 h。浙江省绍兴市诸暨测报点(图5: C),3个世代比较清晰,越冬代的诱蛾昼夜节律在黑暗后的1 h开始,至光期1 h,高峰在暗期7 h(图6: K)。第1代的诱蛾昼夜节律在黑暗后的7 h开始,至光期1 h,高峰在暗期9 h。第2代的诱蛾昼夜节律也始于黑暗后的7 h,高峰在暗期的10 h和光期的1 h。广东省惠州市博罗县5月份的第1代大螟则比较分散(图5: D),从暗期1 h开始,至光期1 h。但6月中下旬的一代昼夜节律的时间比较集中,始于黑暗后的1 h,高峰在暗期的6 h,光期的1 h结束(图6: N, O)。
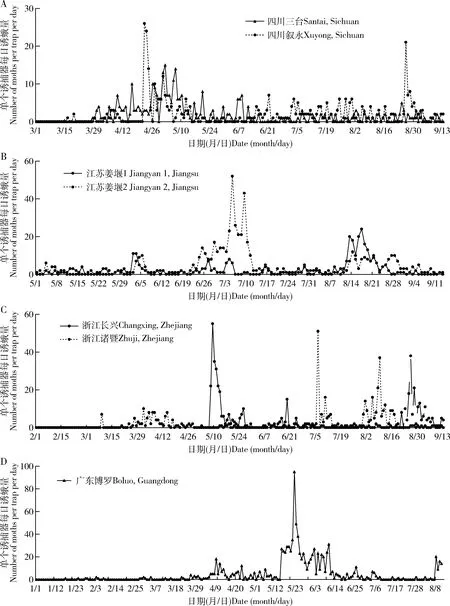
图5 大螟性诱监测点的日诱捕蛾量动态变化Fig. 5 Daily number of moths caught per trap in the field at the pheromone monitoring sites
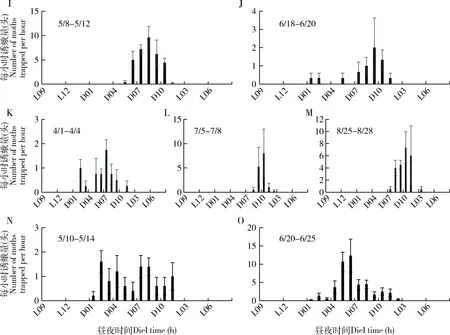
图6 大螟性诱监测点诱捕蛾量的昼夜节律Fig. 6 Circadian rhythms of hourly moth catches per trap in the field at the pheromone monitoring sitesA, B: 四川三台Santai, Sichuan; C, D: 四川叙永Xuyong, Sichuan; E, F: 江苏姜堰1 Jiangyan 1, Jiangsu; G, H: 江苏姜堰2 Jiangyan 2, Jiangsu; I, J: 浙江长兴Changxing, Zhejiang; K, L, M: 浙江诸暨Zhuji, Zhejiang; N, O: 广东博罗Boluo, Guangdong.
这些不同地点和世代的大螟诱蛾结果显示,其昼夜节律受地理位置、世代和环境因子的影响显著。从这些点的数据可以看出雄蛾在暗期的活动时间范围远长于雌蛾在暗期释放性信息素的时间,在光期没有诱捕到雄蛾。
3 讨论
虽然环境中的温度、湿度也可以作为环境钟,但这些因子容易受到各种植物背景、气候等环境因子的影响,因此,温湿度并不像白天黑夜的光强度有稳定的节律变化。日出性和夜出性昆虫行为都具有天生的昼夜节律(Groot, 2014),甚至贮粮害虫也是如此(Závodskáetal., 2012)。通常我们的认识是昆虫在性成熟时先释放性信息素到自然环境之中,同种异性成虫的嗅觉系统捕获气味分子,产生神经信号及其脑部中枢神经系统的加工处理,对气味源作出定向飞行行为。因此,不仅雌成虫释放信息素有昼夜节律,相对应的同种异性个体的嗅觉行为反应、求偶和交配行为也具有昼夜节律。求偶行为的时间差,即昼夜节律差异,也可成为同生境昆虫性信息素近缘种的生殖隔离策略之一(Mazor and Dunkelblum, 2005)。
性信息素的生物合成位置发生在性信息素腺体中,合成产物释放进入细胞膜或表皮层(Foster and Anderson, 2019; Levi-Zada and Byers, 2021)。在烟芽夜蛾Chlorideavirescens中,醛是由类似的醇通过细胞膜或腺体角质层中的氧化酶产生的,醛和醇两种类型的化合物在腺体的不同部位产生、储存:细胞中的醇和角质层中的醛,表面和外角质层含有大量醛和少量醇,内部则是醇含量较高 (Foster and Anderson, 2019)。大螟的主成分是Z11-16∶Ac和Z11-16∶OH(图1),以及微量的顺11-十六碳烯醛(Z11-16∶Ald)。本文为了区分性信息素分泌和释放前、后的差异,采用溶剂浸提法和SPME吸附法,前者代表的是总的性信息素滴度,而后者则是分泌出腺体外、表皮上的性信息素量。 性信息素腺体中先合成Z11-16∶OH,之后才通过乙酰化合成Z11-16∶Ac,而通过氧化酶则合成Z11-16∶Ald。合成性信息素化合物的各种合成酶的基因表达水平具有昼夜节律的变化,如黄地老虎Agrotissegetum(Závodskáetal., 2009)、甜菜夜蛾Spodopteraexigua(Chengetal., 2010)和二化螟(Guoetal., 2020)中,因此,性信息素化合物滴度的昼夜节律是一个普遍的现象(Blochetal., 2013; Liuetal., 2013)。从我们的结果来看,大螟性信息素的生物合成时间较早,合成量快速启动的时间与交配的时间接近,即暗期4 h。然而,性信息素分泌和释放的时间则显著晚于雌雄配对交配的时间,大致有2 h的时间差。不仅如此,分泌出体外的Z11-16∶Ac和Z11-16∶OH的比例在暗期和光期有显著差异,这种配比差异可能影响对雄蛾的引诱作用。在我们的试验中,在室内配对大螟交配时间比性信息素释放至体外的时间要早,这可能是因为人工配对,不需要像在田间,需要通过性信息素的扩散引诱异性个体来求偶。但从数据分析,交配和性信息素释放的昼夜节律似乎表面上看两者是独立的。大螟产卵器伸出的时间在暗期6-8 h,持续时间可达1个多小时。由此推断,性信息素合成后分泌至细胞膜或表皮是主动的释放,但从表皮进入体外空气中则是被动的、自然挥发,因此,大螟产卵器伸出的一部分原因可能是为了更快、更大量地释放性信息素,由此提高了性信息素的扩散范围,增大了吸引雄蛾的机会。
雄蛾对性信息素的嗅觉反应也表现明显的昼夜节律,不仅体现在嗅觉受体基因(Zhengetal., 2014)和气味结合蛋白基因(Konstantopoulouetal., 2006)的表达水平,在行为上也是一样(Kawazuetal., 2010),这种行为差异并不是在周缘神经系统水平上控制,而是在中枢神经系统(Rosénetal., 2003),章鱼胺可能参与其中的信号识别的神经通路过程(Linnetal., 1996; Linnetal., 1992)。从性诱自动智能测报系统的数据可以得到大螟雄蛾诱捕的昼夜节律(图6),相较于雌蛾性信息素的释放和交配的时间范围,显然雄蛾对性信息素反应的时间范围比较宽,可以从最早暗期1 h至光期1 h,高峰期在暗期6-10 h,但同时表明受世代、气候和地理位置差异的显著影响。类似金银花尺蠖Heterolochajinyinhuaphaga,其求偶和交配昼夜节律与温度、相对湿度和光周期相关,随着蛾子日龄的增长,求偶和交配的平均开始时间提前,25℃是最适合求偶和交配的温度,而温度高于或低于25℃,总求偶和总交配的百分比下降,求偶开始时间延迟,交配持续时间减少,增加相对湿度有利于求偶和交配(Xiangetal., 2018)。虫龄也影响昆虫的求偶、交配节律(Wangetal., 2015)。光周期也是一个重要的影响因子(Linnetal., 1992, 1996),延长的光周期抑制了求偶和交配(Xiangetal., 2018)。寄主的差异不仅影响性信息素的组成差异(Grootetal., 2008),也影响了雄蛾对性信息素反应的昼夜节律,玉米型草地贪夜蛾Spodopterafrugiperda的求偶和交配时间比水稻型的变异大(Schöfletal., 2009)。田间诱蛾的昼夜节律是这些因子的综合体现。
大螟成虫不需要补充营养(金翠霞和吴亚, 1986),羽化后当日即可以交配。虽然雌蛾在光期的起始时间还有少量性信息素的合成和释放,但雄蛾并没有反应。相对于雄蛾对性信息素的反应时间,大螟雌蛾在暗期释放性信息素的时间范围比较短,而人工合成的性信息素诱芯在田间是24 h释放,并在田间随气流扩散,因此,在与自然雌蛾的竞争上具有很大的优势。从本研究数据可见,大螟的交配时间早于性信息素的释放时间(图2-4),因此,在虫口高密度的环境下,一些雌雄蛾可能不需要性信息素的帮助就可以实现其交配。也就是说,在虫口密度高的情况下,性信息素群集诱杀的效果可能会下降。越冬代诱蛾量时间比较集中,而之后的世代则比较分散,因此,性诱群集诱杀越冬代效果比较理想。在我国水稻、玉米、高粱或甘蔗种植区的许多地方有多种害虫同时发生,如水稻中的二化螟和大螟,玉米和高粱中大螟和条螟Chilosacchariphagus、亚洲玉米螟Ostriniafurnacalis等,甘蔗中大螟、二点螟Chiloinfuscatellus、条螟等,利用群集诱杀技术的诱捕器成本比较高,因此,理想的信息素技术应该是交配干扰技术。理解大螟的昼夜节律,可以减少合成性信息素化合物释放的时间,即设置起始喷施性信息素化合物的时间在交配开始时间之前2-3 h,雄蛾诱捕时间结束后则可以关闭释放性信息素,由此可以节省性信息素的用量,降低防控成本,提高防治效果。
- 昆虫学报的其它文章
- Morphological differentiation in the Asian honey bees (Apis cerana) in China
- 我国余甘子新害虫锡兰玻壳蚧的形态及生物学特性
- 贝氏小奥林螨连续饲养的草栖钝绥螨生命表参数和捕食能力
- 施药后不同时间玉米田中常用农药残留对玉米螟赤眼蜂的影响
- Inhibition of glucose oxidase gene decreases the resistance of Mythimna separata (Lepidoptera: Noctuidae) larvae to Bacillus thuringiensis infection
- 枣食芽象甲化学感受蛋白PyasCSP4的基因克隆、表达及配体结合特征

