氮磷水平对细基江蓠氮、磷吸收及生长的影响*
付家想,潘 科,黄凌风,蓝文陆,黎明民,李天深
(1.广西科学院广西红树林研究中心,广西红树林保护与利用重点实验室,广西北海 536007;2.广西壮族自治区海洋环境监测中心站,广西北海 536000;3.深圳大学高等研究院,广东深圳 518000;4.厦门大学环境与生态学院,福建厦门 361102)
近年来,人类生产、生活,尤其是近海养殖活动过量投饵给水环境带来空前压力,水体富营养化、生态环境恶化已成为一大环境难题[1],其主要原因是氮(N)、磷(P)含量的急剧增加。利用生物滤器大型藻类修复水质成为解决问题的关键,大型海藻不仅能从周围环境中大量吸收N、P营养元素[1-3]及重金属元素,还能提高水体溶解氧水平,调节水体pH值,从而改善水生生境。N、P是初级生产者生长的营养基础[2],在营养盐贫乏水域,加富N、P会显著促进藻体对其吸收,然而N、P对藻类生长的影响较复杂,与藻类生长的环境因子、氮源和磷源种类、生长速率、碳代谢、底物酶活性和N/P等因素有关[3-5]。对限制性营养要素的吸收能力是藻类大量繁殖的关键,适宜的N/P有利于浮游植物的生长繁殖,反之会造成营养结构失调、种群结构改变,甚至引发藻华灾害。大量研究证实,黄海绿潮灾害频发与海水中营养盐过量密切相关[6,7]。自20世纪60年代国外学者首次提出Redfield比[8](即维系海洋藻类正常生长所需的适宜N/P为16/1)后,关于N、P限制对大型藻类生长影响的研究[9-16]已有不少。研究发现,N、P差异显著会影响大型海藻江蓠属(Gracilaria)的生长状况和生理特征,例如,钱鲁闽等[13]明确了不同形态的N、N/P会影响菊花江蓠(Gracilarialichenoides)对P的吸收,当N/P为10/1时吸收速率最佳;杨芳[14]发现位于东兴、北海和深圳湾3个海区的细基江蓠(G.tenuistipitata)繁枝变型对不同形态N的富集能力存在差异,当N浓度为20 μmol·L-1时,藻体硝酸还原酶(Nitrate Reductase,NR)、超氧化物歧化酶(Superoxide Dismutase,SOD)活性最高;许忠能等[15]发现细基江蓠繁枝变种吸收的N/P随环境N/P的不同而变化,当N浓度一定时环境N/P对细基江蓠繁枝变种吸收N的速率无显著影响;李恒等[16]研究发现,当N浓度为50 μmol·L-1时,真江蓠(G.asiatica)和脆江蓠(G.chouae)对氮的平均吸收速率最大,且脆江蓠对硝酸盐和磷酸盐有更好的去除效果。
目前N、P对大型海藻江蓠属的胁迫研究仅见菊花江蓠、细基江蓠繁枝变型、脆江蓠[15]、真江蓠[16]等,对细基江蓠的研究主要集中在繁育、生物学特性以及与其他藻类相生相克效应[17]方面,有关细基江蓠在不同N、P水平下的植物营养生理生态研究尚缺乏。本研究以Redfield比[18]为理论依据,研究在不同N、P营养条件下细基江蓠对营养盐的吸收特性及对自身生长的影响,以期为利用大型海藻吸收N、P,降低水体富营养水平,改善近岸海域水环境质量提供科学依据。
1 材料与方法
1.1 藻种
细基江蓠(G.tenuistipitata)的采集与保存:实验所用细基江蓠采自广西北海市金海湾潮间带。选择生长状态良好、长势相近的藻体,并用海水冲洗除去杂藻、污泥及其他附着生物,室内暂养。
暂养条件:每1 L海水添加10 mL f/2培养液,海水为经高温(121℃,20 min)消毒且过0.45 μm醋酸纤维滤膜的自然海水(pH值为8.1,盐度为28.3),暂养温度(20±1)℃,光照强度3 000-4 000 lx,光照周期14L∶10D。暂养期间每3 d更换一次海水且24 h充气,以保证营养盐混合均匀并使藻体保持悬浮状态,暂养时间为1周。
实验用细基江蓠的准备:取长势良好的细基江蓠接种至未加N源、P源的f/2营养液中饥饿培养48 h,其他培养条件同上。
1.2 N、P浓度设置
不同N/P实验:设置无机氮(NaNO3∶NH4Cl=1∶1,C∶C)浓度分别为0 μmol·L-1(N0)、40 μmol·L-1(N40)、160 μmol·L-1(N160)、320 μmol·L-1(N320)4个处理组,各处理组无机磷(NaH2PO4)浓度均为10 μmol·L-1,每个处理组各设置3个重复,共12组。其余营养元素按照f/2培养基的比例添加。
不同N、P浓度实验:固定Redfield比N/P=16/1,设置5组不同N、P浓度,各处理组设置3个平行,共15组。N源、P源和其他营养盐元素与不同N/P实验设置相同。具体的N、P浓度设置见表1。

表1 不同N、P浓度条件下N、P浓度设置Table 1 Setting of N and P concentrations under different N and P concentrations
1.3 实验管理
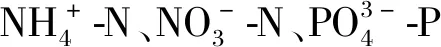
1.4 测定方法
细基江蓠对营养盐的吸收速率v计算公式[14]如下:
(1)
式中:v为营养盐的吸收速率(μmolg-1h-1),Ct-1、Vt-1为每次取样时间间隔的起始培养液中营养盐的浓度和体积,Ct、Vt为每次取样时间间隔结束时培养液中营养盐的浓度和体积,t为培养时间(h),W为藻体湿重(g)。
细基江蓠对营养盐的去除率r计算公式如下:
式中:r为营养盐的去除率,C0、V0为实验开始前培养液中营养盐的浓度和体积,Ct、Vt为每次取样时培养液中营养盐的浓度和体积。
称量前先用纸巾吸去藻体表面的水分,再用精确度为0.001 g的电子分析天平称量藻体湿重。藻体相对生长速率 (Relative Growth Rate,RGR,以湿重计,%d-1)计算公式[15]如下:
(2)
式中:W0是藻体初始湿重,Wt是t时刻藻体湿重。
静态培养下的大型海藻对营养盐的吸收过程可以用一级动力学方程来描述[12],公式[19]如下:
(3)
式中:S0为初始N、P浓度(mg·L-1),Se为t时刻N、P浓度(mg·L-1),t为时间(d),k为N、P去除率常数。
1.5 数据处理
实验数据为3个平行样的平均值,用Origin 9.0软件处理拟合,用SPSS 19.0进行数据统计分析、差异性检验,用one-way ANOVA及Duncan多重比较检验组间差异(以P<0.05为差异显著性标准)。
2 结果与分析
2.1 不同N、P组合处理对细基江蓠生长的影响
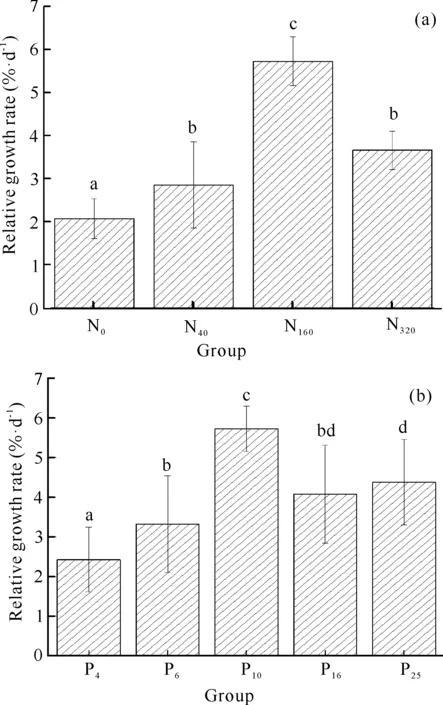
图1和图2展示了不同N、P组合条件下细基江蓠的生长情况,不同N、P组合的细基江蓠湿重及其相对生长速率具有明显差异。细基江蓠在各处理组的生长趋势基本一致,藻体湿重在整个实验阶段随着实验时间延长而增加(图1)。由图1(a)可知,在不同N/P下N160组(N初始浓度为160 μmol·L-1)藻体湿重增量比最大,达48.3%,显著高于其他3个实验组(P<0.01);N0组(N初始浓度为0)藻体湿重增幅最小,仅为12.7%。由图2(a)可知,不同N/P条件下各处理组间的藻体平均相对生长速率大小依次为N160>N320>N40>N0,N40组与N320组无显著差异(P>0.05),其他组各组间差异显著(P<0.05)。

图1 不同N、P水平下细基江篱藻体湿重随时间的变化Fig.1 Variation of wet weight of G.tenuistipitata with time under different N and P levels
由图1(b)可知,在不同N、P浓度条件下,P10组藻体增重比最高,达50.8%;P6组藻体增重比最低,为25.7%;P4组、P6组、P25组间差异不显著,P16组在培养的整个阶段,藻体湿重增长率持续增加。由图2(b)可知,不同N、P浓度条件下各组藻体相对生长速率表现为P10>P25>P16>P6>P4,P6组与P16组、P16组与P25组无显著性差异(P>0.05) ,其他组各组间差异显著(P<0.05)。
Different letters indicate significant differences between groups (P<0.05)
2.2 细基江蓠对的去除


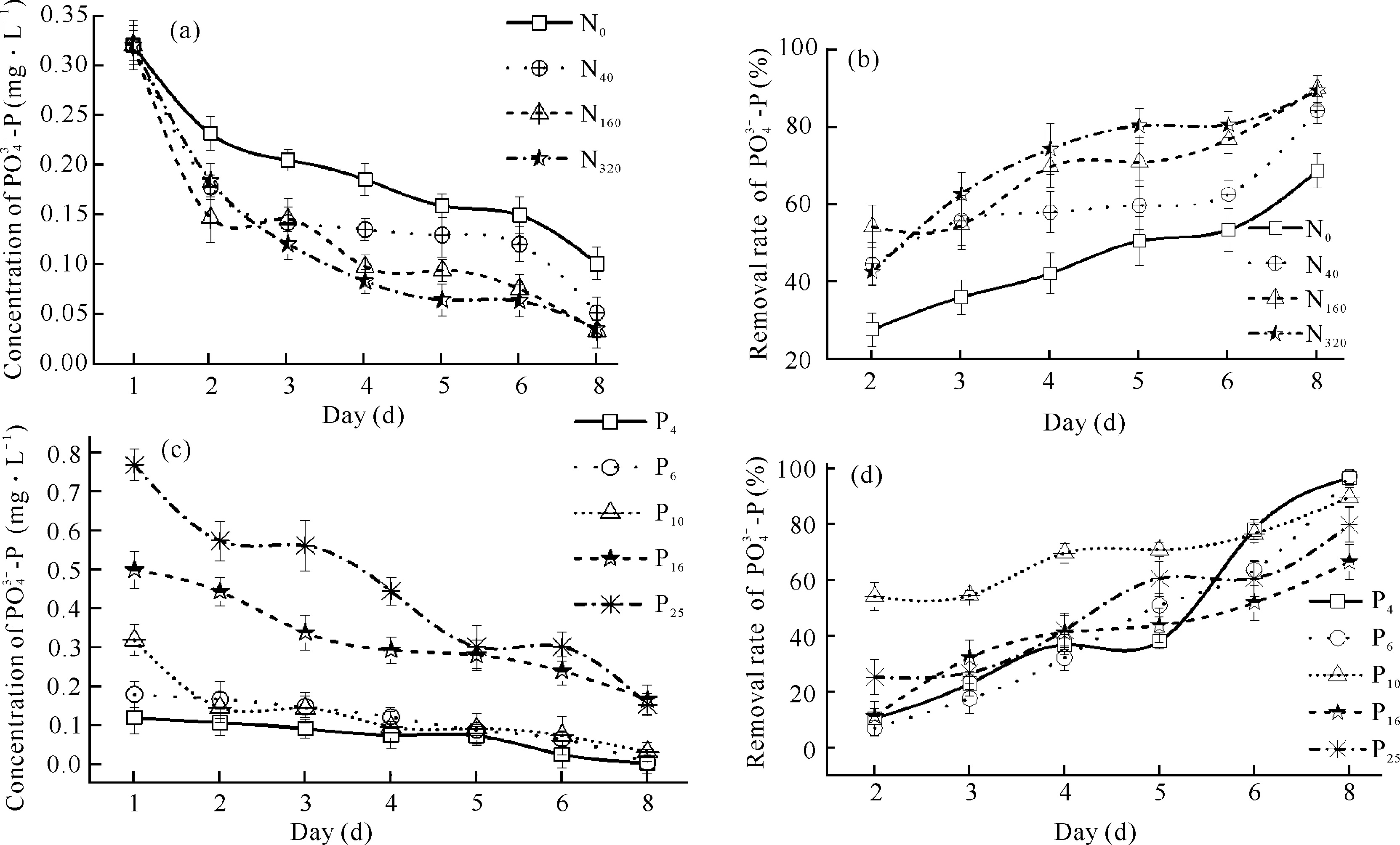
图3 不同N、P水平下浓度、去除率随时间的变化Fig.3 Variation of concentration and removal rate with time under different levels of N and P

表2 在不同初始P浓度下细基江蓠去除P的一级动力学拟合结果Table 2 The first-order kinetic fitting results of P removal by G.tenuistipitata under different initial P concentrations
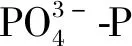
图4 不同初始水平下细基江蓠N、P吸收速率Fig.4 Uptake rates of G.tenuistipitata under different initial levels
2.3 细基江蓠对的去除
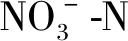
图5 不同N、P水平下浓度、去除率随时间的变化Fig.5 Variation of concentration and removal rate with time under different N and P levels
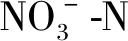
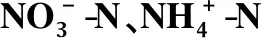
表4 在不同初始浓度下细基江蓠去除N的一级动力学拟合结果
2.4 细基江蓠对的去除
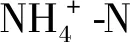
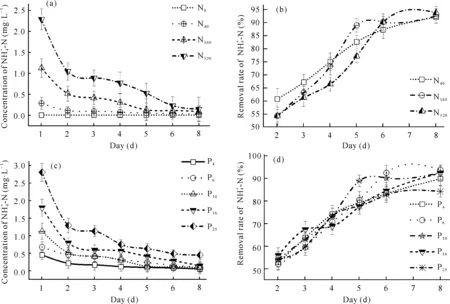
图6 不同N、P水平下浓度、去除率随时间的变化Fig.6 Variation of concentration and removal rate with time under different initial N and P levels
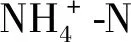
3 讨论
3.1 N、P环境对细基江蓠生长的影响
本研究结果表明,在不同的营养盐水平下细基江蓠都能够较好地生长和吸收N、P。在经过2 d饥饿处理后长达8 d的实验过程中,即使在氮缺乏的N0组,细基江蓠仍保持生长,生长率达到2%d-1。这可能是细基江蓠在获得性外源P的刺激下启动液泡等营养储备库中的N源补充藻体生长对N的需求。如邹定辉等[20]研究发现藻细胞可以大量吸收并将其存储在液泡或胞质内,使细胞内氮营养盐水平浓缩105倍以上。李枫[11]研究发现低氮高磷可促进龙须菜(Asparagusschoberioides)的生长,并且与低氮低磷相比,低氮高磷处理提高了龙须菜的光化学效率,这表明海藻有适应氮限制的内在机制。本实验结果表明细基江蓠存在营养盐储存机制,并具有较强的储备营养素能力,因此能够在外源性N、P缺乏时利用储备库中的营养盐存活并保持一定的生长率。
本研究结果还显示,在不同N/P下,N160组(N/P为16/1)细基江蓠生长率最高,藻体湿重增幅达48.3%,显著高于其他3个实验组(P<0.01),N/P也与Redfield比值(16/1)[18]一致。对多种藻类的研究[21,22]表明,不同N/P对藻类的生长影响显著,N/P差异会对藻细胞的生长、胞内物质的合成与积累产生较大影响。对藻类的营养生理研究发现,适应于富营养化水质的硅藻等在Redfield比值附近生长状态最佳,在介质营养盐充足情况下,中肋骨条藻(Skeletonemacostatum)和威氏海链藻(Thalassiosiraweissflogii)所需的N/P组成接近16/1,而蓝藻、甲藻等适于寡营养环境的微藻更能适应N/P偏离Redfield比值的环境[23],米氏凯伦藻(Kareniamikimotoi)在N/P为80/1的条件下比生长速率最大[24],可见N/P对不同种类海藻的影响还与他们对营养环境长期适应密切相关。细基江蓠主要生长在富含N、P冲淡水汇入的河口等近岸海区,本研究所用的细基江蓠也是采集于富营养化的潮间带海区,能适应富营养的环境,研究结果表明N/P对细基江蓠生长有显著影响,适应富营养环境的细基江蓠倾向于按Redfield比将所吸收N、P用于自身组织生长,偏离Redfield比则对细基江蓠的生长有明显的抑制效应。
3.2 N、P环境对细基江蓠吸收N、P的影响
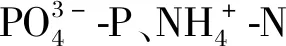

3.3 细基江蓠去除N、P的能力
N、P营养盐是海水集约化养殖系统中造成水体富营养化、危害养殖对象的主要因子,目前利用大型海藻去除养殖废水中N、P已成为国内外的研究热点,学者们一致认为利用大型海藻进行水质修复是净化水体、延缓水体富营养化的重要措施之一[29-31]。在江蓠属的相关报道中,在25℃条件下菊花江蓠特定生长速率为2.3%d-1-3.02%d-1[32],25℃时脆江蓠相对生长速率约为2.6%d-1[15];但金玉林等[33]发现26℃时脆江蓠相对生长速率在5%以上。分析本研究中细基江蓠的生长数据得知,细基江蓠吸收的营养盐主要用于生长,特定生长率为(5.74±0.42)%d-1,高于同类报道中的数值。本研究结果显示,在最佳N/P下细基江蓠在培养后期(第8天)对培养液中的去除率均可达96.8%,对的去除率为83.9%,对的去除率为94.9%,显著高于许忠能等[15]研究中细基江蓠繁枝变种对和的去除率,也高于吴翔宇等[34]关于芋根江蓠在28 d时对和的去除率。由此可见,细基江蓠可用于净化水质,具有作为生物滤器的潜在可能性。

