大葱AfUFGT2 基因的克隆及干旱胁迫下的表达分析
张宇辰 ,徐欢欢 ,王永勤
(1.北京市农林科学院蔬菜研究中心/农业农村部华北地区园艺作物生物学与种质创制重点实验室,北京 100097;2.长江大学 园艺学院,湖北 荆州 434025)
植物遭受各种非生物胁迫时会积累大量活性氧,从而会导致酶抑制、DNA 损伤,甚至会造成植物细胞死亡[1-2]。黄酮类化合物是植物中主要的次生代谢物,在植物细胞清除活性氧中起到重要作用[3-4]。前人研究表明,黄酮类化合物在植物细胞抵抗非生物胁迫中起到重要作用[5-6],干旱胁迫下小麦和枣树的关键类黄酮基因的表达水平显著上调,同时类黄酮化合物含量也显著增加[7-8]。在拟南芥中过表达AtMYB12能够导致类黄酮积累,从而提高植物的抗旱性[9-11]。此前的研究已经表明,随着类黄酮的积累,植物对干旱胁迫的耐受性也不断增强[12-14]。研究还表明,具有强清除活性氧的黄酮类化合物有助于减轻氧化应激反应,防止植物组织因干旱胁迫而失水[14-16]。
糖基化修饰是黄酮类化合物生物合成途径中的最后一步,同时黄酮和花青素的稳定性和生物活性是通过调节黄酮糖基化来控制的[17]。到目前为止,拟南芥中编码糖基转移酶的基因已经得到了充分的研究[18]。拟南芥中至少有8 种UDP基因被鉴定,尽管这些UDPs基因都编码糖基转移酶,但在拟南芥中的功能存在着显著差异[19-21]。例如,AtUGT78D1特异以UDP 鼠李糖作为糖供体,而AtUGT78D3只能接收对羟基苯甲酸二酯,而不是UDP 葡 萄 糖[19-21]。此 外,作 用 于UGT78D1 和UGT78D2 下游的UGT89C1 参与黄酮醇的二次糖基化。这些研究表明,UGT 与黄酮类化合物的糖基化密切相关[20]。然而,有关参与大葱(Allium fistulosumL.)中类黄酮糖基化修饰的基因鲜有报道。
本研究从大葱中分离编码类黄酮糖基转移酶的基因AfUFGT2,并利用生物信息学对该基因的结构、编码蛋白的理化性质进行预测分析;同时对大葱进行干旱胁迫处理,利用干旱胁迫处理后的植物与对照组AfUFGT2基因的差异表达,预测大葱类黄酮化合物合成调控研究,旨在为深入研究类黄酮糖基化修饰的分子机制奠定基础,也为大葱抗旱品种的选育提供理论依据。
1 材料和方法
1.1 试验材料
选取北京市农林科学院蔬菜研究中心鞭杆大葱作为试验材料。
1.2 大葱总RNA 的提取和cDNA 合成
总RNA 的提取步骤参照RNAiso Plus(诺唯赞,中国)说明书,提取大葱的总RNA,稀释成相同浓度后按照cDNA Amplification(诺唯赞,中国)试剂盒说明书步骤反转录成为cDNA,作为实时荧光定量PCR 的模板。
1.3 大葱UFGT 基因的克隆
根据大葱RNA-seq 数据库(NCBI 登录号:PRJNA827977.)获 得AfUFGT2基 因 序 列,利 用Primer 6.0 软件设计引物(表1)扩增AfUFGT2的编码区序列。
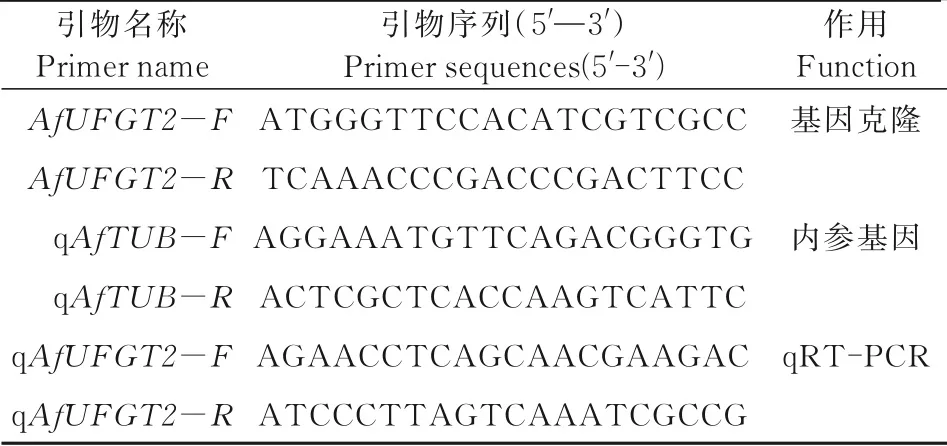
表1 引物序列Tab.1 Primer sequence
PCR 反应体系为样品cDNA 1 μL、10 μmol/L的上下游引物各1 μL、2×TransStart®FastPfu Fly PCR Mix10 μL,加ddH2O 至20 μL。PCR 扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共设置35 个循环。PCR 产物进行1.5%琼脂糖凝胶电泳,使用pEASY-Blune-Zero 载体将经过纯化回收后的电泳产物连接,筛选阳性克隆后送至北京擎科生物科技有限公司进行测序。通过NCBI 对测序得到的AfUFGT2基因编码区序列进行比对。
1.4 AfUFGT2 基因的生物信息学分析
使用Blast p(http://blast.ncbi.nlm.nih.gov/)将AfUFGT2基因进行序列结果分析,使用在线分析工具(https://www.expasy.org/)对AfUFGT2基因编码蛋白质进行特性预测分析;使用PSORT(https://wolf psort.hgc.jp/)预测AfUFGT2基因编码蛋白的亚细胞定位;使用DNAMAN 8.0 进行AfUFGT2基因序列的同源性分析;使用MEGA 6.0 软件进行系统进化树的构建;使用在线分析工具ExPASy 对AfUFGT2基因编码蛋白的二级结构进行预测分析;使用在线分析工具SWISS-MODEL对其三级结构进行预测分析并建立同源模型。
1.5 干旱胁迫下的AfUFGT2 基因差异表达分析
选取花蕾期前长势一致且无病虫害的30 株大葱移栽至日光温室中培养,处理前进行15 d 的预培养,培养条件为白天30 ℃,夜晚18 ℃,每天定时进行人工浇水。把试验材料分为对照组与干旱组,每组15 株,每5 株作为一个生物学重复。对照组与干旱组均在同一环境下,维持正常的光照以及通风条件,其中干旱组通过停止人工浇水来进行自然消耗,对照组正常进行人工浇水,处理10 d 完成干旱胁迫处理。干旱胁迫处理完成后,分别取假茎和叶放入液氮速冻,提取RNA,并逆转录为cDNA。
以大葱AfTUBA作为内参基因[22],按照Taq Pro Universal SYBR qPCR Master Mix(诺唯赞,中国)说明书步骤在LightCycler480 荧光定量PCR仪(Bio-Rad 公司,美国)上完成反应,实时荧光定量PCR 总反应体系为:10 μmol/L 上、下游引物各0.8 μL、TaqPro Universal SYBR qPCR Master Mix 10 μL、cDNA 模板1 μL 和ddH2O 7.4 μL。反应条件为95 ℃2 min;95 ℃15 s,60 ℃50 s,共40 个循环。用2-ΔΔCt计算AfUFGT2基因相对表达量。
2 结果与分析
2.1 大葱AfUFGT2 基因的克隆与序列分析
以从大葱叶片中取得的cDNA为模板,通过PCR扩增并进行亚克隆后测序,结果显示,AfUFGT2基因完整的开放阅读框长度为1 353 bp,编码450 个氨基酸(图1),与数据库序列对比一致。

图1 大葱AfUFGT2 基因序列与氨基酸序列Fig.1 AfUFGT2 gene sequence and amino acid sequence of Welsh onion
2.2 大葱AfUFGT2 基因的生物信息学分析
使用ProtParam 对AfUFGT2的理化性质进行分析,结果显示,大葱AfUFGT2基因编码的蛋白质分子式为C2159H3399N579O631S16,分子质量为48.08 ku,理论等电点pI 为6.01,不稳定指数为29.03。AfUFGT2编码蛋白含有48 个带负电荷的氨基酸残基(Arg+Lys)和41 个带正电荷的氨基酸残基(Asp+Glu),表明AfUFGT2 蛋白稳定性较高。
使用DNAMAN 对大葱AfUFGT2基因编码蛋白进行亲疏水分析,结果显示,大部分肽链为负值,推断其为亲水蛋白(图2-A),其中第14 位疏水性最强,预测值为2.156;亲水性最强的位点为第156 位,预测值为-2.656。采用NetPhos 对大葱AfUFGT2基因编码蛋白进行磷酸化分析,结果表明,其含有7 个Thr 磷 酸 化位点、1 个Tyr 磷酸化位点 和29 个Ser 位 点(图2-B)。使用Concserved Domain Search 分析AfUFGT2编码蛋白的蛋白家族归属,结果表明,其属于糖基转移酶GTB 型蛋白质超家族(图2-C)。
使用PSORT 对AfUFGT2的亚细胞定位预测发现,其对应的编码蛋白位于细胞质中。通过SignalP 3.1 和TMHMM 2.0 在线软件对其进行跨膜区域和信号肽预测分析,结果显示,AfUFGT2编码蛋白没有跨膜区域和信号肽。采用SOPMA 软件对AfUFGT2基因编码蛋白进行二级结构构建,结果显示,AfUFGT2基因的二级结构主要由不规则卷曲(40.87%)、α-螺旋(36.78%)、β-转角(4.09%)和延伸链构成(图2-D)。三维结构预测显示,AfUFGT2基因编码蛋白含有3 个正对的β/α/β类Rossmann 折叠区域(图2-E)。
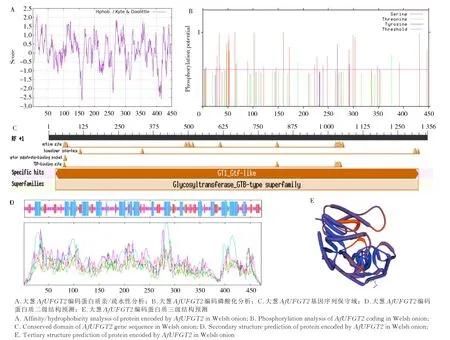
图2 AfUFGT2 基因的生物信息学分析Fig.2 Bioinformatic analysis of AfUFGT2 gene
AfUFGT2 的氨基酸序列与洋葱(AGN33443)、拟南芥(NP_197207)、矮牵牛(BAA89008)、紫苏(BAA19659)、秦 艽 三 花(Q96493)、九 眼 独 活(BAD06514)和三枝九叶草(AID50188)进行多重序列比较结果显示,大葱AfUFGT2 氨基酸序列与这些植物的UFGT 蛋白质序列较为相似,保守性数值都较低且具有完整的糖基转移酶结构域;AfUFGT2 蛋白序列含有PSPG 结构域,且该结构域的第22、23、44 位氨基酸分别为色氨酸、天冬酰胺和组氨酸(图3)。

图3 大葱AfUFGT2 基因序列的多重对比Fig.3 Multiple comparison of AfUFGT2 gene sequences in Welsh onion
进化分析结果表明(图4),UFGT 同源基因编码蛋白所构建的进化关系分成两大分支,其中,大 葱AfUFGT2与水稻(XP_015635040)、青稞(KAE8797650)等植物所属类黄酮7-O-糖基转移酶的氨基酸序列亲缘关系相对较远,与洋葱AcUFGT1 亲缘关系最近,说明AfUFGT2 属于类黄酮3-O-糖基转移酶,参与大葱黄酮类化合物3-O 位置糖基化修饰。
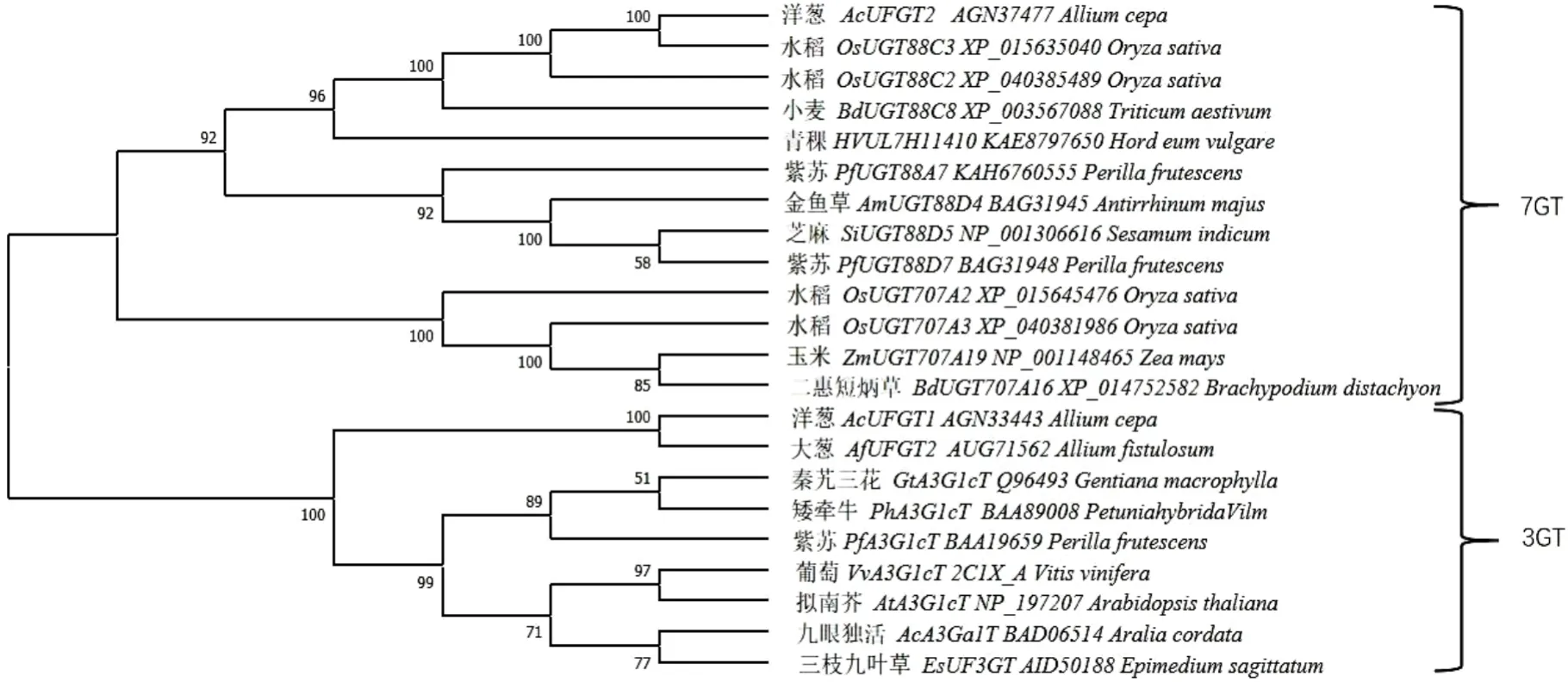
图4 AfUFGT2 与其他植物UFGT 蛋白的系统进化分析Fig.4 Phylogenetic analysis of AfUFGT2 and other plant UFGT proteins
2.3 大葱AfUFGT2 基因在干旱胁迫下的表达分析
为了了解AfUFGT2基因在干旱胁迫下的表达情况,使用大葱AfTUBA作内参基因,通过qRT-PCR 对大葱叶片与假茎中AfUFGT2基因的表达进行分析,结果显示(图5),AfUFGT2基因具有明显的表达特异性,在叶片中的表达高于假茎,在干旱胁迫下大葱的叶片与假茎中AfUFGT2的表达均显著高于对照(P<0.05),表明干旱胁迫能够诱导AfUFGT2基因的表达。
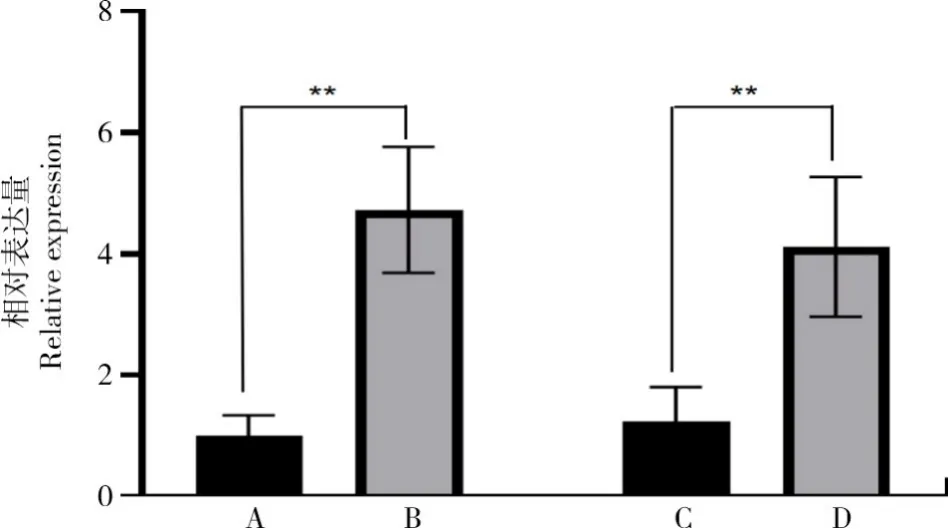
图5 大葱AfUFGT2 基因特异性表达分析Fig.5 Analysis of specific expression of AfUFGT2 gene in Welsh onion
3 结论与讨论
近年来,类黄酮化合物的生理功能受到了广泛的关注,这需要大量的UGTs 来修饰类黄酮分子使其发挥作用[23]。尽管这些UGTs 在拟南芥中得到一些研究,但仍有众多生物学作用等待分析。之前的研究发现,大葱中的类黄酮化合物含量较高[23],因此大葱中的UGTs 对类黄酮含量的调控研究意义重大。次生代谢物——黄酮类化合物在植物抵抗非生物胁迫中起到重要作用,糖基化修饰是黄酮类化合物代谢过程中的重要步骤。糖基转移酶在植物正常生长过程中起到了重要的作用[24-26]。目前,对糖基转移酶的研究主要针对植物的胁迫应答。苹果MdZOG1、大豆GmA02G03420和甜菜BvUGT90A1均受到干旱胁迫的诱导,在干旱条件下显著上调[27-30]。在玉米的研究中,UFGT2 突变体更容易受到环境胁迫带来的影响。研究发现,在拟南芥中过表达随着ZmUFGT2表达量的增加其对干旱和盐胁迫的耐受性也在不断增强[17]。在青稞的研究中,一个糖基转移酶基因HVUL7H11410被鉴定为具有广谱葡萄糖基转移酶活性,并介导黄酮糖基化增强抗旱性[30]。有研究表明,PSPG 结构域与酶蛋白的底物识别有关[31-33]。这些研究都表明,糖基转移酶在植物抵抗干旱胁迫具有重要的作用,能够通过上调表达,积累类黄酮化合物等生物活性物质,从而缓解干旱胁迫带来的负面影响。本研究通过大葱AfUFGT2基因的克隆、生物信息学及实时荧光定量PCR 分析,结果表明,AfUFGT2蛋白序列含有PSPG 结构域,且该结构域的第22、23、44 位氨基酸分别为色氨酸、天冬酰胺和组氨酸,推测AfUFGT2 以UDP-葡萄糖为主要糖基供体,且具有葡萄糖基转移酶活性。干旱胁迫后AfUFGT2基因的表达量明显增多,推测可能是因为大葱为应对干旱胁迫而大量表达AfUFGT2基因,促进黄酮类化合物的3-O-糖基化修饰,从而增加类黄酮基因的表达水平,缓解干旱胁迫。
本研究从大葱叶片中克隆AfUFGT2基因,生物信息分析表明,AfUFGT2基因编码一个酸性的亲水蛋白,属于糖基转移酶GTB 型蛋白质超家族;进化分析表明,AfUFGT2 与洋葱AcUFGT1 亲缘关系最近,属于类黄酮3-O-糖基转移酶,参与大葱黄酮类化合物3-O 位置糖基化修饰。差异表达分析显示,干旱胁迫下大葱会通过大量表达AfUFGT2基因来促进类黄酮化合物的生物合成,进而增强植株抵御干旱的能力。这可能是大葱应对干旱不利环境的一种保护机制。研究结果为深入探究大葱AfUFGT2基因的生物学功能及抗旱作用机制提供了参考。

