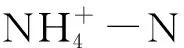二氯甲烷对活性污泥脱氮性能的影响研究
刘星龙, 崔康平, 陈奕涵, 袁新锐
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
1 引言
现代工业生产中经常使用大量挥发性有机物(volatile organic compounds,VOC)作为有机溶剂和生产原料,例如石油炼制、药品制造、皮革制造、涂料等[1]。随着我国医药与化工业的快速发展,这些企业生产过程中排放大量VOC[2,3],在众多VOC中,二氯甲烷(DCM)因具有较高的毒性与残留性[4]被各界广泛关注,被国际癌症机构一致认为是疑似致癌物质[5]。工业生产过程中86%的DCM通过挥发进入大气[6],在水中残留的部分仍会对人们健康与环境安全造成较大危害。
根据《中华人民共和国水污染防治法》规定,工业生产废水必须经有效处理、达到排放标准后再通入市政管网进入污水处理厂,由于企业生产过程中存在一定的波动或处理设备故障,甚至人为因素,违规排放、超标排放屡见不鲜,使未达标的出水进入生活污水处理厂[7]。我国大部分污水处理厂广泛使用生物处理的方法[8],废水中残留的DCM可能对活性污泥系统中的硝化和反硝化菌产生较强的抑制作用,进一步导致整个脱氮生物系统的崩溃,造成出水不达标,严重污染自然水体。目前国内外大部分研究都将DCM作为气态污染物进行处理[9,10],因此对DCM在水体中不同质量浓度对活性污泥系统的影响程度有必要进行研究。
本研究通过向活性污泥序批式反应器(sequencing batch reactor,SBR)中投加不同质量浓度的DCM,研究DCM冲击对活性污泥脱氮性能和生物群落变化的情况,为生活污水处理厂遭遇DCM冲击事故时提供一定数据支持以及参考依据。
2 材料与方法
2.1 实验装置及运行方式
本实验采取用4个完全相同的1 L玻璃制锥形瓶作为SBR反应器,由时控开关控制水浴摇床和空气泵的运行时间,进出水均由用注射器手动完成。实验用污泥取自合肥市望塘污水处理厂,实验配水采用模拟生活污水。将接种污泥加入反应器在驯化20 d后,4个反应器都达到了较高效率的氨氮和有机物去除后开始进行冲击试验。反应器运行周期为12 h,每个周期包括好氧阶段270 min,缺氧阶段270 min,静置阶段150 min,出水阶段15 min,进水阶段15 min。每个周期固定进出水500 mL,水力停留时间为24 h。在好氧阶段用空气泵向反应器内泵入空气,并由玻璃转子流量计控制空气流量,同时水浴摇床保持160 RPM运行,反应器内的溶解氧(DO)均匀混合保持在2~3.5 mg/L。在缺氧阶段停止空气泵运行,水浴摇床保持60 RPM运行,溶解氧保持0.1 mg/L左右。4个反应器均由同一个水浴摇床维持温度在(25±1)℃。通过添加碳酸氢钠和稀盐酸溶液维持反应器pH值为7.5左右。4个反应器所含二氯甲烷分别为0、2、4、6 mg/L,分别以SBRA,SBRB,SBRC和SBRD代表。实验主要分为3个阶段,驯化稳定阶段20 d,模拟冲击阶段7 d和冲击恢复阶段15 d。
2.2 实验用水
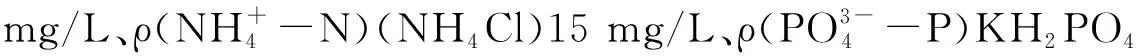
2.3 测定指标与方法
2.3.1 水质测定
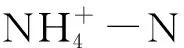
2.3.2 活性污泥中微生物群落的多样性和丰富度通过高通量测序进行测定
(1)样本提取:DCM冲击试验完成后,取各反应器中泥水混合物50 mL放入离心管中于-20 ℃的冰箱中冷藏保存,随后尽快提取DNA。
(2)DNA提取,PCR扩增与基因测序:参照E.Z.N.A.® Soil DNA Kit (Omega Bio-tek, Norcross, GA, U.S.) 试剂盒说明书,对活性污泥样本中的微生物总DNA进行提取。细菌群落结构研究采用16 s rRNA全长通用引物341F 5’- CCTAYGGGRBGCASCAG-3’ and 806R 5’- GGACTACNNGGGTATCTAAT-3’ 进行PCR扩增,每个样本的扩增引物含有8碱基标签序列用以区分样本。准备20 μL的PCR反应体系,如下:4 μL的5x FastPfu Buffer, 2 μL的 2.5 mol/L dNTPs, 上下游引物各0.8 μL (5 μmol/L), 0.4 μL的FastPfu Polymerase,以及10 ng模板 DNA。PCR扩增实验程序如下:95 ℃下进行5 min; 在95 ℃下进行30 s,在55 ℃下进行30 s,在72 ℃下进行45 s,上述三步骤进行1个循环,最后 72 ℃保持10 min。扩增产物经2%琼脂糖凝胶电泳后采用 AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, U.S.) 试剂盒参照说明书操作流程进行纯化。将提取后的基因送至上海凌恩生物科技有限公司(中国上海)进行测序。
3 结果与讨论
3.1 DCM对SBR性能的影响
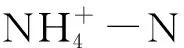
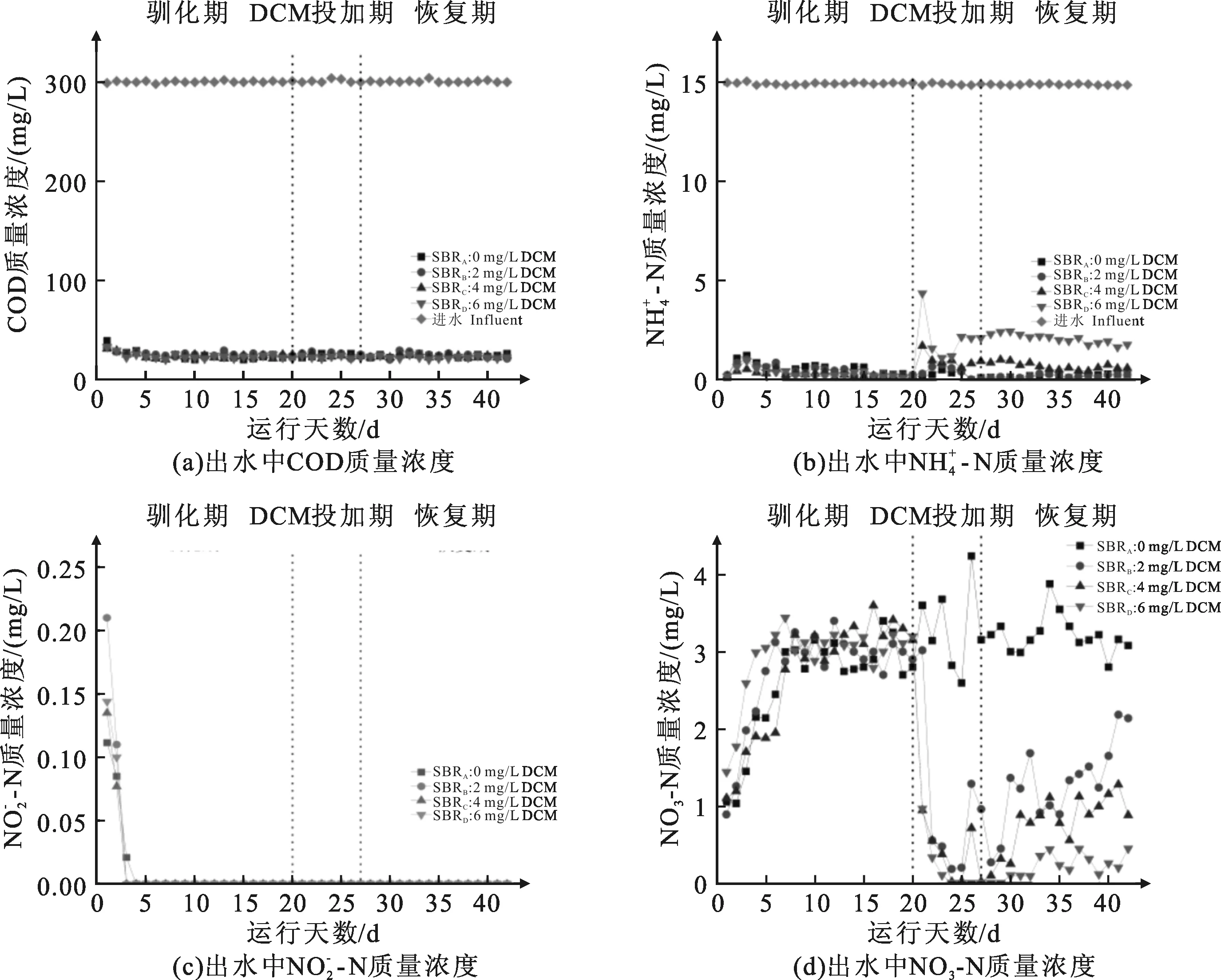
图1 DCM冲击对反应器性能的影响
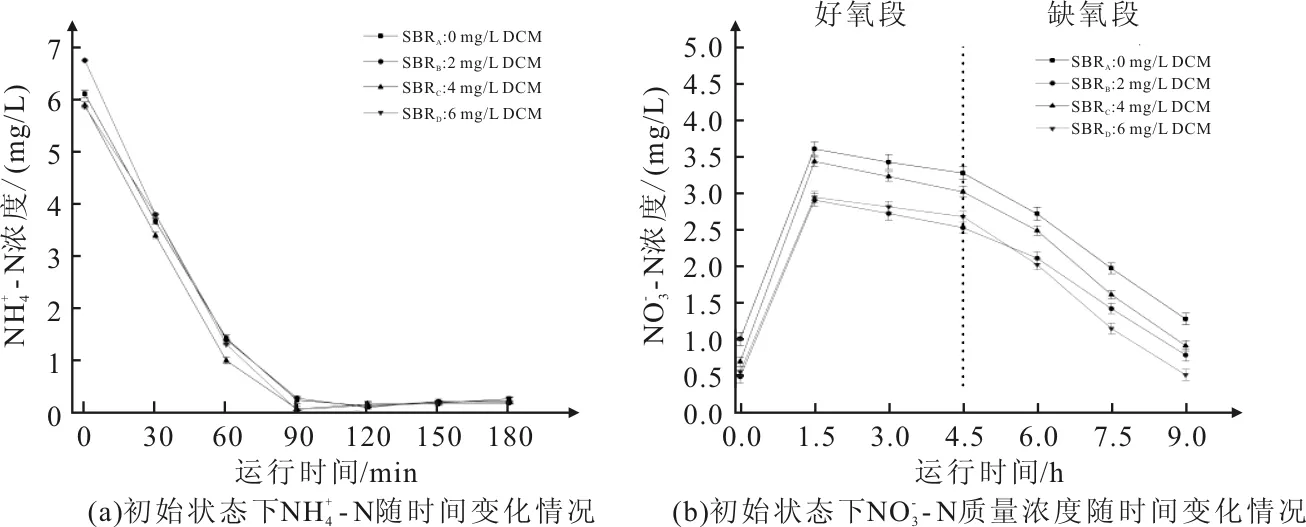
图2 驯化后反应器不同时间和质量浓度

图3 反应器运行周期同一时间与的质量浓度
3.2 DCM冲击对SBR中微生物群落的影响
在冲击期结束后对各组反应器中的活性污泥进行高通量测序,对应的污泥样本为SBRA,SBRB,SBRC,SBRD。基于处理后所得到有效的序列,对活性污泥样品进行分类单元(OTUs)聚类分析,分别获得446、864、766、937个OTUs。不同质量浓度DCM冲击下微生物群落的丰富度和多样性指数变化见表1所列。其中微生物群落的丰富性常用Chao指数和ACE指数来表示,多样性常用Shannon指数和Simpson指数来表示[12]。从表1中可以看出,由于DCM的冲击导致Chao指数和ACE指数的下降,其中在中质量浓度的SBRC反应器中生物多样性下降最为明显,分别从1529、1556下降至819、832。Shannon指数有着明显的下降,DCM质量浓度越高的组Shannon指数下降的显著,在反应器SBRD中从8.8下降至6.7,下降了23.86%,Simpson指数较SBRA也分别有着8~9倍的增长,Shannon指数和Simpson指数的变化都反映了生物多样性的下降,从微生物群落角度反映了DCM对活性污泥系统的影响[13]。

表1 DCM 冲击下微生物群落的丰富度与多样性指数
在冲击结束后微生物群落在门水平的变化如图4所示。在门水平上,冲击前后活性污泥样品中主要的门都为Patescibacteria、Proteobacteria、Chloroflexi和Actinobacteriota,其总丰度在70%以上。其中Patescibacteria在经过DCM冲击后有着明显的增加,从10.44%增加至51.85%,44.68%,51.24%,而Proteobacteria和Chloroflexi的相对丰度分别从未冲击状态的41.13%, 15.06%下降至21.68%、23.51%、19.60% 和10.02%、10.16%、9.29%。说明在DCM的冲击下Patescibacteria门类生物可以有效适应并逐渐成为优势菌种,而Proteobacteria和Chloroflexi会被DCM明显抑制,Patescibacteria门类对于有机物有着较强的降解性能[14],这也解释了在冲击过程中COD的去除未受影响的现象。硝化菌门(Nitrospirota)的显著减少,从未受冲击的0.51%下降至0.46%、0.42%、0.38%这也与活性污泥脱氮性能的下降现象相符。近年来关于Acidobacteriota 门的研究表明,该门菌种通过转运蛋白直接摄取氨[15],实验过程中氨氮有着明显下降,而硝酸盐氮与亚硝酸盐氮没有产生,这与Acidobacteriota直接摄取氨的研究结果相符。Acidobacteriota 门菌类在DCM的冲击中有着显著的下降,影响了活性污泥系统对于氨氮的吸收速率。

图4 DCM冲击对反应器内群落门水平上的影响
4 结论