基于网络药理学的灵芝作用机制研究
徐靖 ,赵建霞 ,张国亮,4 ,王瑛 ,郑化先 ,李明焱,4 ,李振皓,3∗
(1.浙江寿仙谷医药股份有限公司,浙江 武义 321200;2.浙江寿仙谷植物药研究院有限公司,浙江 杭州 310000;3.浙江省珍稀植物药工程技术研究中心,浙江 武义 321200;4.寿仙谷珍稀药材产品省级重点农业企业研究院,浙江 武义 321200)
灵芝为多孔菌科真菌赤芝(Ganodermalucidum)或紫芝 (Ganodermasinense) 的干燥子实体,具有补气安神、止咳平喘等功效[1]。现代研究表明,灵芝具有良好的抗肿瘤、免疫调节、抗氧化、降血糖等生物活性[2-3],应用前景广阔。灵芝是天然真菌药物的重要来源,目前从灵芝属中分离鉴定出600 多种化合物,包括三萜、多糖、甾醇、生物碱、核苷酸、类固醇等类别。其中,多糖和三萜类被认为是灵芝的主要活性成分[4]。通常认为,灵芝多糖具有较好的免疫调节作用,能增强淋巴细胞、巨噬细胞、树突状细胞、自然杀伤细胞等免疫细胞的功能[5-6],也可通过细胞毒性和抗血管生成特性抑制肿瘤的增殖、侵袭和转移[7]。三萜是灵芝主要的小分子活性成分,从灵芝属中分离出的三萜类化合物已有300 多种[4]。研究表明,三萜类化合物不仅具有免疫调节活性[8],而且对不同阶段肿瘤均有明显抑制作用,其抗肿瘤机制包括阻滞细胞周期、诱导细胞凋亡和自噬,以及抑制转移和血管生成等[9]。目前已有较多灵芝药效学及作用机制的相关研究,但许多研究以灵芝提取物或单体化合物为载体,不能较好地体现灵芝多成分-多靶点-多通路的作用特点,以及化合物间、作用途径间的协同作用。
网络药理学理念于2007 年由Hopkins 等[10]提出,该理念以系统生物学为基础,融合了药理学、信息网络学和计算机科学,从药物和疾病间相互作用的整体性和系统性出发,通过虚拟筛选潜在药效物质、作用靶点及通路等,预测药物的作用机制,并结合体内体外研究,对预测结果进行验证,其研究的整体性与中药 “多成分-多靶点-多途径” 的特点吻合,已被广泛用于中药活性成分的靶点预测及中药作用机制的研究[11-12]。
本研究采用网络药理学方法预测灵芝中化合物的相应靶点,预测核心靶点的作用疾病及途径,构建灵芝 “化合物-靶点-疾病-通路” 的多层次相互作用网络,并通过文献进行初步验证,从系统和整体层面研究灵芝主要活性成分的作用机制,旨在为深入开展灵芝药理药效研究和产品开发提供潜在的方向。
1 材料与方法
1.1 灵芝化学成分选择
通过TCMSP 数据库[13],检索到灵芝中的242个化合物,主要为小分子萜类及甾醇等,进一步筛选口服利用度 (OB) ≥30%、类药性 (DL) ≥0.14 的作为潜在优效化合物。此外,在前期研究中,本团队通过高分辨质谱、一标多测等方法对灵芝的主要化学成分进行定性定量分析,发现灵芝酸A 等17 个化合物的含量较高[8],再结合上述优效化合物 (43 个),以这60 个化合物作为本试验的研究对象。
1.2 化合物-靶点网络构建
首先通 过 TCMSP、TCMIP[14]、Swiss Target Prediction[15]、SuperPred[16]等数据库预测化合物的潜在靶点。其中,从Swiss Target Prediction 数据库筛选可能性>0.5 的靶点,从Target Hunter 数据库筛选与待测化合物相似度>0.8 的化合物,将TCMSP 和TCMIP 的靶点直接并入,将化合物与靶点数据集导入Cytoscape3.6.0 软件[17]进行化合物-靶点网络构建,并进行可视化分析。
1.3 核心蛋白互作 (PPI) 网络构建
将预测到的靶点导入STRING 网站,限定物种选择 “Homo sapiens”,将Combined score≥0.9 的网络数据导入Cytoscape 软件,构建PPI 网络,通过Cytoscape 软件中工具栏中 “Analysis Network”功能对整个PPI 网络的拓扑参数进行计算,以度的2 倍中位数、紧密度和介数的中位数为卡值,筛选核心靶点,并在PPI 网络图查看核心靶点与其他靶点的相互作用关系。
1.4 通过核心靶点预测疾病
将候选靶点导入Enrichr 数据库[18],预测其对应的OMIM、DisGeNET 疾病。
1.5 核心靶点生物学功能富集分析
使用Cytoscape 的ClueGo[19]模块对核心靶点进行GO 功能富集分析和KEGG 通路富集分析,设定物种为 “Homosapiens”。GO 功能富集分析包括生物过程、分子功能、细胞组分、细胞免疫过程等四部分,限定只展示P<0.01 的 GO 分析结果;KEGG 通路富集分析只展示P<0.05 的KEGG 富集结果。
1.6 化合物-核心靶点-疾病-通路网络
为阐明灵芝化合物与核心靶点、疾病、通路间的相互作用关系,通过 Cytoscape 软件中的“merge” 功能,将化合物-靶点网络、核心靶点-疾病 (选取前20 种疾病)、核心靶点-信号通路网络进行整合,建立化合物-核心靶点-疾病-信号通路网络图。
2 结果与分析
2.1 化合物选择
从TCMSP 数据库中共收集到242 种化合物,经筛选得到43 种优效化合物,以及含量较高的17种化合物,共得到60 个化合物作为本研究的候选化合物 (表1)。
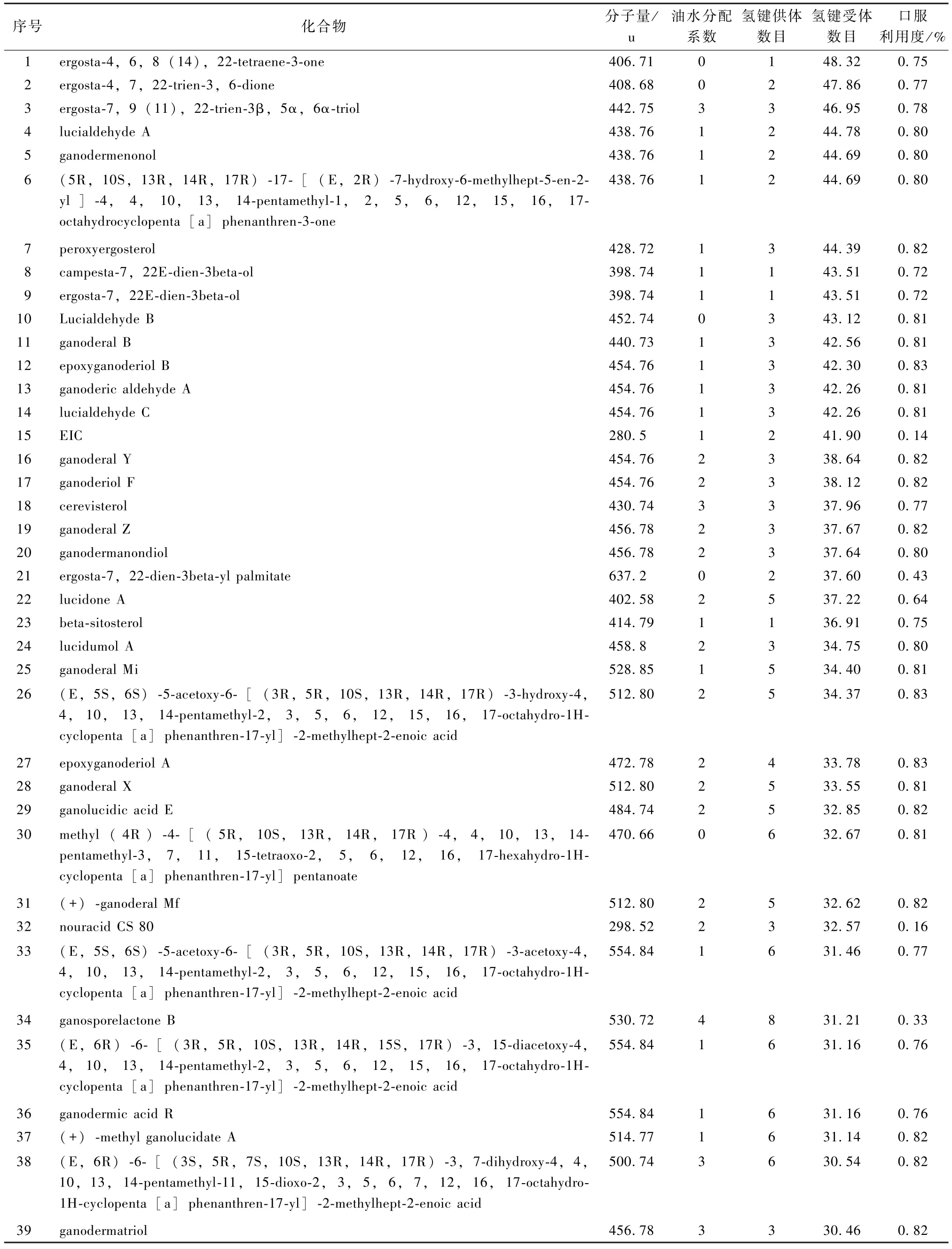
表1 灵芝候选化合物

表1(续)
2.2 化合物-靶点网络
通过TCMSP、TCMIP、Swiss Target Prediction、Super Pred 数据库,从60 个化合物中共预测到289个靶点,灵芝 “化合物-靶点” 网络图 (图1) 显示,有349 个节点、1 388 个边。三角形节点表示化合物,圆形节点表示靶点,每条边表示化合物与靶点的相互作用关系,形状的大小与度值成正比,线条的粗细与介数成正比。每个化合物对应的平均靶点为23.5 个,每个靶点平均与4.8 个化合物发生相互作用,初步说明灵芝也具有多成分、多靶点的作用特点。

图1 化合物-靶点网络图
2.3 核心靶点互作网络 (PPI) 构建
表2 列出了度值最高的化合物及靶点节点的拓扑参数。其中,ACHE 和BCHE 靶点的主要功能为神经调节,且与其连接的化合物均超过30 个,提示这些化合物可能通过靶点ACHE 或BCHE 影响神经调节作用;AR、NR3C1、NR3C2、ESR1 作为激素相关的转录因子调控特定基因的表达,说明这些化合物可通过调节激素相关基因的表达而影响细胞的增殖和分化;TNF 可诱导肿瘤细胞发生凋亡和坏死性细胞死亡,其效应化合物有22 个,说明这些化合物可能具有较好的抗肿瘤活性。
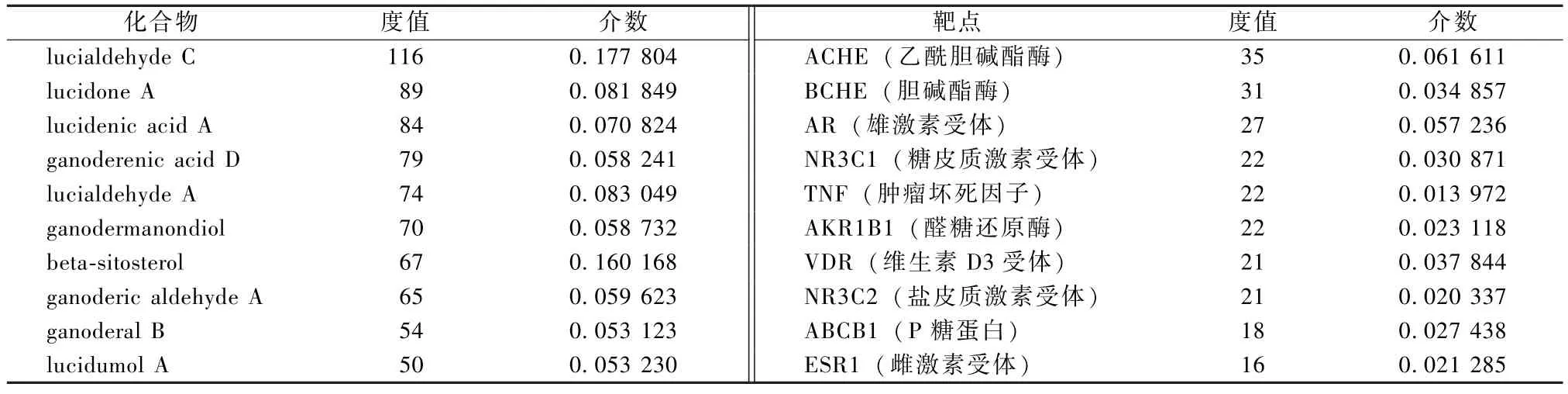
表2 度值最高的化合物及靶点
在图2 的核心靶点网络图中,共有216 个节点、898 条边,说明在预测到的289 个靶点中,共有216 个靶点能与其他靶点发生显著的相互作用,六边形代表符合核心靶点筛选标准的22 个核心靶点 (表3),圆形代表其他靶点,形状的大小与度值成正比,线条的粗细与相关强度 (combinescore) 成正比。由图2 可知,22 个核心靶点不仅与众多靶点相连,且处于PPI 网络的关键位置,发挥了连接2 个模块的桥梁作用,也表明灵芝中的化合物可通过调控这些核心靶点间接影响更多的靶点。
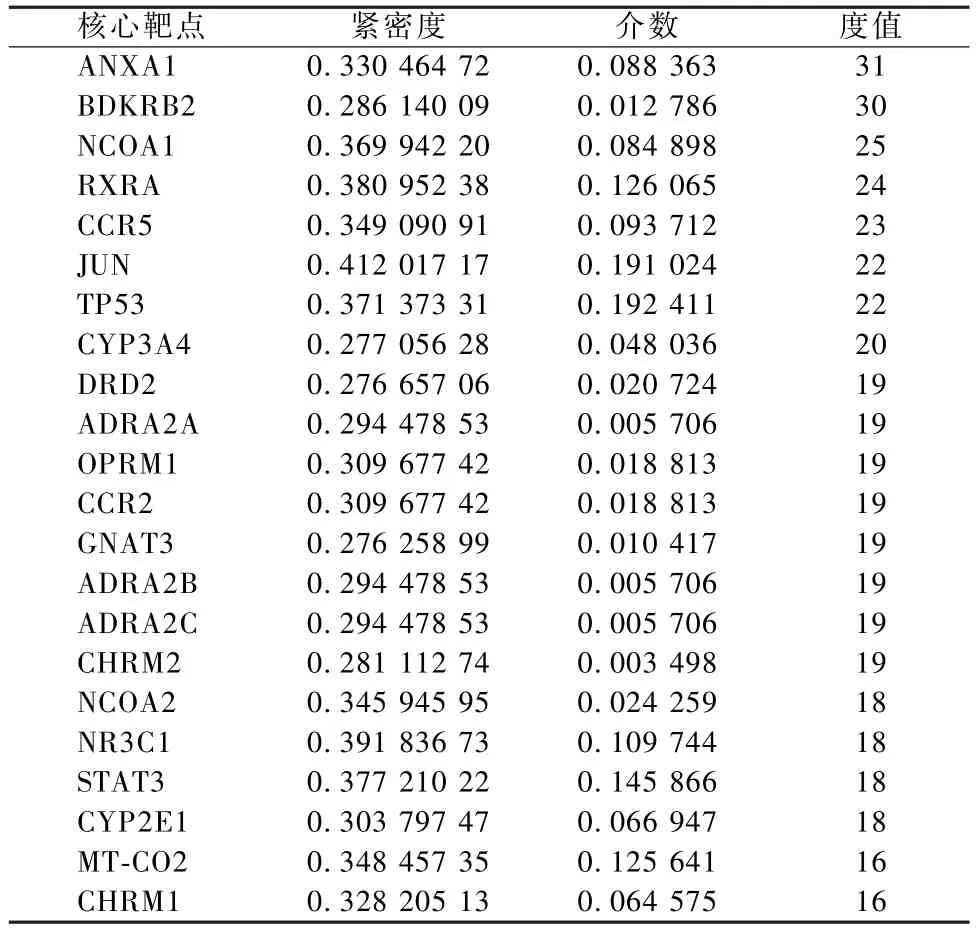
表3 PPI 的核心靶点及其拓扑参数

图2 核心靶点在PPI 网络图中的分布
2.4 通过核心靶点预测疾病
利用Enrichr 数据库中的OMIM、DisGeNET 模块,预测核心靶点相关疾病。表4 显示,OMIM 预测疾病189 个,依据相关强度 (combined score)对top20 进行排序,主要疾病为HIV (艾滋病)、pancreatic cancer (胰腺癌)、hepatocellular carcinoma(肝癌)、breast cancer (乳腺癌)、colorectal cancer(结直肠癌)、dystonia (肌张力障碍) 等,可见核心靶点相关疾病主要集中在癌症和自身免疫性疾病。DisGeNET 模块预测疾病2 588 个,依据相关强度排序对top20 进行排序,主要为alcohol or other drugs use (酗酒或使用其他药物)、hemiballismus(单侧抽搐)、intracortical osteosarcoma (皮层骨肉瘤)、asterixis (扑翼样震颤)、ballismus (投 掷症)、skin appendage adenoma (皮肤附属器腺瘤),可见核心靶点相关疾病主要集中在药物成瘾性疾病和不自主运动疾病等。
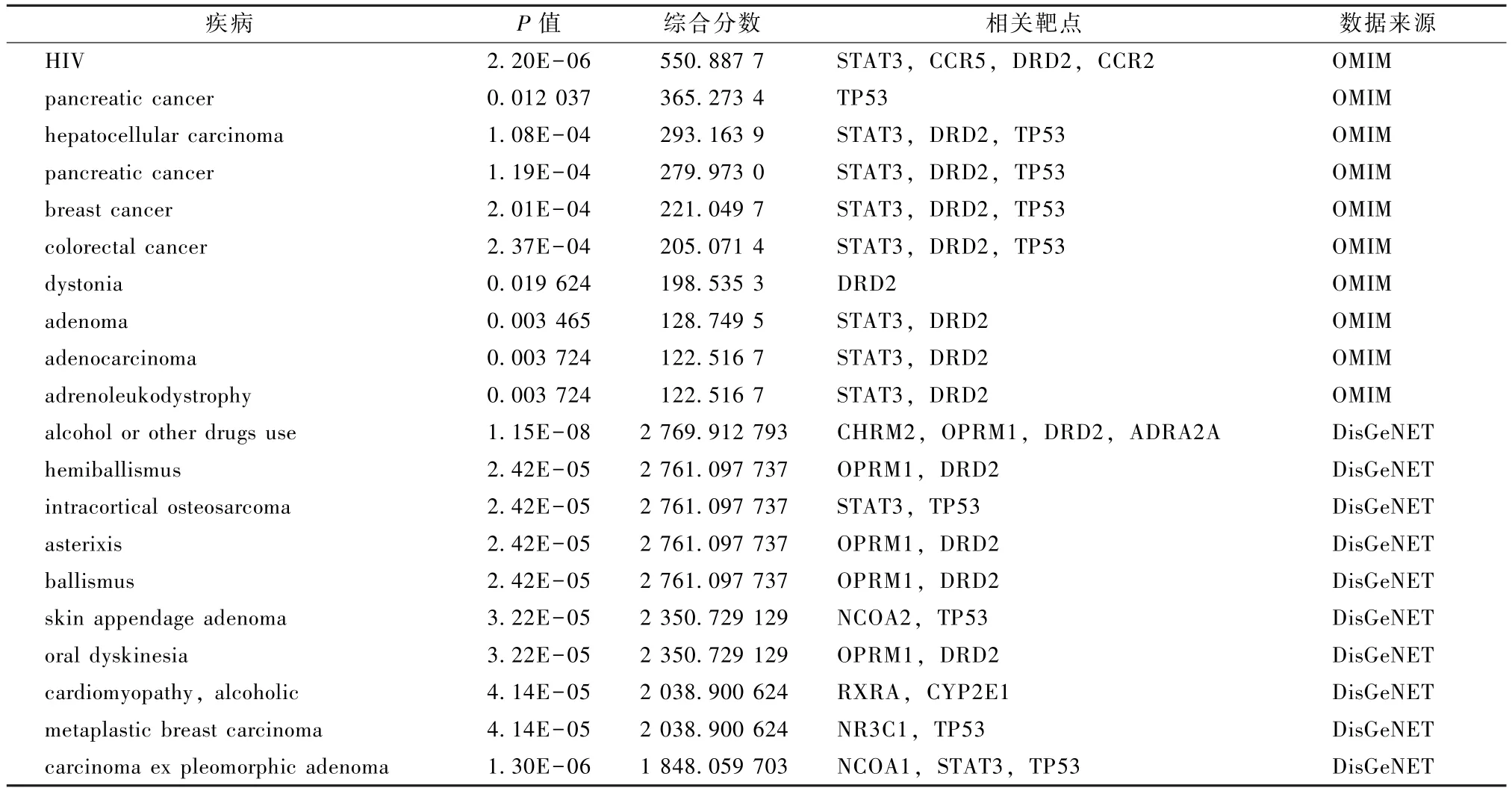
表4 灵芝核心靶点相关的疾病 (top20)
2.5 核心靶点生物学功能富集分析
通过ClueGo 对核心靶点进行GO 功能富集分析和KEGG 通路富集分析。GO 富集结果如图3 中A。选取P<0.01 的通路进行作图,圆形节点代表生物过程,圆形的颜色代表生物过程类别,边则表示生物过程间的相互作用关系,粗细与Kappa Score 成正比,圆形的大小与P值成正比。各GO条目间存在相互作用关系,主要分为8 个类别。其中,G 蛋白偶联受体信号通路 (G protein-coupled receptor signaling pathway) 类别占比40.79%,细胞分泌的负调控类别 (negative regulation of secretion by cell) 占比21.05%,中性粒细胞清除类别 (neutrophil clearance) 占比19.74%,单羧酸转运 (monocarboxylic acid transport) 类别占比10.53%,RNA 聚合酶Ⅱ对pri-miRNA 转录的正向调控 (positive regulation of pri-miRNA transcription by RNA polymerase Ⅱ) 类别占比3.95%。
KEGG 通路富集分析结果如图3 中B。选取P<0.05 的通路进行作图,共有15 个核心靶点成功富集,其主要参与了5 个代谢通路,包括神经活动受体-配体相互作用通路 (neuroactive ligand-receptor interaction)、环磷酸鸟苷酸-环磷酸鸟苷酸依赖性蛋白激酶信号通路 (cGMP-PKGsignaling pathway)、雌激素 信号通 路 (estrogen signaling pathway)、甲状腺激素信号通路 (thyroid hormone signaling pathway)、非小细胞肺癌 (non-small cell lung cancer)。

图3 核心靶点富集分析结果网络
2.6 化合物-核心靶点-疾病-生物功能网络
图4 显示,度值最高的核心靶点有DRD2、STAT3、NR3C1、ADRA2A,其值分别为53、37、27、26。
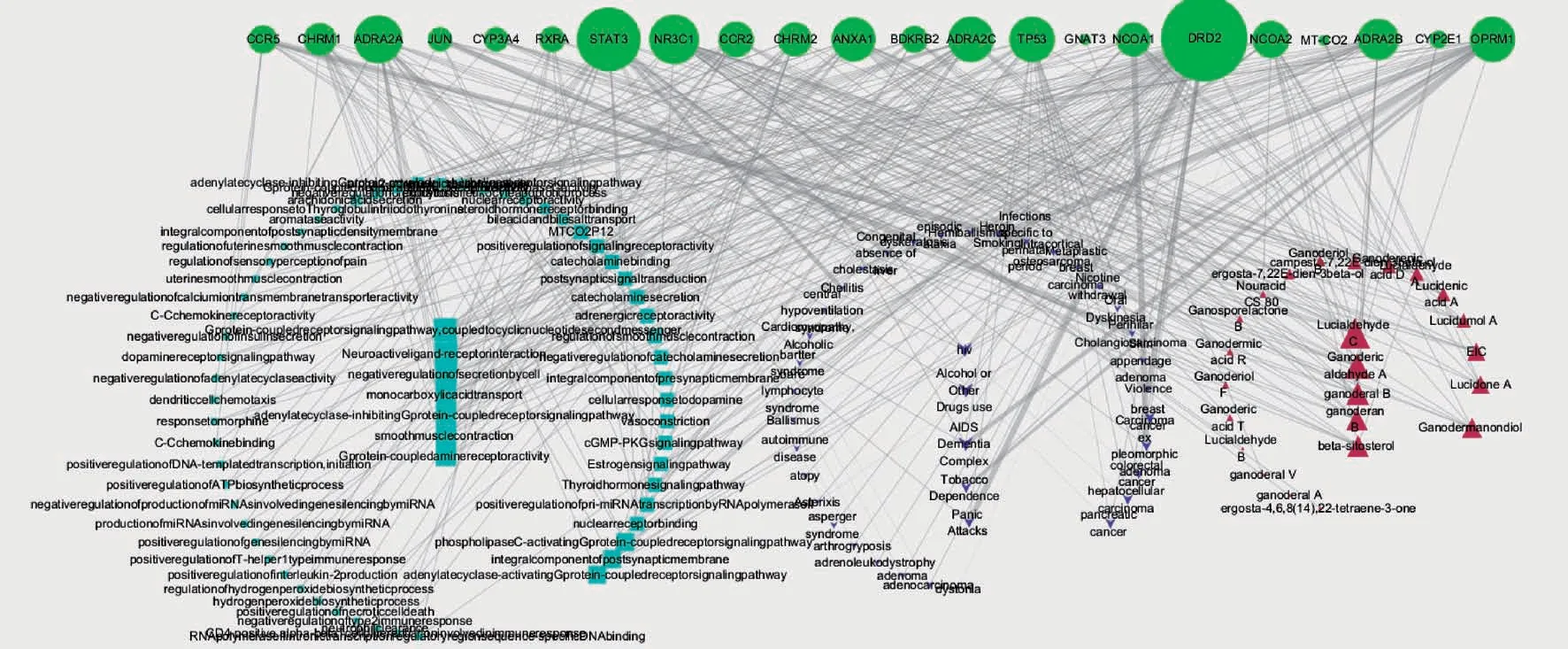
图4 化合物-核心靶点-疾病-信号通路网络
4 个度值最大的核心靶点与相应化合物、生物功能、疾病的相互作用关系见图5。图中显示,灵芝化合物可能通过靶点DRD2、STAT3、NR3C1、ADRA2A,进而调控相应的生物功能,从而改善对应的疾病。DRD2 与2 个化合物、22 个生物功能、30 个疾病相连,提示灵芝中2 个化合物可能通过调控DRD2 及相应的22 个生物功能对30 种疾病发挥作用;NR3C1 与22 个化合物、3 个生物功能、2个疾病相连,提示灵芝中22 个化合物可能通过调控NR3C1 及相应的3 个生物功能,从而对2 种疾病发挥作用。
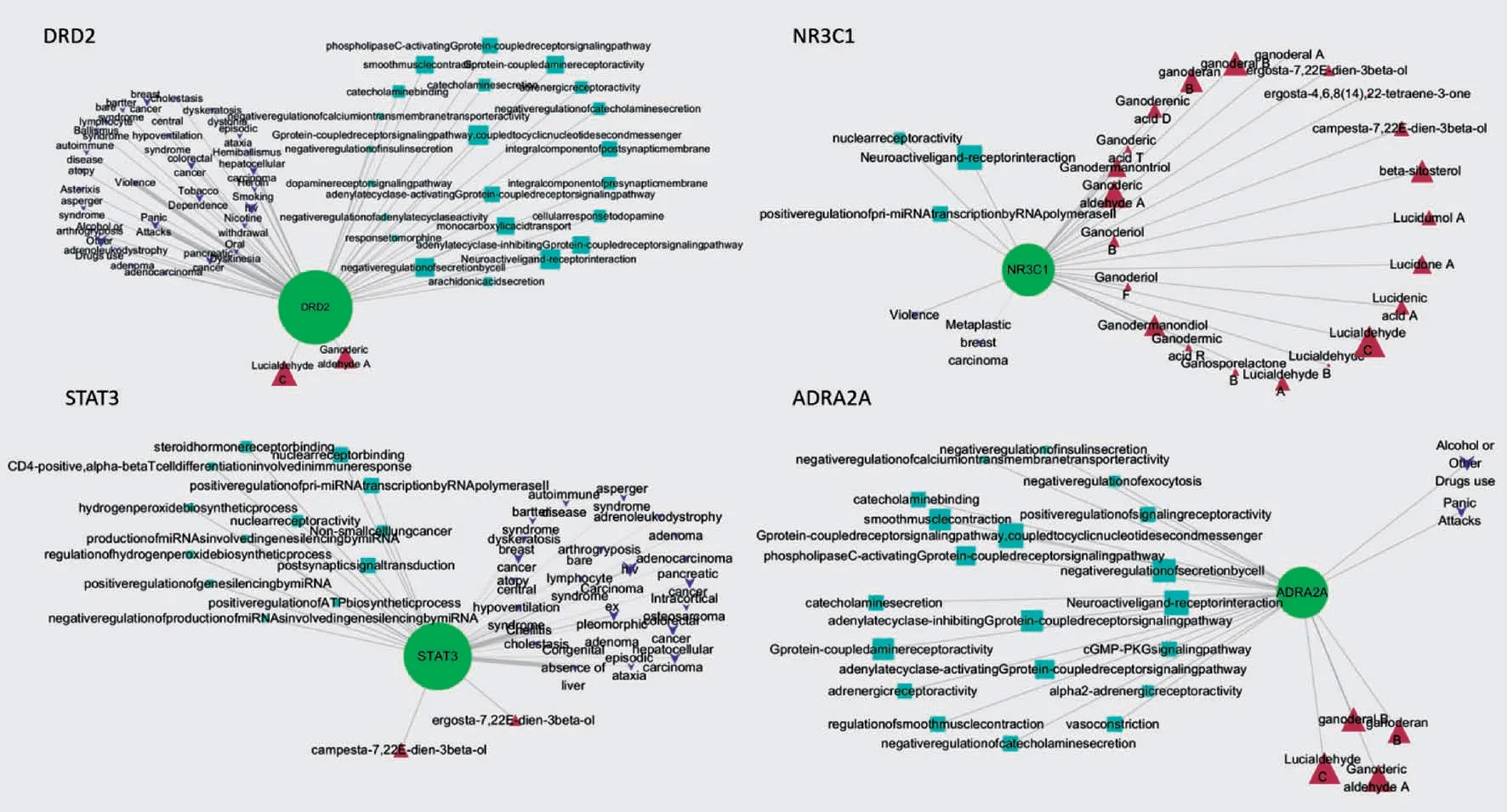
图5 部分核心靶点-化合物-疾病-信号通路网络
3 讨论
本研究利用网络药理学方法研究了灵芝药理作用机制,共选择60 个灵芝化合物,预测到289 个靶点,通过蛋白互作网络筛选出核心靶点共22 个,核心靶点涉及88 个GO 条目、5 个KEGG 通路及2 706 个疾病。本研究还以核心靶点为桥梁,建立了 “化合物-核心靶点-疾病-生物功能” 网络图,以期发现灵芝中活性成分的作用机制,为灵芝的药效学研究以及临床应用提供理论依据与新思路。
在 “化合物-靶点” 网络中,度值的大小代表目标化合物 (靶点) 与其他靶点 (化合物) 发生相互作用的个数,度值越大的化合物,表明其在人体中相应的靶点越多,其药效也就能更充分的发挥,具有潜在的研究价值。
Lucialdehyde C 是灵芝中的重要化合物,其潜在靶点有119 个。研究表明,Lucialdehyde C 对Lewis 肺癌细胞、人乳腺管癌细胞T-47D、腹水癌细胞S180、小鼠肉瘤细胞Meth-A 均有明显的细胞毒性,ED50值分别为10.7、4.7、7.1 和3.8 μg·mL-1[20]。Lucidone A 潜在靶点有89 个,在最大无毒浓度 (MNTC) 范围内,Lucidone A 能显著抑制H2O2诱导的谷丙转氨酶 (ALT) 和天门冬氨酸氨基转移酶 (AST) 水平升高[21],还可通过诱导组蛋白H3、MYT、DNMT3A 和DNMT3B 甲基化,延缓阿尔兹海默症的发病进程[22]。Lucidenic acid A具有显著的抗氧化、抗炎和降血糖活性[23],还可显著抑制肿瘤细胞增殖,将细胞周期阻滞在G1期,并诱导肿瘤细胞凋亡[24-25],其潜在靶点有84个。Ganoderenic acid D 对Hep G2、Hela 和Caco-2细胞具有明显的细胞毒性,IC50值分别为 (0.14±0.01)、(0.18±0.02) 和 (0.26±0.03) mg·mL-1[26]。Ganodermanondiol (灵芝酮二醇) 为主要的三萜类化合物之一,可显著抑制Lewis 肺癌细胞、人乳腺管癌细胞T-47D、腹水癌细胞S180、小鼠肉瘤细胞Meth-A 增殖[20],还可抑制Epstein-Barr病毒感染并预防鼻咽癌的形成[27]。Kim 等[28-29]发现,Ganodermanondiol 通过抑制胞内酪氨酸酶、酪氨酸酶相关蛋白、小眼畸形相关转录因子 (MITF)及MAPK/cAMP 信号通路的表达,抑制黑色素瘤细胞B16F10 增殖。Min 等[30]发现,Ganodermanondiol对经典补体通路表现出较强的抗补体活性,这可能与灵芝加强机体体液免疫的活性有关[29]。Lucidumol A 对醛糖还原酶、葡萄糖苷酶有较好的抑制作用;beta-sitosterol、Ganoderic aldehyde A、ganoderal B 潜在靶点较多,但相关的药效研究报道较少,可能与其在灵芝中含量较低、不易纯化制备有关,具体有待进一步验证。
核心靶点网络图展现了灵芝靶点间的相互作用关系,其中依据度值、紧密度、介数3 个参数筛选出核心靶点 22 个,包 括 ANXA1、BDKRB2、NCOA1、RXRA、CCR5、JUN、TP53、CYP3A4、DRD2、ADRA2A、OPRM1、CCR2、GNAT3、ADRA2B、ADRA2C、CHRM2、NCOA2、NR3C1、STAT3、CYP2E1、MT-CO2、CHRM1。核心靶点与“化合物-靶点” 网络图中关键靶点仅存在1 个共同靶点NR3C1,说明最重要的靶点并不一定是效应化合物最多的靶点,也有可能是在蛋白互作网络中的重要靶点,这些靶点可通过蛋白互作网络发挥作用。核心靶点相关的疾病主要集中在癌症、自身免疫性疾病、药物成瘾性疾病、不自主运动疾病等方面。富集到的GO 条目较多,大致分为8 个类别。其中,G 蛋白偶联受体信号通路类别占比显著高于其他类别,代表了人类基因组编码的最丰富的受体家族,并且是许多药物的靶标[31],表明灵芝活性成分药效的发挥与该通路类别密切相关。相应KEGG 通路有5 个,其中神经活性配体-受体相互作用通路是细胞膜内外信号通路相关受体和配体的结合体,其与9 个核心靶点相连,提示灵芝活性成分可通过该通路治疗疾病。
由各化合物-靶点-疾病-生物功能网络可知,DRD2、STAT3、NR3C1、ADRA2A 度值最 高,说明其在化合物-靶点-疾病-生物功能网络中发挥了重要作用。研究表明,DRD2 基因的变异与酒精及药物依赖性、创伤后压力心理障碍症 (PTSD)、情感障碍、精神分裂症相关的某些症状有关[32]。研究表明,灵芝可通过抑制STAT3 的易位而达到抗前列腺癌的作用[33]。Rios-Fuller 等[34]发现,灵芝提取物通过抑制STAT3 信号传导来降低三阴性乳腺癌的细胞活力,并显著降低了乳腺癌模型小鼠肿瘤的体积和质量。ZHAO 等[35]研究表明,NR3C1 为灵芝主要的效应靶点,可能是评估灵芝提取物抗肿瘤功效的潜在标志物。以上研究结果与DRD2、STAT3、NR3C1 靶点网络图展示结果一致,不仅展示了已有研究中灵芝相关靶点、疾病的关系,也提示了灵芝具体化合物与靶点、生物功能、疾病之间的联系,以及灵芝中药效物质的作用靶点及通路,如灵芝 中化合 物 Lucialdehyde C、Ganoderic aldehyde A 通过DRD2 靶点及22 个相关生物功能对30 种疾病发挥作用,化合物ergosta-7,22Edien-3beta-ol、campesta-7,22E-dien-3beta-ol 通 过STAT3 靶点及11 个生物功能对22 种疾病发挥作用;灵芝中22 种化合物通过NR3C1 靶点及3 条生物功能对暴力倾向及乳腺癌发挥作用。灵芝化合物可能通过靶点DRD2、STAT3、NR3C1、ADRA2A,进而调控相应的生物功能,从而改善对应的疾病,这为灵芝药效物质及作用机制的进一步研究提供参考和方向。
本研究结果充分说明了灵芝多成分、多靶点、多通路的作用特点,也揭示了化合物可能的作用疾病与途径。上述结果的理论基础为化合物对靶点预测、靶点对疾病与通路的预测,由于预测方法、原理、数据库的差异,结果有待进一步的实验验证。

