NLR、FAR及自身抗体检测在系统性红斑狼疮合并间质性肺病中的预测价值
徐紫荆 周冬梅 殷松楼 殷寒秋
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种以致病性自身抗体和免疫复合物形成为特点的自身免疫性疾病,以多器官和多系统受累为特征,主要见于年轻女性[1]。据临床统计,SLE累及肾脏及血液系统最为常见,但近年来研究发现SLE患者出现肺部病变不少见[2]。SLE累及肺部可表现为胸膜炎、肺炎、慢性间质性肺疾病(interstitial lung disease,ILD)、弥漫性肺泡出血等[3]。系统性红斑狼疮继发间质性肺病(SLE-ILD)表现多样,可急性发病,也可隐匿起病,早期症状通常不明显,晚期易发展为肺纤维化,且预后极差,也是造成SLE患者死亡的原因之一[4]。因此,寻找SLE-ILD发病的相关危险因素,有助于该疾病的早期筛查和干预,改善SLE-ILD患者的预后。
对象与方法
1.研究对象:回顾性分析2011年7月~2021年11月于徐州医科大学附属医院风湿免疫科初诊的SLE患者共258例。纳入标准:SLE的诊断符合1997年美国风湿病学会(ACR) 修订的 SLE 分类标准[5]。ILD的诊断符合2002年美国胸科协会 (ATS)和欧洲呼吸协会(ERS)肺病国际多学科共识和 2012 年 ATS/ERS 更新的 ILD 分类标准[6]。入组所有患者均接受0.5mg/kg或1mg/kg泼尼松治疗。排除标准:①排除药物性狼疮及皮肤性狼疮;②排除各种感染(肺部感染、肺结核等)或肿瘤;③排除合并其他结缔组织病(如类风湿关节炎、血管炎等);④排除特发性及感染或肿瘤等导致的继发性ILD。
2.研究方法:根据患者胸部高分辨率CT(HRCT)肺部受累情况将SLE患者分为SLE-ILD组和SLE组,分析比较两组患者的临床特征及血清学资料。收集患者年龄、性别、病程、临床表现、血清学指标、肺HRCT等临床及影像学资料,临床表现包括发热、咳嗽、皮疹、关节痛、口腔溃疡、雷诺现象、脱发等。血清学指标包括血常规、血生化、尿常规、红细胞沉降率(erythrocyte sedimentation rate, ESR)、C反应蛋白(C-reactive protein, CRP)、抗核抗体(anti-nuclear antibody, ANA)、抗双链DNA(dsDNA) 抗体、抗Sm抗体、抗SSA抗体、抗SSB抗体、抗u1-RNP抗体、补体C3、补体C4、SLE疾病活动指数(SLEDAI)积分,计算中性粒细胞与淋巴细胞比值(NLR)、纤维蛋白原白蛋白比值(FAR)、血小板与淋巴细胞比值(PLR)等。

结 果
1.SLE组和SLE-ILD组患者基本特征及实验室指标比较:SLE-ILD组患者咳嗽、雷诺现象的发生率高于SLE组,差异有统计学意义(P<0.05),SLE-ILD组患者年龄、吸烟史高于SLE组(P<0.05)。在SLE-ILD组中,NLR、中性粒细胞计数、FAR、FIB水平显著高于SLE组(P<0.05),血清白蛋白水平明显低于SLE组(P<0.05)。两组间ESR、CRP、淋巴细胞计数、补体(C3、C4)、ANA、Sm抗体、dsDNA抗体阳性率比较,差异无统计学意义(P>0.05)。在SLE-ILD组中,抗SSA抗体、抗RNP抗体阳性率显著高于SLE组(P<0.05), 详见表1。

表1 SLE-ILD组与SLE组基线特征比较
2.分析SLE合并ILD 的危险因素:以是否合并ILD为因变量,将单因素分析结果中差异有统计学意义的8个可能影响因素(咳嗽、雷诺现象、NLR、ALB、FIB、FAR、抗SSA抗体及抗RNP抗体)纳入二分类Logistic回归分析中,详见表2。结果显示NLR、FAR、抗SSA抗体及抗RNP抗体是SLE患者合并ILD 的独立预测因素,详见表3。
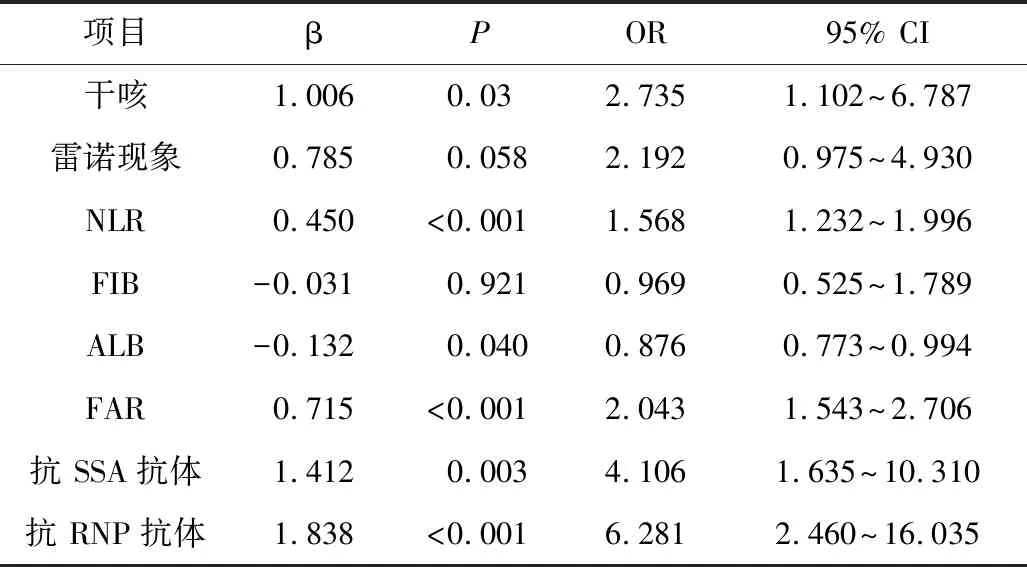
表2 SLE-ILD相关危险因素的单因素Logistic回归分析结果
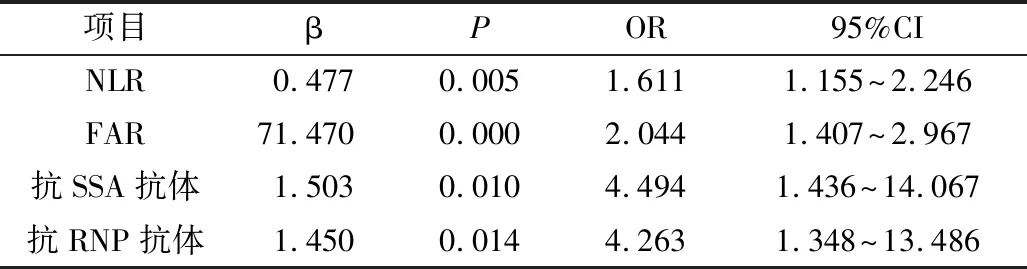
表3 SLE-ILD相关危险因素的多因素Logistic回归分析结果
3.探讨NLR、FAR在SLE-ILD中的预测价值:NLR、FAR的ROC曲线下面积(AUC)分别为 0.734和0.821,敏感度为54.5%和88.6%,特异性为89.5% 和 69.2%,NLR与FAR联合检测的ROC曲线下面积(AUC)为0.850,敏感度和特异性分别为63.6%和92.3%, NLR、FAR联合检测预测效果更佳,详见图1、表4。
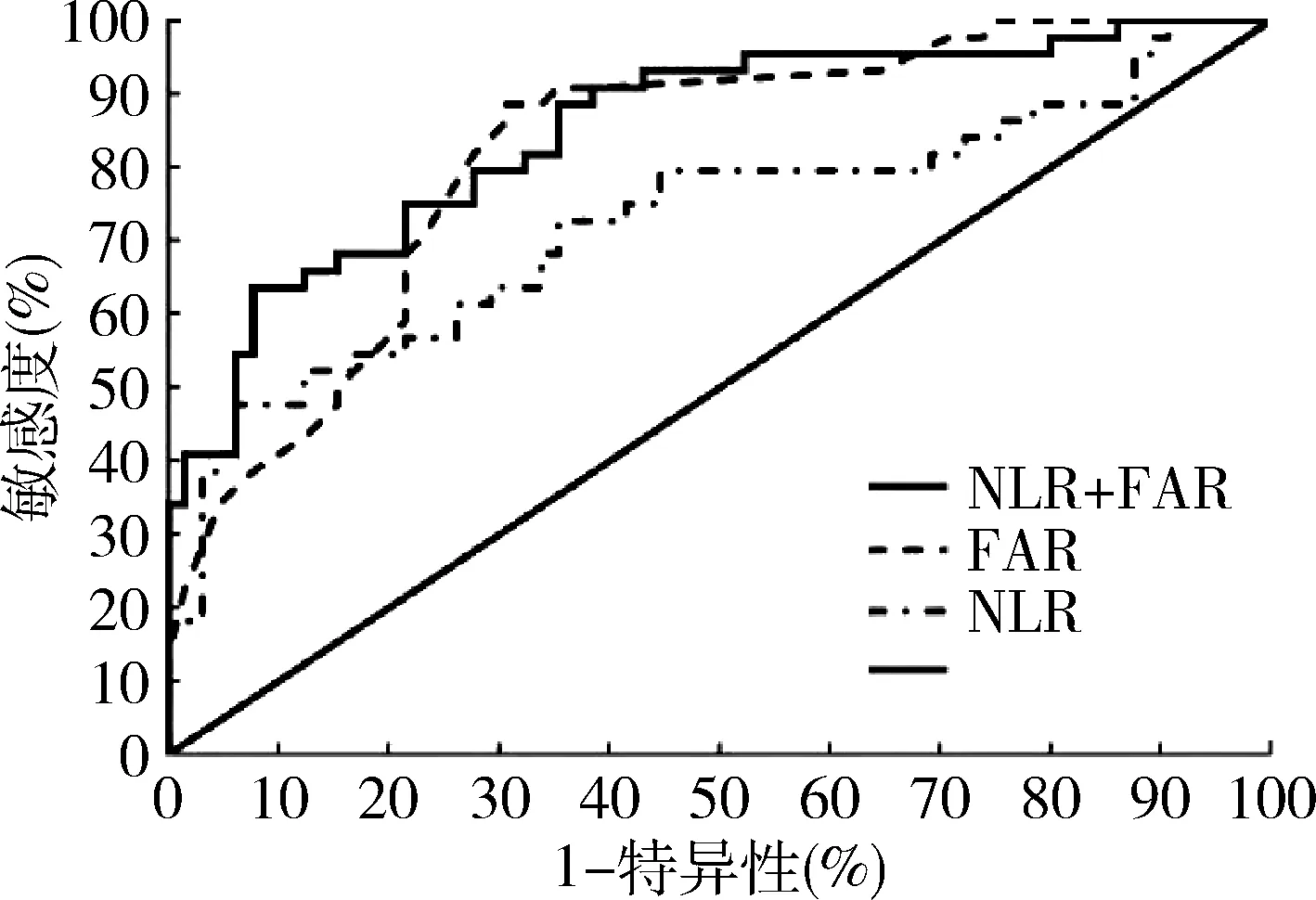
图1 ROC曲线分析
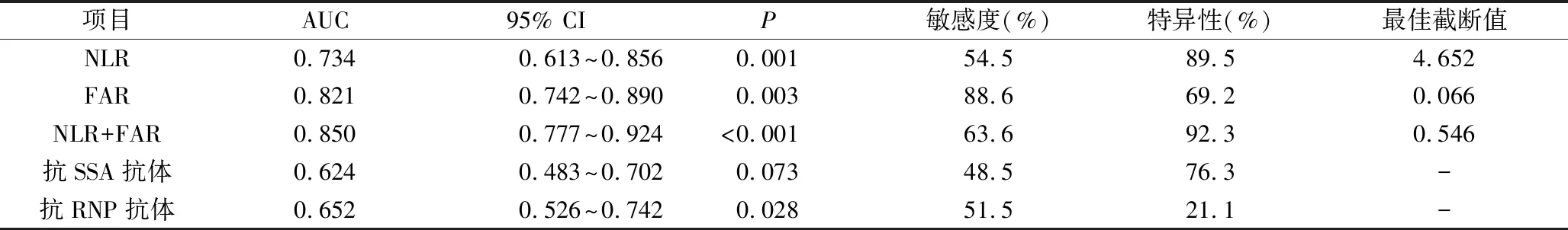
表4 NLR、FAR及联合检测在SLE-ILD组患者中的预测价值
4.SLE-ILD组的HRCT表现:最常见的HRCT分型为非特异性间质性肺炎(NSIP),其次是普通型间质性肺炎(UIP),详见图2, NSIP组、UIP组以及其他HRCT分型患者间NLR、FAR、抗SSA抗体阳性率及抗RNP抗体阳性率比较,差异无统计学意义(P>0.05)。
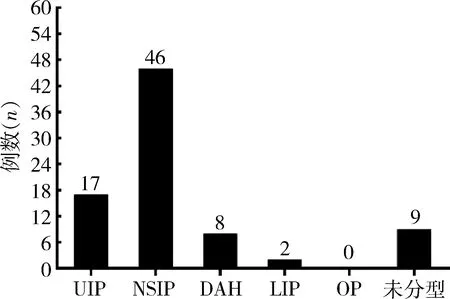
图2 SLE-ILD的HRCT分型结果DAH.弥漫性肺泡出血;LIP.淋巴细胞间质性肺炎;OP.机化性肺炎
讨 论
SLE是在遗传、环境和激素等的相互作用造成炎性反应和器官损伤[7]。ILD是SLE肺受累常见表现之一,但起病隐匿, 早期症状不典型,可有咳嗽、咳痰等,且缺乏特异性血清标志物, 确诊时往往已发生不可逆转的纤维化病变,严重影响患者生活质量及预后[8]。HRCT诊断间质性肺病的敏感度高,且与病理学结果高度一致,尽管HRCT可以早期发现ILD,但由于暴露于辐射,指南中不建议对患者进行常规HRCT检查[9]。本研究中NLR和FAR都是容易获得且价格低廉的实验室参数,便于预测及评估疾病。
本研究发现,SLE-ILD组咳嗽和雷诺现象的比例高于对照组,差异有统计学意义。咳嗽多为干咳,与ILD限制性通气功能障碍、弥散功能降低、低氧血症及肺的弥漫性病变有关。雷诺现象不但可以发生在肢体末端,而且可以出现在内脏血管,例如肺脏、心脏,肺小血管反复痉挛是造成肺部缺血、肺纤维化的原因之一[10]。林俊等[11]报道,以雷诺现象为首发症状的SLE患者出现RNP抗体阳性的比例明显高于非雷诺现象首发者,可以解释本研究中SLE-ILD组患者雷诺现象发生率及RNP抗体阳性率高于SLE组。
循环全血细胞计数(CBC)亚群可引起全身炎症的相对变化,主要表现为淋巴细胞计数减少和中性粒细胞计数增多。近年来,CBC参数在某些自身免疫性疾病中的作用越来越受到关注,被证明是自身免疫和炎症性疾病中炎症的有用标志物。研究表明,SLE患者淋巴细胞计数减少的发生率高达82%,其次是白细胞减少症(41.8%)、中性粒细胞减少症(40.0%)[12]。中性粒细胞计数、淋巴细胞计数和血小板计数具有复杂的病理生理过程,与SLE的发病密切相关。近年来,NLR已成为一种常用的炎性指标,它被用作许多疾病的危险因素,尤其是炎症性疾病的识别和预后[13]。与健康对照组比较,SLE患者的NLR水平升高, NLR和PLR与SLE患者的疾病活动和器官受累有关[14]。在本回顾性研究中,笔者分析了NLR与SLE患者继发肺部损害之间的潜在联系。SLE-ILD与SLE的疾病活动性尚未阐明有明确的相关性,本研究中两组患者ESR、CRP、SLEDAI评分、补体C3、补体C4及尿蛋白之间比较,差异无统计学意义。本研究中,SLE-ILD患者较SLE患者的白蛋白水平显著降低,猜测是由于在ILD进程中,产生大量炎性细胞因子(如IL-1、IL-6、TNF-α等)抑制肝细胞合成白蛋白,进而促进内皮细胞调亡,加速氧自由基的生成,促进成纤维细胞增生进一步加重肺间质纤维化[15,16]。
近年来关于SLE患者自身抗体与间质性肺病的相关性研究仍有争议,既往研究表明,SLE活动期与非活动期抗SSA抗体、抗RNP抗体的阳性率存在显著性差异[17]。本研究发现抗SSA抗体与抗RNP抗体与SLE-ILD具有相关性,笔者还分析了两组患者的其他免疫相关指标,如IgG、IgM、自身抗体(ANA、抗ds-DNA抗体、抗Sm抗体、抗SSB抗体),但未发现两组之间上述指标差异有统计学意义。
SLE-ILD最常见的病理类型为非特异性间质性肺炎,其他类型如寻常型间质性肺炎、弥漫性肺泡出血、淋巴细胞性间质性肺炎相对少见[18]。NSIP多为磨玻璃样病变,UIP多为网格状和蜂窝状病变。在本研究中,SLE-ILD以NSIP为主,占56.1%,其次为UIP,占20.7%,与既往研究相符[19]。SLE-ILD分型与疾病的预后相关,纤维化是其预后的不良因素。UIP成纤维细胞灶较多,因而其预后较差,有文献报道类风湿关节炎相关的间质性肺炎,UIP最易出现急性加重,其临床、影像学与病理学的特征与特发性纤维化急性加重相似,预后很差[20]。
通过Logistic回归分析,本研究发现,NLR、FAR、抗SSA抗体阳性、抗RNP抗体阳性是SLE-ILD的危险因素。在病变早期,SLE-ILD易与肺部感染相混淆,因此有必要全面掌握SLE-ILD的临床表现、影像学表现及相关危险因素,以便对患者进行早期诊断、早期治疗和改善。
综上所述,NLR、FAR是SLE-ILD的危险因素,可作为预测SLE-ILD的血清学指标,NLR、FAR联合检测预测效果更佳。对于高NLR、高FAR、低白蛋白、抗SSA抗体阳性、抗RNP抗体阳性的SLE患者应早期性肺部HRCT检查明确是否合并间质性肺病,密切随访,从而改善预后、提高患者的生活质量。

