不同品种猕猴桃叶绿素荧光参数的日变化研究
申 婷,董云龙,王梦钦,徐 达,严胜柒,张云峰,
(1.云南师范大学生命科学学院,昆明 650500;2.生物能源持续开发利用教育部工程中心,昆明 650500)
农业生产对气候生态条件的依赖性强,气候条件不仅决定作物的分布和品质的形成[1],且会改变农作物的适宜性区划[2,3]。中国是猕猴桃资源最为丰富的国家[4],也是猕猴桃的主要产地,栽培面积和产量均居世界第一。到2011 年,仅陕西省猕猴桃栽培面积和产量就分别达到50 303 hm2和735 748 t[5]。在野生状态下,猕猴桃多分布于湿润区和半湿润区的常绿阔叶林、常绿落叶混交林和针阔混交林,具有喜湿润阴冷、喜阳惧烈阳的特性[6]。长期的林下生境,致使猕猴桃形成了复杂的温度、光照互作关系及在这种关系下的光抑制敏感特征[7-9]。张指南等[10]研究表明,猕猴桃植株不耐高温,35 ℃或以上的环境温度会使叶片发生灼伤。Allan 等[11]研究表明,遮光率达30%~40%时,能提高猕猴桃果实的产量和品质,但遮光率高于55%时反而对猕猴桃有害,适当遮阴能显著提高猕猴桃叶片的光合速率。原寒等[12]的研究也表明,不同猕猴桃品种对光照度的适应性存在较大差异,高光强会引发猕猴桃光合机构的损伤,且中华猕猴桃的光强适应性一般高于美味猕猴桃。同时,猕猴桃植株也不耐低温,近年来极端低温天气时有发生,低温导致猕猴桃园遭遇冻害[13]。特别是叶片,由于其组织热量较小,易受到冷冻压力的影响,且叶片组织直接暴露于光照下,活细胞内致死性冷冻的风险要比其他器官高[14,15]。因此,寻找适宜的猕猴桃栽培条件成为猕猴桃栽培产业亟待解决的问题。
近年来,叶绿素荧光分析技术作为研究光合作用的重要手段之一,对研究植物叶片对光能的吸收、传递、耗散以及对外界胁迫的响应等具有重要作用[3,16]。对植物叶绿素荧光的研究,可快速、准确地检测植物光合生理状态、对胁迫环境及生境条件的适应性[17]。美味猕猴桃、中华猕猴桃、软枣猕猴桃作为目前猕猴桃栽培中应用较为广泛的3 种类型[18],其野生资源地理分布差异明显,美味猕猴桃主要分布在中国西部,中华猕猴桃分布在东部,但更偏南,与美味猕猴桃的分布有交叉重叠,而软枣猕猴桃主要分布区为东北、华中及陕西等地[19],3 个栽培类型地理位置差异也很明显。为此,本研究选取这3 种栽培类型的品种作为试验材料,经短暂低温、叶面遮阴、背部增光等处理措施,以叶绿素荧光成像技术为手段,对其叶绿素荧光参数的差异及日变化进行研究,以期为猕猴桃品种的选育、栽培、区划研究提供参考。
1 材料和方法
1.1 材料
供试材料为3 个猕猴桃品种,分别为美味猕猴桃海沃德(Actinidia chinensisvar.deliciosa.cv.Hay⁃ward,Hw)、中华猕猴桃黄金果(Actinidia chinensiscv.Hort16A,Ho)及软枣猕猴桃青海(Actinidia argutacv.Qinghai,Qh),栽培苗于2019 年冬季种植在云南师范大学生物能源持续开发利用教育部工程中心的温室(E 102°45′—103°00′,N 24°42′—25°00′)。该地区年平均日照时数为2 200 h,年均降雨量为789.6 mm,年均温度为14.7 ℃。所有栽培苗均在自然条件下进行栽培,定期浇水。当猕猴桃藤条长到30 片叶子以上,选取长势良好、叶片完整、无病变、发育成熟的叶片进行试验。
1.2 试验设计
2020 年6 月26—28 日分别测定3 个品种成熟叶片的叶绿素荧光参数。试验共设置6 个处理,分别为空白对照(CK)、0 ℃冰水短暂处理(Low tempera⁃ture,LT)、叶片表 面遮阴[Shade,遮光率(23%±2%)]、叶片背面锡箔纸打光[Light,增光率(20%±2%)]、上午低温短暂处理后中午及下午遮阴(Shade+LT)、上午低温短暂处理后中午及下午打光(Light+LT)。早上6:30 将成熟叶片放入0 ℃冰浴2 h,其他叶片同时段分别进行处理,遮阴叶片使用遮阴网进行遮阴,打光叶片用锡箔纸对叶片背面进行打光。所有成熟叶片将叶柄插入水中,间隔45 min喷洒适量水,防止叶片水分流失,所有试验均在温室内进行,试验重复3 次。
1.3 叶绿素荧光参数
采用FC 800-O 型FluorCam 开放式叶绿素荧光成像系统(捷克PSI 公司)测定猕猴桃叶片的叶绿素荧光参数,测定时间为上午8:30、中午12:00、下午16:00。测定前进行15 min 以上暗处理。测定初始荧光(F0)、最大荧光(Fm)、非光化学荧光淬灭系数(NPQ)以及光量子效率(Fv/Fm)等指标。叶绿素含量测定采用日本柯尼卡美能达叶绿素测定仪SPAD-502 Plus测定,测定方法参照说明书。
1.4 数据处理
使 用Grphpad prism 8.0、Microsoft Excel 及PAST3 软件进行数据分析。
2 结果与分析
2.1 3 个品种猕猴桃叶片叶绿素荧光参数F0的日变化
2.1.1 3 个品种猕猴桃的叶绿素含量 图1 和图2为3 个品种猕猴桃的叶绿素含量及叶绿素荧光参数测定时的植株周边温度。从图1 可以看出,海沃德的叶绿素含量较黄金果的略低,而青海的叶绿素含量高于海沃德和黄金果。上午、中午、下午测定时的温度、光照度分别为(23±1)℃、(300±150)lx,(27±1)℃、(1 200±150)lx,(30±1)℃、(500±170)lx。因此,上午、中午、下午测定时的光照度为低、高、中。

图1 不同品种猕猴桃叶片叶绿素SPAD 值
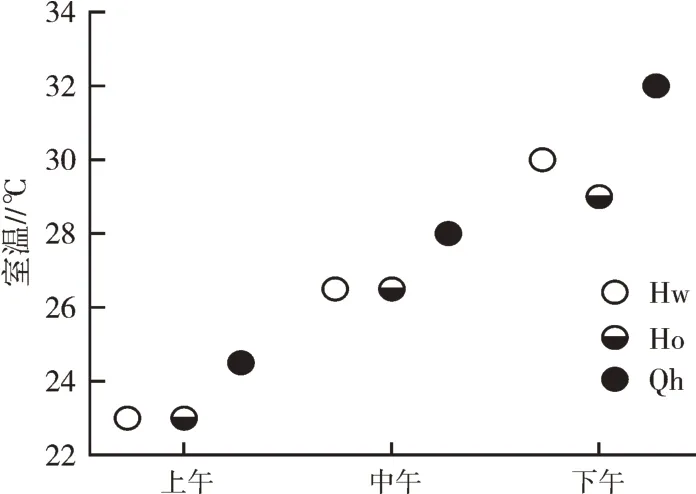
图2 供试猕猴桃植株周边上午、中午、下午的温度变化
2.1.2 3 个品种猕猴桃叶片叶绿素荧光参数F0的分析 图3 为3 个猕猴桃品种的叶绿素荧光的F0成像图,图中测试叶片区域中红色区域越大、色泽越偏红,表明其荧光越高。图3 显示不同品种、不同处理猕猴桃叶片的F0荧光成像结果具有较大差异,表明猕猴桃叶片的F0不仅与品种有关,与测定时间、处理方式也有密切关系。为进一步研究不同处理对3个猕猴桃品种叶绿素荧光参数F0的影响,对各处理、各品种的F0进行统计分析,并利用Grphpad prism 8.0 软件进行绘图(图4)。

图3 3 个猕猴桃品种不同处理的F0叶绿素荧光成像结果
比较3 个猕猴桃品种上午叶片正面对照组的F0及其叶绿素含量(图4A、图1),发现各品种的F0与叶绿素含量并不具有一致性,3 个品种的叶绿素含量为青海>黄金果>海沃德,其中黄金果与海沃德间不存在显著差异(P>0.05),但二者均与青海存在显著差异(P<0.05);而在对照组的F0中,海沃德与青海的F0较高,黄金果的F0较低,且前两者间不存在显著差异(P>0.05),但与后者间存在显著差异(P<0.05)。作为叶绿素荧光分析的基础,F0是PSⅡ(光系统Ⅱ)反应中心完全开放时的荧光产量,在植物适宜生长环境下,F0恒定在一定范围,大小与叶绿素浓度有关[20]。结果表明,试验地环境并非3 个猕猴桃品种的最适宜环境。3 个品种的野生基原植物分属中华猕猴桃、美味猕猴桃和软枣猕猴桃,其地理分布存在很大差异[19],反映出各基原植物在其长期演化过程中形成了其独特适应性,与试验地昆明存在一定的差异。
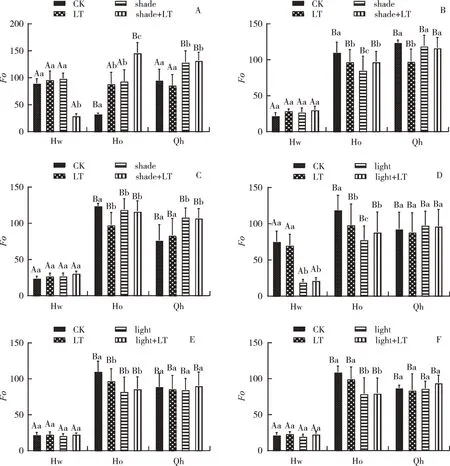
图4 不同品种猕猴桃叶片初始荧光F0值的日变化
图4A 显示,上午的低温处理组中海沃德、黄金果及青海叶片正面的F0间均无显著差异(P>0.05);遮阴处理组中海沃德与黄金果间不存在显著差异(P>0.05),但与青海间均存在显著差异(P<0.05);低温遮阴处理组中,3 个品种间均存在明显差异。结果表明,3 个品种对低温、遮阴及其组合的响应不一致,在环境适应性上存在差异。
在中午的测量中(图4B),与上午相比,对照组中海沃德叶片正面的F0下降,而黄金果和青海的F0上升,表明随中午温度、光照的升高,3 个猕猴桃品种的光合作用机构都有一定程度的损伤。至下午(图4C),对照组中海沃德的F0与中午的基本持平,黄金果的F0有所上升,而青海的F0回落,且较上午的F0低。F0反映的是处于最低激发态下叶绿素分子所吸收的光能,可从3 个途径释放所吸收的能量而回到基态,包括光化学反应、热耗散、荧光释放[16]。当植物受到环境胁迫致使光合作用机构受到损伤,F0会发生变化,F0增加意味着光合作用机构受到损伤,如随后F0降低则表明叶片损伤的光合作用机构能以热耗散增加而得到修复[21,22]。结果表明,在温度、光照升高条件下,海沃德、青海以热耗散的方式对损伤光合作用机构进行修复;黄金果的损伤会进一步加深,但这种损伤并非不可逆,虽然黄金果下午的F0有所升高,但与中午的F0间差异不明显。试验结论表明,猕猴桃对低温处理后的修复能力与叶片的叶绿素含量具一定的相关性。因此,在猕猴桃的抗性品种选育及抗性材料筛选时,可将叶片中叶绿素含量的高低作为一个指标考虑。
由图4A 可知,上午经短暂低温处理后,与对照相比,2 个猕猴桃品种叶片正面的F0均有增高,其中海沃德的升高不明显,而黄金果升高较明显,与对照呈显著差异(P<0.05)。至中午,海沃德的F0比对照高,而黄金果和青海的F0比对照低,但海沃德与对照间无显著差异,而黄金果、青海与其同时段的对照间差异显著(P<0.05)(图4B)。至下午,2 个猕猴桃品种海沃德、黄金果的F0变化趋势与中午的变化趋势一致(图4C),青海的F0稍高于对照,但二者差异不显著。表明3 个品种尽管其光合机构有损伤,但均能以热耗散的方式而修复[21,22],且修复能力与其叶绿素含量有关,黄金果与青海的叶绿素含量较高(图1)。魏桦[23]利用电导率评价法对不同猕猴桃资源的抗寒性进行评价的结果为海沃德属高抗品种,而黄金果是中抗品种,与本研究结果不同,可能是其他因素不同导致的。猕猴桃叶片由于组织热量较小、保护结构单一,对冷害的敏感性要高于其他器官[14,15],且休眠状态下的抗性往往要高于生长活跃状态。
对低温遮阴处理组进行分析,发现上午海沃德叶片正面的F0与对照相比显著下降,黄金果与青海的F0显著升高。而在中午、下午的测定中,与上午相应的低温遮阴处理组相比,海沃德虽有上升,但上升幅度不明显;而黄金果、青海的F0下降,且与上午相应处理间差异明显,但中午、下午间差异不明显。表明低温遮阴处理后,经中午、下午的高温、高光强环境后,虽然海沃德的损伤一直延续,但这种情况并没有加深,说明海沃德经过低温、高温、高光强生境后,遮阴能在一定程度上缓解其损伤。结果同时表明,遮阴处理后,不管经中午、下午的高温、高光强,黄金果和青海都能以热耗散的形式缓解光合机构的损伤。遮阴不仅有利于提高3 个猕猴桃品种的光合效率,同时也有助于缓解温度、光照、低温对其叶片光合机构的损伤。国内外的诸多研究均表明,适当遮阴能显著提高猕猴桃叶片的光合速率及提高猕猴桃的产量、质量[11,14],与本试验的结果相同,同时还表明在非适应条件下,遮阴会降低非适宜环境对猕猴桃叶片的损伤。因此,在猕猴桃栽培过程中,如发生低温、高温、高光强等环境胁迫时,可采用遮阴以避免进一步受害。
从图3 可以看出,在对照组中,海沃德叶片背面所显现荧光的红色明显,其次是黄金果,而青海的较弱,与前文所述试验地并非3 个品种的适宜地一致。表明就试验地昆明而言,猕猴桃品种海沃德不适宜在这里生长;同时经中午高温、高光强后,背部打光处理有助于黄金果和青海2 个品种光合机构的损伤修复。因此,在经历低温、高温、高光强等环境胁迫时,除采用叶片正面的遮阴处理外,采用叶片背部打光处理,在一定程度上也有助于避免胁迫的加剧。
图4D 显示,上午对照组的3 个猕猴桃品种叶片背面的F0存在差异,黄金果最高,青海次之,海沃德最低,且黄金果、青海的F0与海沃德间存在显著差异(P<0.05),而黄金果与青海间无显著差异。经低温处理后,3 个品种的F0均发生不同程度的降低,其中只有黄金果低温处理的F0与对照差异显著,表明低温处理对猕猴桃叶片背面F0的影响没有叶片正面的影响大,这可能与猕猴桃叶片的结构特点具有一定的相关性,猕猴桃叶片的角质层薄,栅栏细胞层少,一般为2 层,海绵细胞多。这也是强光照会降低猕猴桃光合效率,适当遮阴有助于猕猴桃光合效率提高的根本原因。
由图4D 可知,背面打光处理后,在上午测定时段,海沃德及黄金果的F0与对照间差异显著(P<0.05);虽然青海的F0升高,但与对照间无显著差异。低温背面打光处理的F0变化与背面打光处理的F0变化一致。至中午、下午,随着温度、光照的提高,3个猕猴桃品种的F0均发生变化,但大部分处理组与对照间并无明显差异,表明背面打光在一定程度上可缓解低温处理对叶片光合机构的损伤。F0的统计分析结果(图4D、E、F)与上述荧光成像的分析结论相一致。叶绿素荧光成像作为一种能直观反映植物光合生理状态、对环境胁迫及生境条件适应性的检测手段[17],从图像与数据分析的高度吻合性可直接利用图像分析技术来进行植物生长及其对环境适宜性的判定。目前,已广泛用于植物的光合效率评价、突变体筛选、表型组研究等领域[24],随着遥感技术、数字农业的发展,叶绿素荧光成像技术有了更为广泛的运用前景。
2.2 3 个品种猕猴桃叶片正面叶绿素荧光参数Fv/Fm和NPQ 的变化
2.2.1 3 个品种猕猴桃叶片正面叶绿素荧光参数
Fv/Fm分析 图5 中数值反映测试猕猴桃叶片的外界胁迫及热耗散情况(最大坐标值分别为1.00、0.60、0.75)。Fv/Fm是反映植物PSII 光化学的最大量子效率,用于植物胁迫检测[25,26]。Fv/Fm在正常范围值为0.74~0.83,非胁迫条件下该参数很少变化,但外界的任何类型胁迫都会导致PSII 损坏(通常称为光抑制),从而导致Fv/Fm降低,该参数常用来指示环境的胁迫程度或环境胁迫对光合作用机构的损伤程度[27]。
图5 显示,不同品种、不同处理猕猴桃叶片正面的Fv/Fm具有较大差异,与品种、测定时间、处理方式密切相关。上午测定中,对照组3 个猕猴桃品种间Fv/Fm差异不明显。中午,对照组3 个猕猴桃品种的Fv/Fm相对上午黄金果上升,海沃德略下降,青海变化不明显。下午,对照组中海沃德的Fv/Fm略低于正常范围值,青海在正常范围内,而黄金果相对中午回落,且在3 个时段中Fv/Fm最低。结果表明,在温度、光照升高的条件下,海沃德、青海叶片受到的光抑制得到部分修复;黄金果能承受的温度、光照异于其他2 个品种,反映出3 个品种在环境胁迫下光抑制存在一定差异。
低温处理组中,上午经过短暂低温处理后与对照组相比,海沃德和青海的Fv/Fm升高较明显,黄金果的Fv/Fm略有降低。至中午,海沃德和青海的Fv/Fm急剧下降,但黄金果的Fv/Fm呈上升趋势,3 个品种与其同时段的对照间差异明显。表明随温度、光照的增强,海沃德和青海受到短暂低温后,光抑制加剧,可能由于在短暂低温后冻害造成反应机制受损。但黄金果光抑制降低,说明在一定的温度、光强下,不同品种间光抑制响应不同。至下午,3个品种的Fv/Fm变化趋势与其相应的对照组差异明显;与中午的变化趋势相反,海沃德和青海的Fv/Fm上升,黄金果的Fv/Fm略有降低,与上午相应低温处理的变化相比呈下降趋势。遮阴处理组中,3 个品种的Fv/Fm变化趋势与低温处理组一致,但下午有所差异。3 个猕猴桃品种的Fv/Fm变化趋势有差异,与不同品种间对温度及光强的适应性有关,黄金果的高光合效率需要一定的高光照,这也许是黄金果需种植于气温较高的区域;而对于海沃德和青海,适度光照有助于光合作用损伤的修复(图5)。
经低温遮阴处理后,上午3 个猕猴桃品种叶片正面的Fv/Fm与对照相比略升高。而中午、下午的测定中,与上午相应处理组相比,海沃德和青海的Fv/Fm虽有下降,但变化并不明显,而黄金果无明显变化。表明低温遮阴处理后,经中午、下午的高温、高光强环境后,虽然3 个猕猴桃品种光抑制一直延续,但并没有加深趋势(图5)。此结果与F0的分析结果相一致,说明在发生低温、高温、高光强等环境胁迫时,可采用遮阴以避免进一步的危害。上述结果对3 个品种猕猴桃在试验地昆明的种植有一定的理论指导意义。

图5 不同品种猕猴桃叶片正面的非光化学荧光淬灭NPQ和光量子效率Fv/Fm的日变化
2.2.2 3 个品种猕猴桃叶片正面叶绿素荧光参数
NPQ的分析NPQ是植物的一个光保护过程,在光照下,叶绿素的散热速率常数迅速增加,激发能可反映PSⅡ反应中心以热形式耗散掉过剩光能的比例,避免植物光合机构受损伤[28]。NPQ主要由热耗散引起,用其估算热能耗散掉的光能从而降低光合反应中心的光能分配。在环境胁迫下,NPQ的增加对降低光抑制有重要作用[29]。
图5 显示,上午对照组和低温处理组3 个品种间NPQ差异不明显;遮阴处理组中海沃德、黄金果及青海的NPQ差异明显,其大小顺序为海沃德>青海>黄金果,海沃德和青海的NPQ与对照组相比明显上升,黄金果无明显差异;低温遮阴处理组中,海沃德和黄金果的NPQ差异明显,两者与青海无明显差异。结果表明,3 个猕猴桃品种的叶绿素含量不同,叶绿素的散热速率常数呈不同程度的增加,由于光保护机制不同,低温、遮阴及其组合处理的热耗散程度不同。
至中午(图5),对照组中黄金果的NPQ上升,海沃德的NPQ下降,青海的NPQ变化不明显;表明随中午温度、光照的变化,青海应对胁迫环境的光保护机制优于海沃德和黄金果;在低温处理组中,海沃德和黄金果的NPQ与同期对照组差异明显,且较上午NPQ略高,但青海的NPQ较上午低。结果表明,随着温度、光照变化,不同品种通过增加NPQ以降低光抑制。在遮阴和低温遮阴处理组中,3 个猕猴桃品种的NPQ与同时段的对照组差异明显,且大部分处理高于对照组,但较上午呈下降趋势。
至下午(图5),短暂低温、遮阴、低温遮阴处理组中,3 个品种的NPQ与同时段的对照组差异明显,其NPQ都高于对照组,且大部分处理与中午、上午相比呈下降趋势。F0和Fv/Fm的结果分析表明,在猕猴桃栽培过程中,如发生低温、高温、高光强等环境胁迫时,可采用遮阴来避免进一步的为害。
2.3 3 个品种猕猴桃叶片背面叶绿素荧光参数Fv/Fm和NPQ 的变化
从图6 中可以看出,3 个猕猴桃品种不同处理不同时段集中在Fv/Fm变化,而NPQ没有明显变化。说明在叶片背面不通过增加NPQ来降低光抑制,可能通过其他途径来减轻光抑制对植株的影响。

图6 不同品种猕猴桃叶片背面的非光化学荧光淬灭NPQ和光量子效率Fv/Fm的日变化
上午对照组3 个品种的Fv/Fm存在差异,青海最高,黄金果次之,海沃德最低,且黄金果与海沃德、青海间存在明显差异。经低温处理后,虽然3 个品种的Fv/Fm均发生不同程度的变化,与对照组相比,海沃德的Fv/Fm上升,青海的Fv/Fm下降,黄金果的Fv/Fm无明显变化。表明短暂低温处理对3 个品种叶片背面的Fv/Fm也造成了胁迫,且胁迫程度高于叶片正面。背面打光处理后,在上午测定时段,3 个品种的Fv/Fm与对照呈明显差异;虽然青海的Fv/Fm升高了,但低于对照组,黄金果与对照组相比明显降低,海沃德差异不明显。
至中午、下午,在低温处理组中,与上午相比3个猕猴桃品种的Fv/Fm均发生降低,除黄金果外都高于同时段的对照组;背面打光及低温背面打光处理组中,3 个品种与同时段的对照组相比,除低温背面打光处理组黄金果的Fv/Fm偏低外,其他的Fv/Fm变化较小;与上午相比,黄金果的Fv/Fm呈明显上升趋势,海沃德和青海的Fv/Fm呈下降趋势。随温度、光照的提高,3 个品种的Fv/Fm均发生变化,但海沃德和青海的Fv/Fm各处理组大体上明显高于对照组,说明不同处理一定程度上能缓解海沃德和青海的光抑制作用,但黄金果的光抑制加深,表明不同品种可采取适当的叶背低温及打光来降低光抑制对叶片的损坏,但整体变化表明,过高温度、光强会加重光抑制。
3 讨论
叶绿素荧光参数可作为植物应对外界胁迫能力的参考指标。初始荧光F0是PSⅡ(光系统Ⅱ)反应中心完全开放时的荧光产量,F0是荧光分析的基础,在植物适宜生长环境下,F0恒定在一定范围,其大小与叶绿素浓度有关。叶绿素是植物光合作用的基础,其含量的变化对光合作用有重要影响,含量下降会影响总叶绿素荧光水平[30]。本研究中虽然3 个品种的叶绿素含量与F0变化不具有一致性,但当受到低温胁迫时不同品种间的修复能力与叶片的叶绿素含量有关,且3 个品种的F0在不同处理不同时段的变化幅度不同,总体上为海沃德>黄金果>青海。
光是影响植物通过光合作用获取能量的重要因素之一,植物在长期的进化过程中,演化形成了物种的独特光照适应性[31],植物形态和生理上可对不同光照条件作出可塑性反应[32]。叶片是对环境敏感性较高的器官[33]。植物叶片叶绿素荧光参数能够快速反应植物受到外界胁迫的响应。在高辐照度下,光合装置吸收过多的光能导致叶绿体含有叶绿素的反映中心失活或受损[34-36]。因此,光合活性受到光的抑制[37,38]。许大全等[21]研究表明,F0降低表明热耗散增加,植物光合机构的损伤能以热耗散的方式修复。本研究中,经过短暂低温处理后,3 个猕猴桃品种均能以热耗散的方式修复,但修复能力跟叶绿素含量有关。遮阴处理中,海沃德在经过低温、高温、高光强环境后,遮阴能在一定程度缓解损伤;叶片背面打光在一定程度上也可缓解低温处理对叶片光合机构的损伤,该结果与李西文等[39]、荣立苹等[40]、闫小莉等[41]的研究结果一致。
分布在温带地区的许多植物都具有感知非冻结低温并增强防冻的能力,这种现象称为冷适应[42]。短暂低温引起叶片气孔部分关闭的气孔限制和叶肉细胞光合活性下降的非气孔限制,从而导致植物光合速率降低[43]。任何胁迫都会导致PSΠ 的失活损伤,即光抑制[44]。Fv/Fm常被作为判断是否发生光抑制的标准,其降低是光合作用光抑制的显著特征[45]。本研究中,3 个猕猴桃品种叶片正背面不同处理的Fv/Fm值均低于正常范围,但在不同处理组中,3 个品种的Fv/Fm变化程度为黄金果>海沃德>青海。随温度、光照增加,对照组的Fv/Fm呈上升趋势,上升程度为青海>海沃德>黄金果,表明不同品种间的适应性存在差异;在遮阴及低温遮阴处理组中,3个品种与对照组相比,呈先升高后降低的趋势,变化幅度较小,说明遮阴能对光抑制起到一定的削弱作用。对于叶片背面,不同品种可采取适当的叶背低温及打光来降低光抑制对叶片的损坏。这一结果与李清雪等[46]研究结果相似。
本研究中,NPQ整体呈下降趋势,在不同时段不同处理的变化幅度为海沃德>黄金果>青海。NPQ和Fv/Fm的协同变化,在Fv/Fm增加(降低)的大部分处理中,NPQ都增加(降低),表明光合效率的提高是以提高NPQ(热耗散)为代价,可能是猕猴桃栽培中易发生叶片灼伤的原因,当其光合作用机构发生损伤时,增加NPQ是缓解光合作用机构损伤的途径之一,猕猴桃光合作用机构损伤的修复依赖于NPQ(热耗散)。
由于猕猴桃分布全国,品种较多,不同品种间对环境的适应机能存在差异,因此,运用植物叶片叶绿素荧光动力学参数指标进行不同品种抗逆性评价时,需根据品种各自特征,结合植物生理特性以及其他抗逆性指标,综合分析猕猴桃抗性育种及不同猕猴桃品种的地域栽培。

