大口黑鲈摄食含小肽饲料后的胃排空特征和消化酶活性变化
丛湘明 李 向 华雪铭* 宓水潮 杭 莹 易婉婷
(1.上海海洋大学,农业农村部环境生态与鱼类营养研究中心,上海 201306;2.上海海洋大学,农业农村部淡水水生遗传资源重点实验室,上海 201306;3.上海海洋大学,国家水产科学实验教育示范中心,上海 201306;4.常州亚源生化科技有限公司,常州 213111)
鱼类的胃排空率(gastric evacuation rate,GER)指摄食后食物从胃排至肠道的速率[1],是建立鱼类摄食和生长模型的重要组成部分[2-3]。在野生鱼类资源调查中常将测定的胃排空率与相应种群在自然环境中的胃内容物相结合,用来研究鱼类在自然状态下的日摄食量[4]、摄食周期以及生态转换效率等一系列生态学相关的问题[5-6]。在养殖生产中,胃排空率常被用于人工配合饲料开发[7]、饵料转换率评估[3]以及投喂策略优化[8-10]等研究。20世纪末以来,国内学者陆续对鲇鱼(SilurusasotusLinnaeus)[11]、斑点叉尾(Ietaluruspunetaus)[12]、虹鳟(Oncorhynchusmykiss)[13]等养殖鱼类的胃排空率进行了系统研究,并通过多种数学模型对胃内容物重量进行拟合,为科学制定养殖鱼类投喂频率提供重要参数。
大口黑鲈(Micropterussalmoides),隶属鲈形目(Perciformes),黑鲈属(Micropterus),是具有适应性强、生长快等优点的肉食性温水鱼类,且可以全程使用人工配合饲料养殖,目前已成为我国淡水鱼养殖的主要品种之一。但近几年陆续报道在全程使用配合饲料饲养后期会出现肌肉品质下降[14]、肝脏病变等状况[15],这说明大口黑鲈相关饲料产品还有很大的提升空间。小肽又称寡肽,是一类由蛋白质水解形成,以2~10个氨基酸组成的易消化吸收且兼顾多种生物功能的小分子物质[16]。在本实验室前期研究中发现,饲料中添加2%小肽可以提高消化酶活性,促进养殖动物生长[17],但是否需要同时改变投喂策略更有利于营养物质的消化吸收还未可知。
因此,本研究在前期研究[17]基础上,考察摄食含小肽饲料后的大口黑鲈胃排空率及胃排空过程中消化酶活性变化,使用数学模型对胃排空率进行拟合,计算其排空时间,旨在了解添加小肽后对大口黑鲈消化吸收进程的影响,为养殖中投喂频率和饲料配方的优化提供理论依据。
1 材料与方法
1.1 试验饲料
试验所用小肽由常州某生化科技有限公司提供,通过复合水解法以玉米蛋白作为底物,经过浸泡、酸化、酶解、浓缩、均质、喷雾干燥、半成品物理冷却、粉体包衣等多道工艺精制而成。其蛋白质水平为46%,其中小肽平均分子质量为1 003 Da,分子质量为1 000 Da的小分子蛋白质占总蛋白质的25%~30%。
根据大口黑鲈的营养需求并结合养殖生产中常用的商品饲料设计本试验所用饲料配方,以鱼粉、豆粕、玉米蛋白粉等原料为蛋白质源,鱼油、菜籽油和大豆磷脂为脂肪源,配制3种饲料:D0+饲料满足大口黑鲈的营养需求(正对照组),D0-饲料在D0+饲料基础上降低3%蛋白质水平(饲料中鱼粉、血粉、豆粕、玉米蛋白粉等比例减少)(负对照组),D2饲料则在D0-饲料基础上添加2%小肽。
将饲料原料粉碎后过60目筛,按照配方比例充分混匀后,再加入油脂使用混合机混合均匀,随后加入所配饲料质量15%~20%的水后再次混匀,经制粒机制成直径为2 mm的颗粒饲料,待50 ℃烘干至水分含量低于10%后,密封储存于-20 ℃冰箱中备用。试验饲料组成及营养水平见表1。
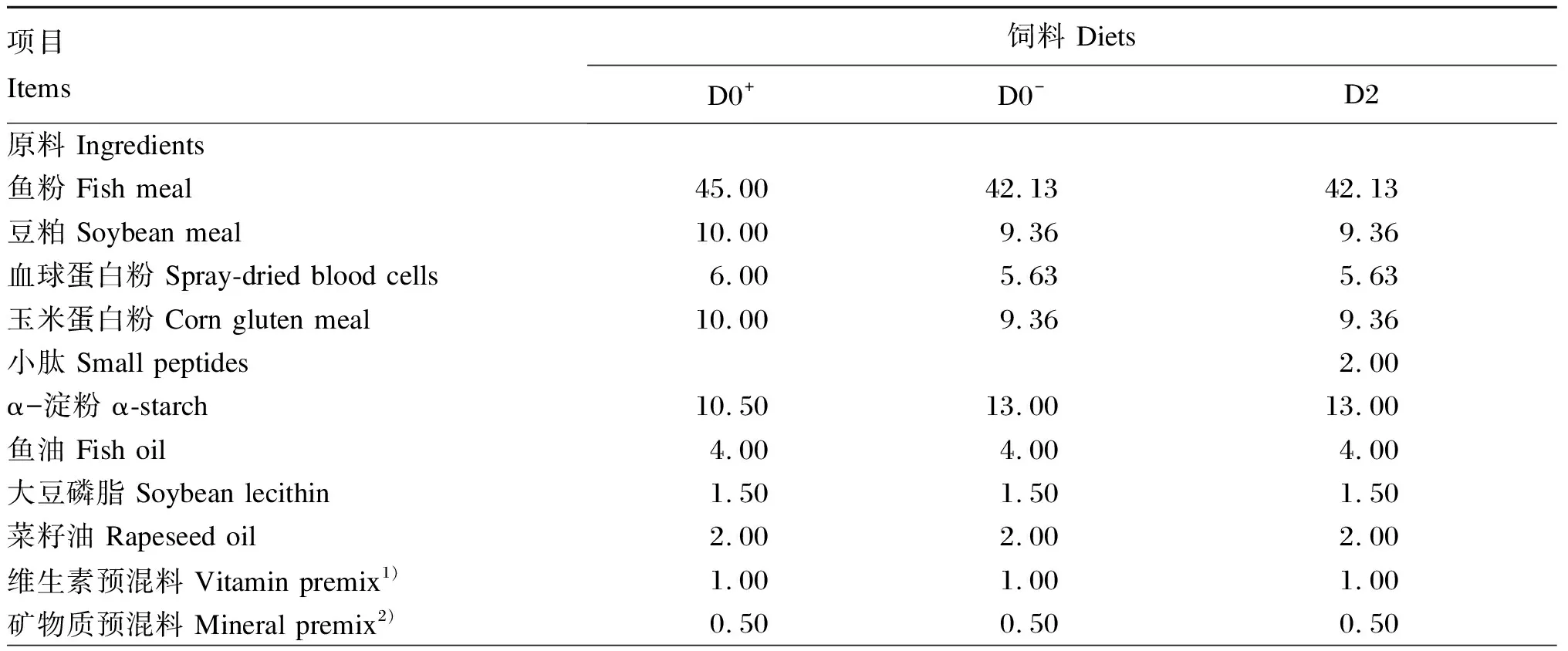
表1 试验饲料组成及营养水平(风干基础)

续表1项目 Items饲料 DietsD0+D0-D2酵母膏 Yeast extract1.001.001.00氯化胆碱 Choline chloride0.500.500.50磷酸二氢钙 Ca(H2PO4)2 1.001.001.00牛磺酸 Taurine 0.300.300.30微晶纤维素 Microcrystalline cellulose2.002.002.00沸石粉 Zeolite4.706.724.72合计 Total100.00100.00100.00营养水平 Nutrient levels3)粗蛋白质Crude protein46.6443.7044.64粗脂肪 Crude lipid12.0711.7811.82总能 Gross energy/(MJ/kg)18.9418.8418.81
1.2 饲养管理
饲养试验在上海海洋大学滨海养殖基地进行。提前将购买于浙江省湖州市池塘养殖的鱼苗进行暂养与驯化,选取规格均匀、健康的大口黑鲈540尾[初始体重(21.27±0.17) g],随机分配至12个网箱中,每个网箱(200 cm×120 cm×100 cm)45尾鱼,每组4个网箱即4个重复,养殖周期为60 d,每天表观饱食投喂2次(08:30和16:30),日投喂量为体重的2%~3%,采用自然光照,水体温度(27±5) ℃;定期吸污换水,24 h连续充气;溶解氧浓度不低于5 mg/L,氨氮浓度不高于0.3 mg/L。
1.3 试验设计
D0+组、D0-组和D2组分别从饲养试验结束后的4个网箱中挑选规格相同、体重为(85.58±1.81) g的大口黑鲈80尾,将挑选出的大口黑鲈放置在每组相应的小网箱(80 cm×30 cm×50 cm)中,每组8个网箱,每个网箱10尾。正式试验开始前,通过解剖法确定取样时间间隔,为保证试验采样操作方便,所有正式试验用鱼饥饿处理48 h,确保其消化道彻底排空。随后,所有网箱的鱼投喂与养殖试验对应的饲料,表观饱食投喂1次,投喂持续时间30 min,分别在投喂结束后的0、3、6、9、12、18、24、30 h随机对各组8个网箱中的1个网箱取样。胃排空试验时水质和管理条件与前期养殖试验相同。
1.4 样品采集与测定
将网箱中10尾大口黑鲈全部捞出,使用丁香酚迅速将鱼麻醉。沿着大口黑鲈腹部,从肛门剪至下颌部,暴露内脏。分离出胃和消化道,用镊子分别夹紧胃贲门部和幽门部,将贲门朝向预先干燥称重的离心管,完全挤出胃内容物,对离心管称重,所得重量即为胃内容物湿重;将胃内容物置于烘箱中按GB/T 6435—2006测定水分含量,然后记录所得干重。
将去除内容物的胃和肠道置于-20 ℃保存,用于消化酶活性的测定。淀粉酶、脂肪酶活性均采用南京建成生物工程研究所提供的试剂盒进行测定;胃蛋白酶活性采用GB/T 23527—2009中酸性蛋白酶活性测定方法测定,肠道蛋白酶活性采用GB/T 23527—2009中中性蛋白酶活性测定方法测定,组织匀浆液的蛋白质浓度采用考马斯亮蓝染色法进行测定。
1.5 指标计算与数学模型
SR(%)=100×Nt/N0;
WGR(%)=100×(Wt-W0)/W0;
FCR=Wf/(WT-WO);
SGR(%/d)=100×(lnWt-lnW0)/t。
式中:SR为存活率;Nt为终末尾数;N0为初始尾数;WGR为增重率;Wt为终末体重;W0为初始体重;FCR为饲料系数;Wf为摄入饲料量;WT为试验末总重;WO为试验初总重;SGR为特定生长率。
参照文献[10]用线性、指数和平方根模型分别拟合胃内容物剩余重量百分比:
线性模型:Y=A-Bt;
指数模型:Y=Ae-Bt;
平方根模型:Y0.5=A-Bt。
式中:Y为任一取样时间胃内容物重量占总摄食量的百分比,即胃内容物剩余重量百分比(%)=(任一取样时间时胃内容物重量/总摄食量)×100;B为瞬时胃排空率(%/h);t为摄食后的时间(h);A为常数。通过比较各拟合模型的相关系数(R2)、残差平方和(RSS)、残差的标准差(SDR)来选择大口黑鲈的最佳排空模型。
1.6 数据处理与统计分析
试验数据用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),若发现各时间点存在显著差异则采用Duncan氏法进行多重比较。3种数学模型的参数A、B均由统计软件Origin 2018进行曲线拟合得到。所有统计值均以平均值±标准差(mean±SD)表示,显著水平定为P<0.05。
2 结果与分析
2.1 大口黑鲈摄食不同饲料后生长性能的变化
从表2可以看出,D0+组终末体重与增重率最高,D2组终末体重与增重率略高于D0-组,但差异不显著(P>0.05)。3组间饲料系数、特定生长率与存活率也都差异不显著(P>0.05)。

表2 各组大口黑鲈摄食不同饲料的生长性能
2.2 大口黑鲈摄食不同饲料后胃内容物水分含量的变化
由于30 h时大口黑鲈胃内容物已排空未采集到内容物,因此摄食后各组胃内容物水分含量变化为24 h内,结果如图1所示。3组大口黑鲈胃内容物水分含量均在摄食后0~6 h显著上升(P<0.05),均呈现先上升后下降的趋势。D0+组、D0-组和D2组胃内容物水分含量分别在18、12和18 h最高。D0-组和D2组胃内容物水分含量在3~24 h内保持稳定。
2.3 大口黑鲈摄食不同饲料后胃排空模型的选择与胃排空时间
分别使用线性、平方根及指数模型对3组大口黑鲈胃排空数据进行拟合。结果显示(表3,图2),3组胃内容物的干重和湿重数据能较好地与3种模型进行拟合。比较各组各模型的R2,采用湿重拟合结果中只有D2组线性模型R2高于0.900。综合R2、RSS以及SDR可知,使用胃内容物干重拟合结果相对要优于湿重拟合结果。在本试验条件下,D0+组胃排空规律的最佳模型是使用干重拟合的指数模型,D0-组和D2组的最佳模型是使用干重拟合的平方根模型。
将图2中最佳模型与表4结合来看,D0+、D0-和D2组的胃内容物完全排空均为30 h,但3组的变化趋势不尽相同。D0+组中在0~9 h,胃内容物剩余重量百分比在9 h时急剧下降,胃内容物剩余重量百分比降至42%左右,随后缓慢下降至24 h时,胃内容物已排空85%左右; 在30 h时,胃内容物已基本排空。D0-组中在0~9 h,胃内容物剩余重量百分比保持着相对匀速下降趋势,9~18 h时胃内容物剩余重量百分比急剧降至23%左右,随后缓慢下降至24 h时,胃内容物已排空80%左右;在30 h时,胃内容物已基本排空。D2组在整个排空过程中,胃内容物剩余重量百分比也呈现先慢后快再慢的特点,但保持着相对匀速下降趋势,12 h时胃内容物剩余重量百分降至42%左右,在24 h时,胃内容物已排空85%左右;在30 h时,胃内容物已基本排空。因此,根据各组最佳模型拟合得到的方程式Y=99.080e-0.084t、Y0.5=9.972-0.257t和Y0.5=9.868 9-0.274t,计算可知50%和80%胃排空的理论时间,D0+组分别为8.14和19.04 h,D0-组分别为11.28和21.4 h,D2组分别为10.21和19.67 h。
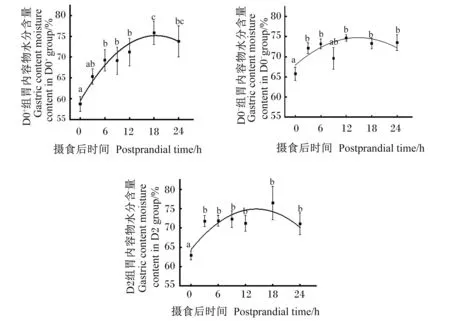
不同小写字母表示不同取样时间点的数据之间差异显著(P<0.05)。下图同。

表3 各组大口黑鲈摄食不同饲料的胃排空曲线的3种数学模型拟合

续表3项目 Items组别 Groups模型 Models公式 EquationsR2RSS SDR湿重Wet weightD0+线性模型 Y=98.554-3.187t0.86511 991.96312.320平方根模型Y0.5=10.171-0.222t0.85413 191.93212.917指数模型Y=106.638e-0.058t0.82415 661.11414.056D0-线性模型 Y=106.890-3.588t0.8837 052.9979.449平方根模型 Y0.5=10.605-0.245t0.86215 322.74113.913指数模型Y=114.725e-0.060t0.81720 328.52015.985D2线性模型 Y=107.133-3.638t0.90710 266.07511.400平方根模型 Y0.5=10.623-0.250t0.88812 601.46412.614指数模型Y=115.145e-0.061t0.84017 867.01114.971
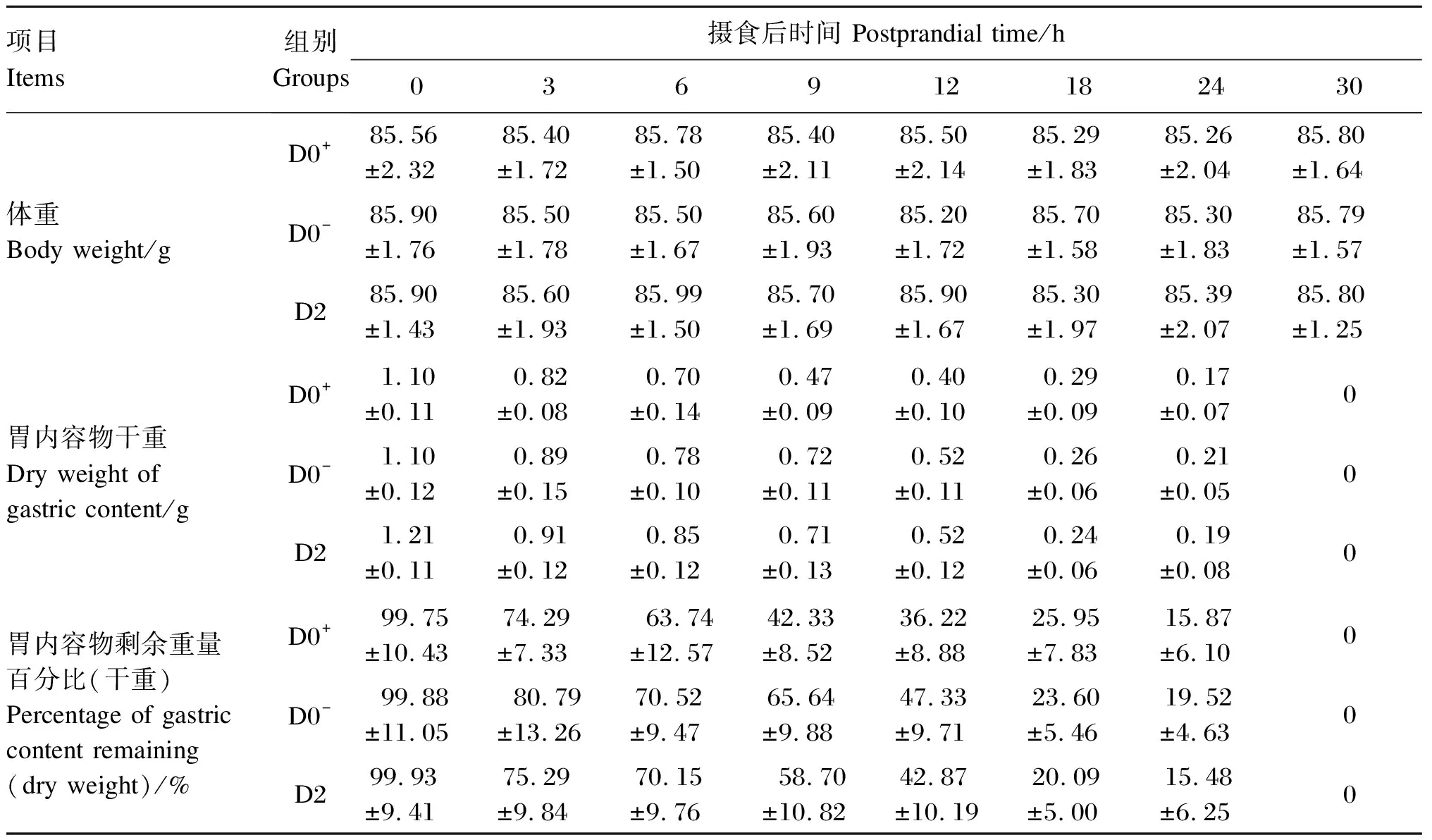
表4 各组大口黑鲈摄食不同饲料的体重与胃内容物重量(干重)
2.4 各组胃排空过程中消化酶活性的变化
由图3至图5可知,各组胃肠道中的淀粉酶、蛋白酶和脂肪酶活性均呈先升高后降低的趋势,D0+组摄食后9 h时胃肠道中的淀粉酶、脂肪酶和蛋白酶活性达到最高值,而D0-组和D2组则在摄食后9 h时胃蛋白酶活性达到最高值,显著高于同组其他时间点(P<0.05),12 h时胃肠道中的淀粉酶、脂肪酶及肠道蛋白酶活性达到最高值,显著高于同组其他时间点(P<0.05)。
通过比较各组各时间点3种消化酶活性(图6)可知,刚摄食后,D0-组胃淀粉酶和胃蛋白酶活性显著高于D0+组和D2组(P<0.05),而D0+组肠道淀粉酶活性显著高于其余2组(P<0.05),肠道蛋白酶活性显著低于D0-组和D2组(P<0.05);3组胃脂肪酶活性除6 h外其余时间点差异不显著(P>0.05)。随着时间的推移,胃肠道3种消化酶的活性也发生了变化,在摄食后6 h时D0+组胃蛋白酶、淀粉酶以及肠道脂肪酶活性显著高于其余2组(P<0.05),摄食12 h后D0+组胃肠道的淀粉酶和胃蛋白酶活性显著低于其余2组(P<0.05)。

图2 3种数学模型对各组大口黑鲈胃内容物剩余重量百分比变化的拟合结果
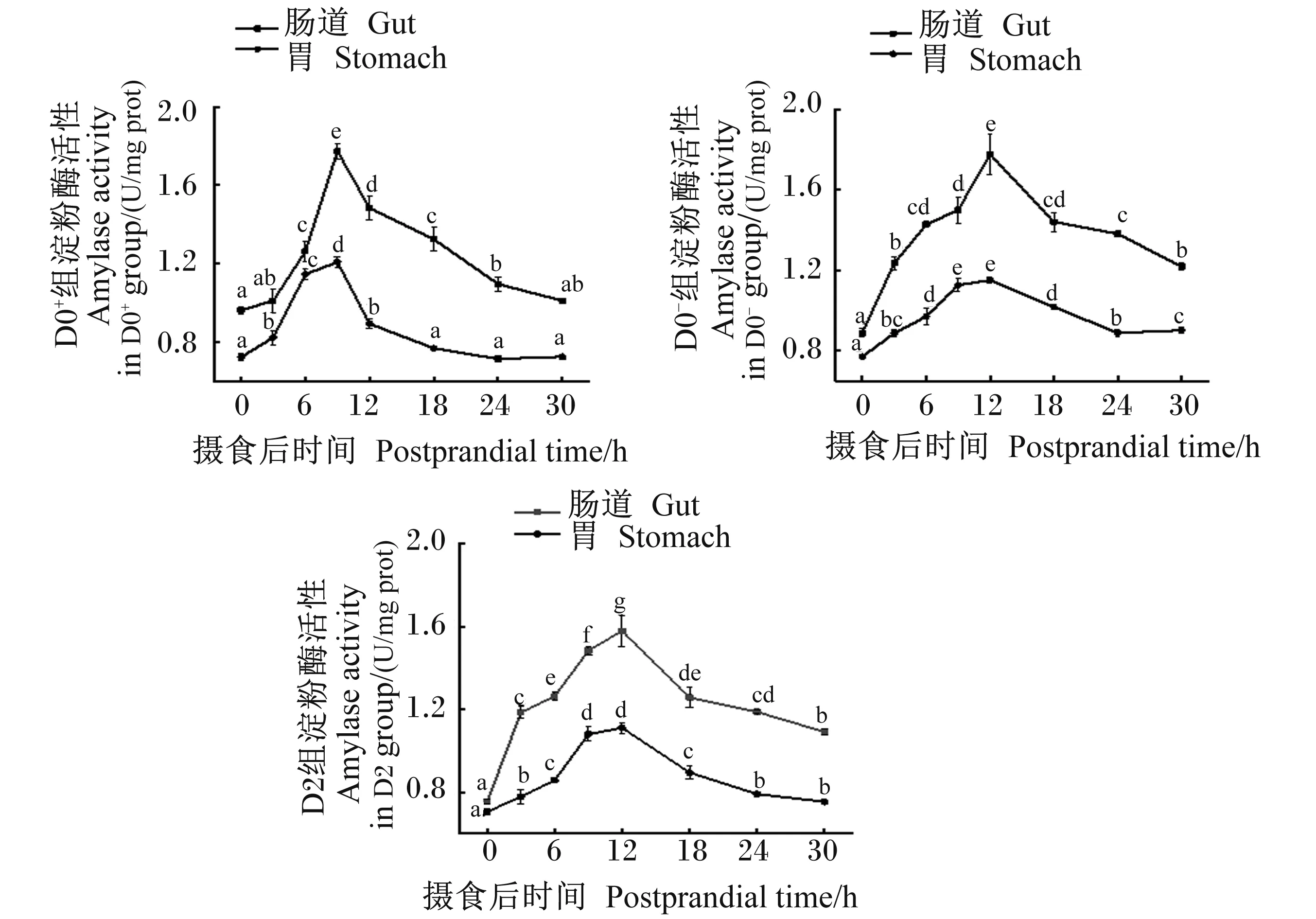
图3 各组大口黑鲈摄食不同饲料30 h内胃肠道淀粉酶活性变化

图4 各组大口黑鲈摄食不同饲料30 h内胃肠道蛋白酶活性变化

图5 各组大口黑鲈摄食不同饲料30 h内胃肠道脂肪酶活性变化
3 讨 论
3.1 不同饲料对大口黑鲈鱼胃排空特征的影响
虽然鱼类种属繁多,有着不同的生活习性与摄食习惯,但主要胃排空类型分为3种:第1种类型为先快后慢型,当食物到达鱼类胃部后,先经过一段时间的快速排空,随后随着时间的增加胃排空速率逐渐减慢,如摄食浮游生物的鳀鱼(Engraulis)[18]和玉筋鱼(Ammodytespersonatus)[5],投喂饲料的斑点叉尾[12]和瓦氏黄颡鱼(Pelteobagrusvachelli)[19];第2种类型为直线下降型,鱼类摄食后其胃内容物重量随时间的推移呈线性下降趋势,如许氏平鲉(Sebastesschlegelii)[20]、黑鲷(Sparusmacrocephalus)[21]等肉食性鱼类;第3种类型为先慢后快再慢型,鱼类摄食后其初始胃排空速率较低,随后排空速率开始加快,最后又降低排空速率直至胃内容物排空,如厚颌鲂幼鱼(Megalobramapellegrini)[22]、云龙石斑鱼(E.moara♀×E.lanceolatus)[23]和虹鳟(Oncorhynchusmykiss)[24]等。本研究发现,摄食不同饲料后的大口黑鲈胃排空特征不尽相同,但都呈现出先慢后快再慢的特点,D0+组和D0-组尤为明显,胃内容物剩余重量百分比分别于9和18 h明显下降。这说明不同饲料对于大口黑鲈胃排空的总体趋势影响不大,在使用不同品质鱼粉制作的饲料投喂欧白鲑(Coregonusalbula)[25]及不同蛋白质水平的饲料投喂虹鳟[24]时也得到了类似的结果。

图6 各时间点内3组大口黑鲈摄食不同饲料的胃肠道消化酶活性的比较
3.2 不同饲料对大口黑鲈最优模型的影响
在本试验中,3组大口黑鲈胃内容物水分含量均在摄食3 h后上升,自6 h开始基本保持不变,这种现象是鱼类消化饲料的主要步骤之一[12]。研究表明,鱼类胃内容物中的水分含量对胃排空模型的建立有一定的影响[26],用湿重来模拟鱼类胃排空有可能高估胃内容物的实际含量。本研究中,各组胃内容物剩余湿重百分比在0~6 h会有个别取样点超过100%的现象,在虹鳟[13]和南方鲇幼鱼[27]等试验中均出现此现象,这种现象会导致拟合模型的可靠性降低。从本试验湿重拟合结果来看确实如此,各组各模型的R2只有D2组的线性模型高于0.900。因此,本试验采用胃内容物干重来模拟评估大口黑鲈胃排空模型。
由于鱼类胃排空机制复杂多样,因此很难用统一的模型表现不同鱼类胃排空方式。文献报道的拟合模型就有10余种,如平方根模型、指数模型、线性模型、幂函数模型、逻辑斯蒂克模型、Gompertz模型、倒数模型等[1]。其中最为常用的拟合模型是线性模型、指数模型以及平方根模型[28]。目前研究表明,眼斑拟石首鱼(Sciaenopsocellatus)[29]、许氏平鲉[20]、大眼梭鲈(Stizostedionvitreumvitreum)[30]等鱼类的胃排空方式适用线性模型拟合,而俄罗斯鲟(Acipensergueldenstaedtii)幼鱼[31]、厚颌鲂幼鱼[22]、鲇鱼[11]等鱼类的胃排空方式适用平方根模型拟合;斑点叉尾[12]、瓦氏黄颡鱼[19]和银大麻哈鱼(Oncorhynchuskisutch)[32]等鱼类的胃排空方式适用指数模型拟合。在本试验中,3组数据能较好地用3种模型进行拟合,由结果可以看出经D0+组指数模型和平方根模型的R2、RSS以及SDR差异不大,综合比较后,D0+组胃排空规律的最佳模型是指数模型,D0-组和D2组的最佳模型是平方根模型,其方程式分别为Y=99.080e-0.084t、Y0.5=9.972-0.257t和Y0.5=9.868 9-0.274t,通过计算可知50%和80%胃排空的理论时间,D0+组分别为8.14和19.04 h,D0-组分别为11.28和21.40 h,D2组分别为10.21和19.67 h。3组50%和80%胃排空时间有一定差异,D0+组最短,可能是因为D0+组饲料中蛋白质水平高于其他2组,尤其是鱼粉中存在“未知生长因子”,使得饲料更容易被机体消化分解;D2组胃排空后期时间缩短,可能与小肽促进营养物质的吸收功能有关。
有研究表明,当鱼类胃内容物排出超过50%后,其食欲的恢复也超过50%[33],当排空超过80%时,其食欲完全恢复[34]。在理想情况下,当鱼类的食欲恢复时,立即获得饲料,才能保证良好的生长,并避免过度投喂所造成的养殖水体污染。但张鹏飞等[35]认为胃排空率达到80%作为投喂最佳时间间隔的判定指标并不充分,还要考虑到鱼类的摄食节律,郭浩宇等[20]在许氏平鲉幼鱼的研究中认为,投喂间隔时间应结合养殖过程中的实际观察;朱云海等[36]在日本黄姑鱼(Nibeajaponica)的研究中认为,投喂间隔时间应该在食欲开始恢复和完全恢复之间。因此,综合3组拟合结果大口黑鲈投喂间隔时间应为8~21 h,此时食欲已得到较大程度的恢复, 能取得较好的投喂效果。谢苏明等[37]研究大口黑鲈投饲频率后发现,分别于每天06:00和18:00各投喂1次的生长率、抗氧化能力优于其他组,间隔时间为12 h,与本试验结论基本吻合。
3.3 胃排空过程中消化酶活性的变化
消化酶在鱼类生长发育过程中有着极其重要的作用,根据消化对象的不同,大致可分为蛋白酶、淀粉酶、脂肪酶和纤维素酶等几种[38]。鱼类在摄食消化过程中,随着时间的推移,消化酶的活性也发生相应的变化,消化道中酶的数量经过一段时间达到峰值,之后便会随着饲料的减少而减少,消化道排空时最少[39]。
在本试验中,3组大口黑鲈胃肠道中的蛋白酶、淀粉酶和脂肪酶活性随着时间的推移都呈现先升高后降低的规律性时序变化和组织差异性,这与在斑点叉尾[12]、云龙石斑鱼[23]、全雄黄颡鱼(all-malePelteobagrusfulvidraco)[40]和罗非鱼(Oreochromismossambicus)[41]的研究结果一致。D0+组饲料蛋白质水平及鱼粉用量高于其他2组,机体更容易获取所需要的营养,因此,胃肠道的淀粉酶和蛋白酶活性变化速率要快于其余2组,这与D0+组胃排空变化速率快于其余2组的结果相吻合;而D0-组和D2组为了获得足够的营养,机体通过增强胃肠道消化酶活性的方式来强化营养物质的消化吸收,因此消化酶活性在前期达到峰值要慢于D0+组。本研究中,D2组大口黑鲈6~9 h胃内容物排空速度高于D0-组,其9 h胃蛋白酶活性也显著高于D0-组,9~30 h肠道的蛋白酶活性都显著高于D0+组和D0-组,可能因为饲料中添加的小肽在胃部经过胃蛋白酶-盐酸系统的分泌和消化作用释放到达肠道,经肠道中PepT1跨膜运输进行完整的转运吸收[42],在此过程中通过激活细胞膜上的受体或与细胞内受体结合等方式,引起细胞信号传递,诱导胃肠道内分泌细胞分泌多种激素[16],进而提高胃肠道内消化酶的活性[43],增强肠道对蛋白质的吸收利用。
但是从生长结果来看,3组之间差异不显著,这与我们前期在(11.04±0.05) g的大口黑鲈鱼研究[17]中得出来的结果基本一致。目前,尚未见到关于胃排空特征和消化酶活性与生长性能差异的报道,基于本试验现有结果,推测饲料蛋白质水平的变化以及小肽的添加均能引起消化酶活性改变,以保持胃排空时间的相对恒定,进而保证了各组大口黑鲈对营养物质的吸收利用相对稳定,从而导致了各组生长性能差异不显著。
4 结 论
综上所述,改变饲料蛋白质水平(3%以内)或在饲料中添加2%小肽对大口黑鲈总体胃排空时间及胃排空变化趋势影响不显著,胃排空方式为先慢后快再慢型,以平方根方模型为最优;摄食不同饲料后的大口黑鲈胃肠道消化酶活性均呈各自的规律性变化,以维持胃排空时间的相对恒定,因此不需要改变投喂频率。结合生产实践,建议大口黑鲈投喂间隔时间为8~21 h,每日投喂2次。

