急性脑梗死患者血清MMP-9、miR-221表达水平检测及临床价值探索
冯佳佳, 刘 丹, 张广炜, 金丽霞
急性脑梗死(acute cerebral infarct,ACI)是神经内科及急诊科最常见的急危重症之一。据统计,在我国ACI约占脑卒中总发病率的80%[1],其致残率、致死率、复发率极高。但ACI的早期诊断仍局限于影像学,具有诊断意义的循环标志物尚未发现。近年来诸多研究证实,约20%的miRNAs在ACI患者的外周血中表达异常且与其病理相关[2]。基质金属蛋白酶(matrix metalloproteinase,MMPs)是一组蛋白水解性锌依赖内肽酶,参与中枢神经系统疾病的病理生理过程[3]。其中MMP-9在ACI的研究已经有一定的历史背景,但miR-221在脑血管疾病领域的研究尚少。因此本研究旨在探讨ACI患者血清MMP-9、miR-221表达水平,并分析二者联合检测对ACI的诊断价值,若能达到预期结果,二者联合检测有望成为ACI的诊断性循环标志物。
1 资料与方法
1.1 临床资料 选取2020年12月-2021年12月在我科收治的ACI患者50例为病例组,同期健康体检者50例为对照组。纳入标准:(1)符合1996年全国第四届脑血管病学术会议修订的脑梗死诊断标准,且经头部CT或MRI检查证实;(2)满足CISS分型标准,CISS分型为动脉粥样硬化性脑梗死;(3)年龄≥18岁,发病时间≤7 d。排除标准:(1)既往有脑出血病史或CT显示脑出血;(2)有明显的心、肝、肾功能不全及恶性肿瘤;(3)存在心房颤动等严重心律失常;(4)心源性栓塞所致的脑卒中患者。本实验通过科研伦理委员会批准,所有研究对象均签署知情同意书。
1.2 实验方法
1.2.1 ELISA检测血清MMP-9的含量 用干燥管收集患者入院次日清晨空腹肘静脉血4 ml,常温下3000 rpm离心5 min,用高压灭菌的EP管收集分离后的上层血清,-80 ℃保存,采用酶联免疫吸附(ELISA)法检测MMP-9的含量,操作流程严格按照ELISA试剂盒说明书(武汉新启迪生物科技有限公司)进行。
1.2.2 qRT-PCR检测血清miR-221的表达水平 用EDTA管收集患者入院次日清晨空腹肘静脉血2 ml,采用实时荧光定量PCR(qRT-PCR)法检测miR-221的表达水平。按照Trizol试剂说明书(Invitrogen life technologies公司)抽提血清总RNA。cDNA合成:取总RNA样品800 ng(8 μl),加入缓冲液,Mix共20 μl,RT反应条件为:16 ℃,30 min;42 ℃,40 min;85 ℃,5 min,-20 ℃保存。实时定量PCR:U6作为内参,在cDNA样品中加入SYBR Green进行PCR扩增,PCR循环参数:95 ℃ 10 min;95 ℃ 10 s;60 ℃ 60 s共40个循环,用2-△△Ct计算miR-221的相对表达量。
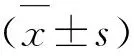
2 结 果
2.1 病例组和对照组临床资料比较 两组患者在年龄、TC、TG、LDL-C和HDL-C水平比较,差异无统计学意义(P>0.05)。而性别、高血压、糖尿病和高脂血症比较,差异有统计学意义(P<0.05)(见表1)。

表1 病例组与对照组临床资料比较
2.2 病例组与对照组血清MMP-9和miR-221表达水平比较 病例组患者血清MMP-9的表达水平(1.77±0.55)(μg/L)显著高于对照组(1.01±0.22)(μg/L),差异有统计学意义(P<0.001,见图1A);病例组患者血清miR-221的表达水平(2.29±2.51)显著高于对照组(1.13±1.09),差异有统计学意义(P<0.01,见图1B)。

注:病例组与对照组比较**P<0.01,***P<0.001图1 A:对照组与病例组血清MMP-9的比较;B:对照组与病例组血清miR-221的比较
2.3 病例组与对照组临床资料及血清MMP-9、miR-221的相关性分析 ACI与性别、高血压、糖尿病、高脂血症、MMP-9、miR-221呈正相关(P<0.05,见表2);ACI患者的MMP-9与miR-221不相关(r=0.193,P=0.055)。
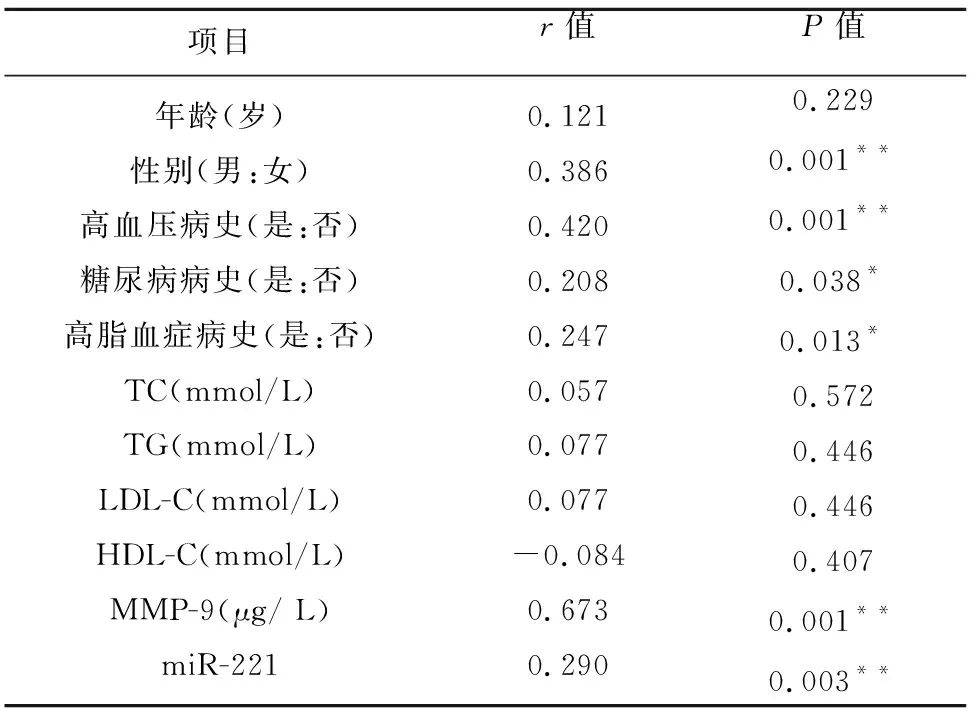
表2 病例组与对照组临床检验和实验指标的相关性分析
2.4 急性脑梗死发病危险因素的Logistic回归分析 以急性脑梗死为因变量,性别、高血压、高脂血症、MMP-9、miR-221为自变量,进行二元Logistic回归分析,在校正其他危险因素后,结果显示性别、高脂血症、MMP-9、miR-221有统计学意义(P<0.05),是ACI发病的独立危险因素(见表3)。
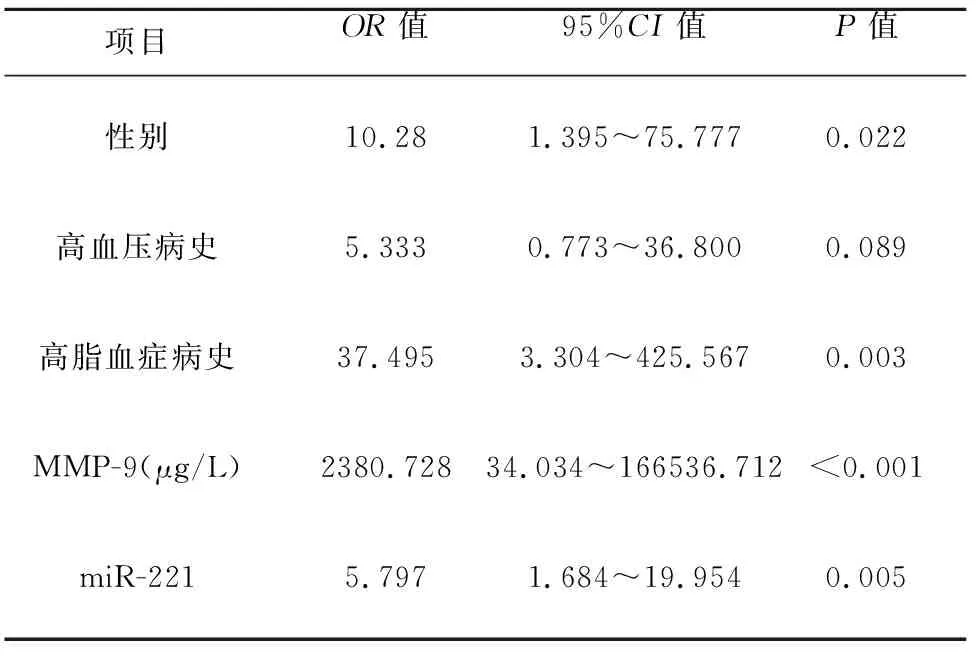
表3 急性脑梗死发病危险因素的Logistic回归分析
2.5 血清MMP-9、miR-221诊断急性脑梗死的ROC曲线 以预测概率做ROC曲线(见表4、图2),结果显示:MMP-9、miR-221的AUC分别为0.899、0.746,联合检测的AUC为0.924,此时的敏感度为82%,特异性为98%。经过ROC分析曲线下成对样本区域差异计算得出,预测概率与MMP-9之间AUC差异具有统计学意义(P=0.041<0.05)。由此得出,MMP-9、miR-221联合检测较单项检测更有助于ACI的诊断。
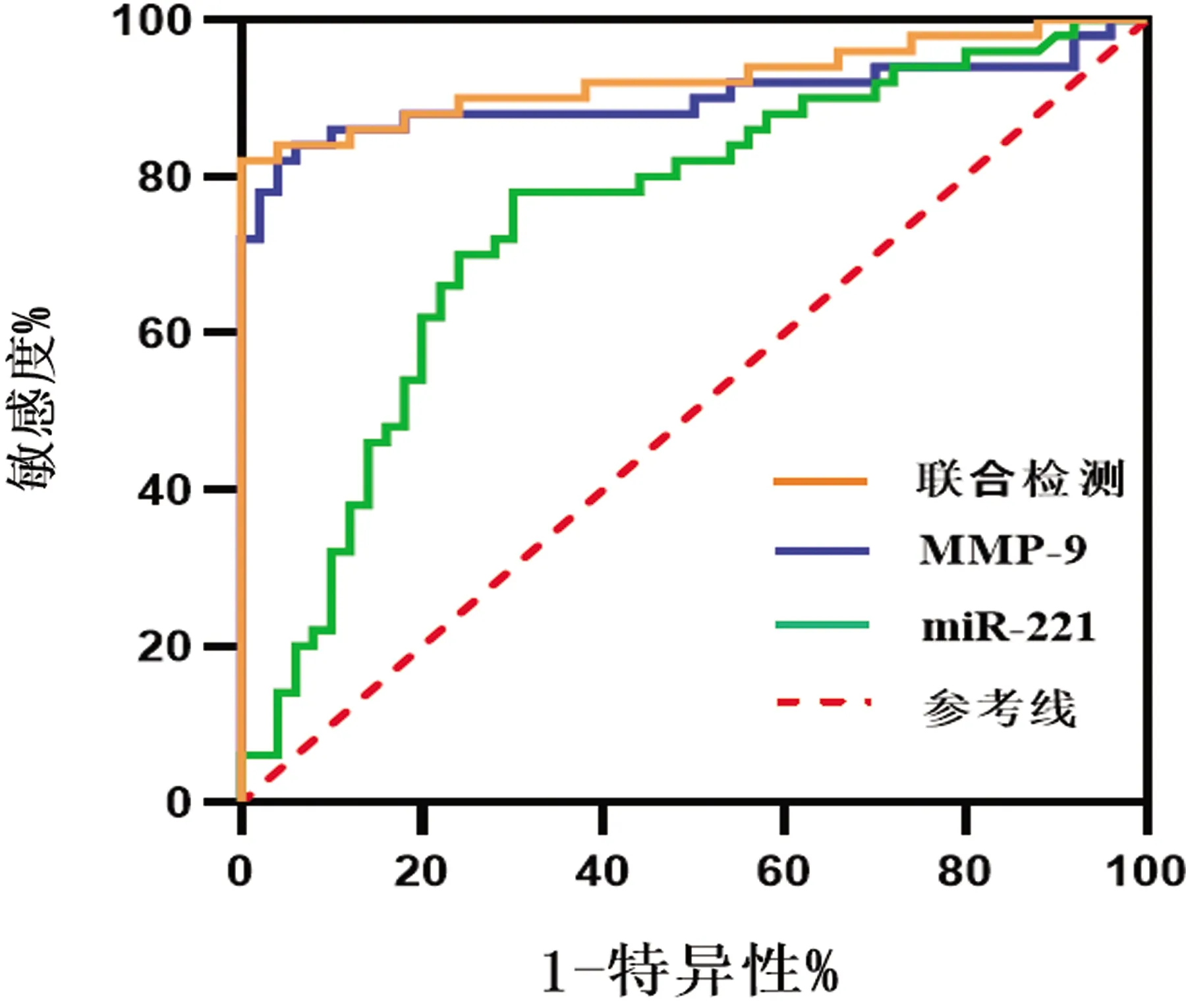
图2 血清MMP-9、miR-221、联合检测诊断急性脑梗死的ROC曲线
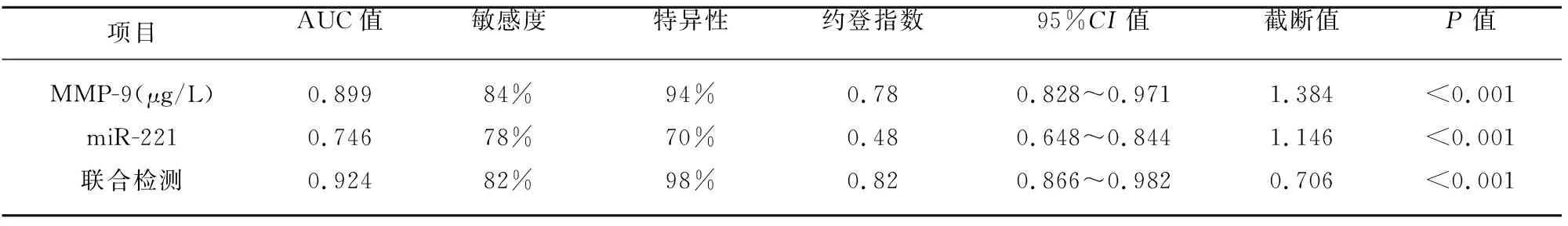
表4 ROC曲线分析
3 讨 论
动脉粥样硬化是ACI最重要的病理因素,颈动脉粥样硬化不稳定斑块已被列为ACI的极高危险因素[4]。MMP-9通过降解胶原纤维及细胞外基质,使得纤维帽薄弱、颈动脉斑块不稳定,从而形成血栓诱发脑梗死[5]。前期研究已经证实MMP-9在脑梗死发病2 h内会升高[6],超急性期脑梗死患者血清MMP-9水平与病情严重程度和梗死体积显著相关[5]。
本实验结果显示,与对照组相比,病例组患者血清MMP-9水平显著增高,且与ACI呈正相关,Logistic回归分析显示MMP-9是ACI发病的独立危险因素。ROC曲线分析显示,当MMP-9≥1.384(μg/L)时所对应的敏感度是84%,特异性为94%,AUC为0.899,对ACI的诊断价值较高。Choi[7]等人通过大脑中动脉短暂闭塞动物模型发现,MMP-9是ACI潜在生物学标志,可作为辅助功能评估脑梗死。本实验结果与前期研究结果相符,更加佐证了MMP-9有望成为诊断脑梗死的循环标志物之一。
MiRNAs是一种小的非编码RNA,通过识别同源序列和干扰转录、翻译或表观遗传过程来调节基因的表达,参与了许多复杂生物网络通路的调节[8]。近年来越来越多的证据表明,循环miRNAs能够调节ACI病理过程的靶点,被认为是ACI潜在的诊断性循环标志物[9]。例如:Zhou[10]等人报道miR-21和miR-24的血浆水平可能作为ACI的关键分子介质;Wu[11]等人认为ACI患者血浆中miR-99b表达下调,有可能成为诊断ACI的潜在指标。
本实验主要探讨的是病例组血清miR-221的表达水平与对照组之间的差异,结果显示病例组血清miR-221水平显著高于对照组,Logistic回归分析显示:miR-221是ACI发病的独立危险因素。ROC曲线显示:当miR-221≥1.146时所对应的敏感度是78%,特异性为70%,AUC为0.746,对ACI的诊断价值具有中度准确性,MMP-9与miR-221联合评估时AUC为0.924,对ACI具有较高的诊断效能。Sofie[12]等人研究发现ACI患者外周血中miR-221-3p与健康对照组相比表达上调。Tsai[13]等人研究发现,miR-221在健康人群中的平均表达水平最低,其次是动脉粥样硬化组,脑卒中患者组中表达最高。Sandra[14]等人研究显示miR-221在进展性颈动脉粥样硬化患者中表达显著增高。我们的实验结果与前期研究结论相符。无独有偶,研究发现在急性心肌梗死患者血清中miR-221的表达水平显著高于健康对照组[15];在急性肺栓塞患者血清中miR-221水平也显著高于健康人群[16]。我们的实验结果显示性别、高脂血症也是ACI发生的危险因素,与大量的回顾性研究结果相吻合[17]。
本研究的不足之处首先在于研究对象的数量和地域有一定的局限性;其次,本次研究ACI患者的血液样本是在临床事件发生后采集的,所以因果关系只能推断;再次,在本实验所收集的样本中,对照组和病例组之间是否患有糖尿病是存在显著差异的,而既往研究表明高血糖可诱导miR-221表达上调[15];最后,药物治疗是否会影响ACI患者血清MMP-9、miR-221表达水平我们尚不清楚。这些都可能是导致此次实验结果的原因。未来期望继续扩大样本及严守质控来验证实验结果。
综上所述,MMP-9和miR-221的表达与ACI的发生密切相关,且二者联合检测有助于ACI的早期诊断,有更高的敏感性和特异性,有望成为ACI早期诊断理想的组合靶标,值得在临床上进一步的研究和推广。

