伴麻痹性痴呆的神经梅毒患者的临床特征及诊断指标分析
丁琦超, 陆 悦, 孙 旭, 毕晓莹
神经梅毒是由苍白密螺旋体侵入神经系统造成的疾病,可以发生在梅毒的各个时期,晚期更加多见。其临床表现多样[1],按照受累部位分为间质性神经梅毒和实质性神经梅毒,前者包括脑膜血管型神经梅毒、脑膜炎型神经梅毒,后者主要包括GPI、脊髓痨等。目前大部分研究单纯归纳GPI患者的临床特征、影像学数据等,还有一些研究关注于GPI与其他类型痴呆的对比[2,3],但据了解,少有研究关注和探索有助于临床医师识别伴GPI神经梅毒患者的生物学标记物及影像学特征。本研究通过比较GPI患者与不伴GPI神经梅毒患者的临床特征、实验室及影像检查结果,寻找有助于诊断伴GPI的神经梅毒患者的血清学指标,降低GPI在神经梅毒患者中的漏诊率以及误诊率,实现早期诊断和治疗。
1 对象与研究方法
1.1 本研究纳入了2010年1月1日-2021年6月1日年间就诊于海军军医大学第一附属医院确诊的104例神经梅毒患者的人口学资料、临床症状、实验室检验结果、影像学数据等,纳入标准:(1)首先入组患者需符合神经梅毒的诊断标准:①CSF FTA-ABS(荧光梅毒螺旋体抗体吸收试验)和/或VDRL(性病研究实验室试验)阳性,无法开展以上检查时,可用TPPA(梅毒螺旋体明胶颗粒凝聚试验)和TRUST(甲苯胺红不加热血清试验)替代;②脑脊液中蛋白含量大于450 mg/L,白细胞数值大于5×106/L,且排除会造成以上指标异常的其他疾病[4]。(2)GPI患者符合以上神经梅毒的诊断,同时有认知功能受损和/或精神行为异常的临床表现,使用蒙特利尔认知量表评估认知功能(Montreal Cognitive Assessment,MoCA)。排除标准:(1)患有其他可能影响认知功能的疾病,例如血管性痴呆、阿尔兹海默症等;(2)患有其他精神障碍,例如精神分裂症、抑郁症等;(3)合并有艾滋病的患者。
1.2 研究分组 根据以上纳排标准,将患者分为神经梅毒伴GPI患者组(n=59)与神经梅毒不伴GPI患者组(n=45)。
1.3 评估标准 利用MoCA量表评估患者的认知功能,主要包括:视空间与执行能力(5分)、命名能力(3分)、注意力与计算力(6分)、语言能力评定(3分)、抽象能力(2分)、延迟回忆(5分)及定向力(6分),如果受教育年限<12 y加1分,得分<26的患者被认定为存在认知功能障碍。
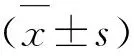
2 结 果
2.1 两组患者的基本资料 两组患者的年龄、性别、BMI、不洁性生活史、脑梗病史、高血压病、糖尿病及高脂血症等基本资料比较,差异均无统计学意义(P>0.05)(见表1)。
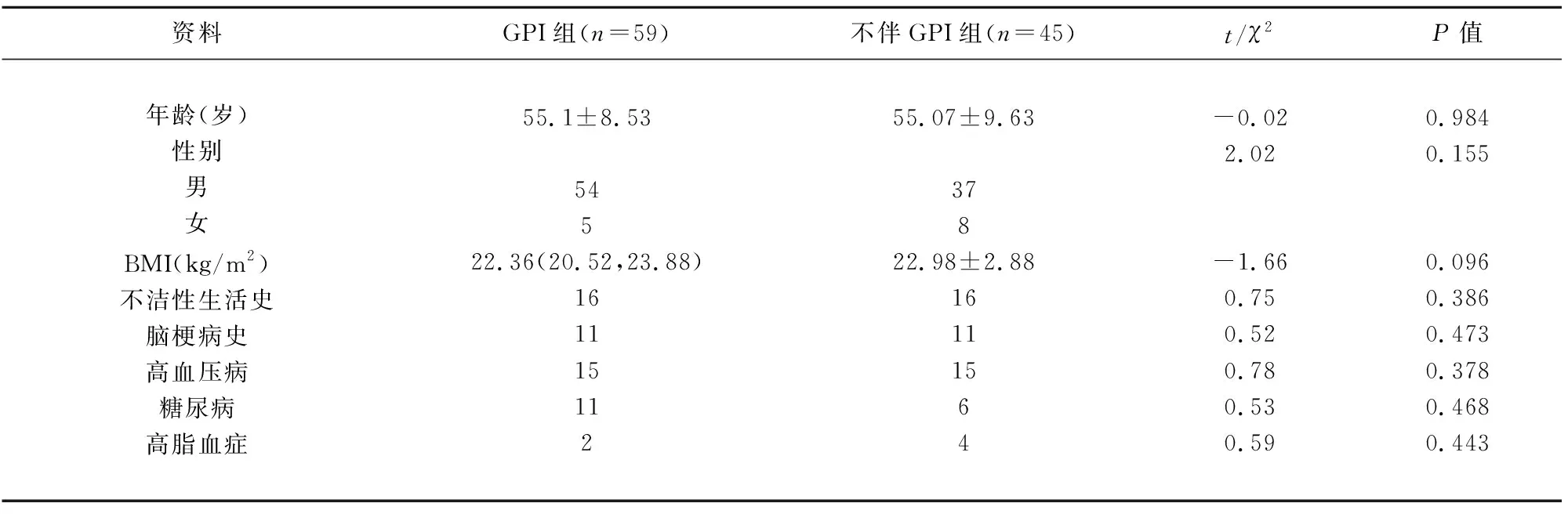
表1 两组患者的基本资料比较(n=104)

表2 两组患者的临床表现对比(n=104)
2.3 两组患者的实验室检验结果 与不伴GPI组相比,伴GPI组患者外周血的中性粒细胞数、NLR、脑脊液蛋白含量更高,差异具有统计学意义(t中性粒细胞=-2.6,P中性粒细胞数=0.009,tNLR=-3.09,PNLR<0.001,t脑脊液蛋白=-2.73,P脑脊液蛋白含量=0.006)两组患者外周血的红细胞数目、白细胞数目、血小板、中性粒细胞数、淋巴细胞数、HDL、LDL、总胆固醇、肌酐、尿素、尿酸、脑脊液有核细胞数、脑脊液压力等指标比较,差异无统计学意义(P>0.05)(见表3)。
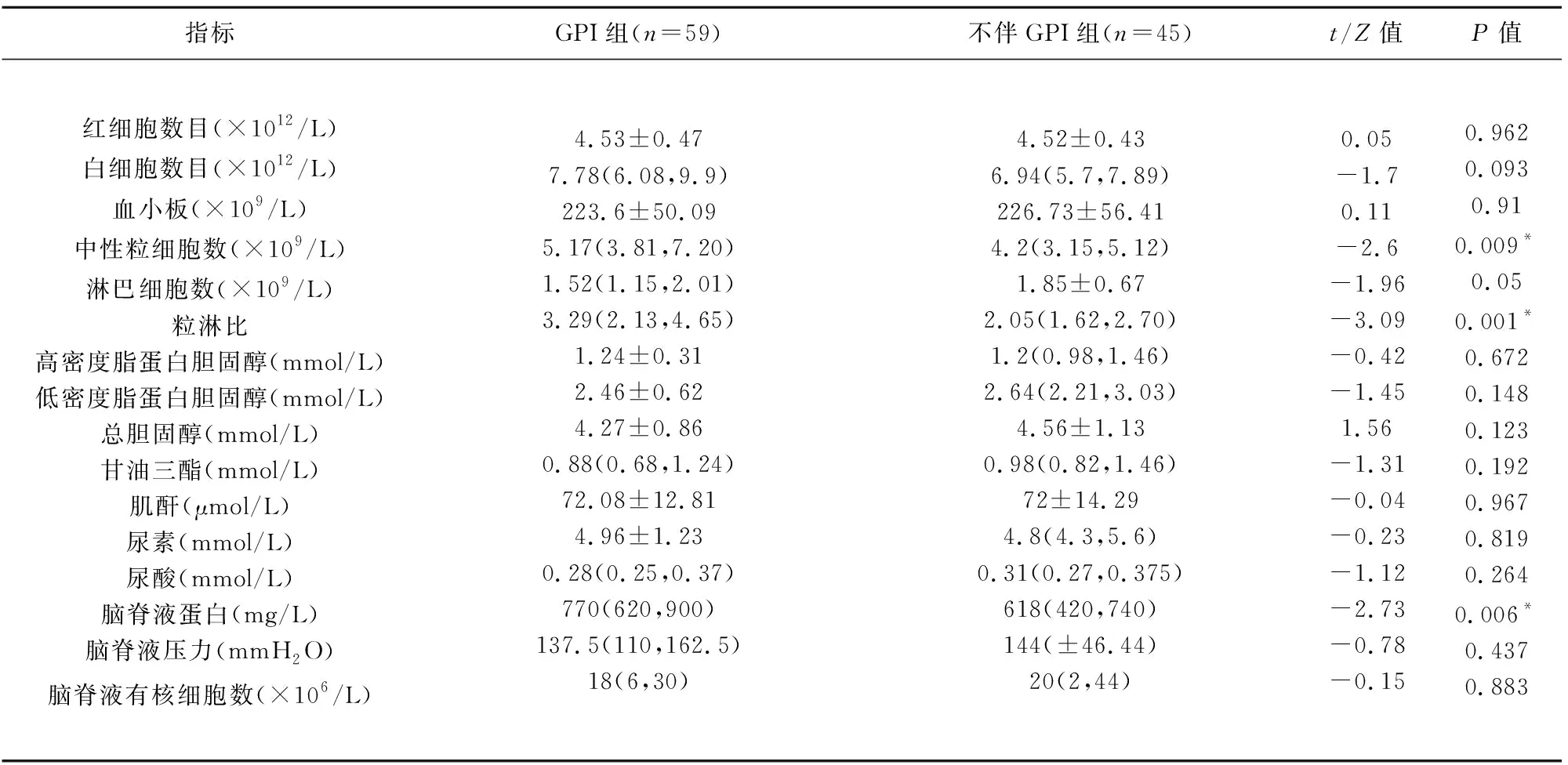
表3 两组患者的实验室检验指标比较
2.4 两组患者的头部影像学特征 本研究纳入的104例患者中,由于各种原因,最终有75例患者配合完成了头部MRI的检查,其中两组患者影像学上最常见的表现是缺血性卒中(49例),但是伴GPI组缺血性卒中的类型以腔隙性脑梗死为主(23/26,88.46%),主要分布在额叶皮质下、基底节区、颞叶,而提示新发脑梗死的仅3例,梗死部位为侧脑室旁(2例)、顶叶(1例);不伴GPI组MRI表现为缺血性卒中的患者以新发脑梗死为主(18/23,78.26%),梗死部位主要为侧脑室旁(5例),基底节区(4例),颞叶(4例),脑干(4例),顶叶(2例),额叶(2例),枕叶(2例),小脑(1例)(见表4)。
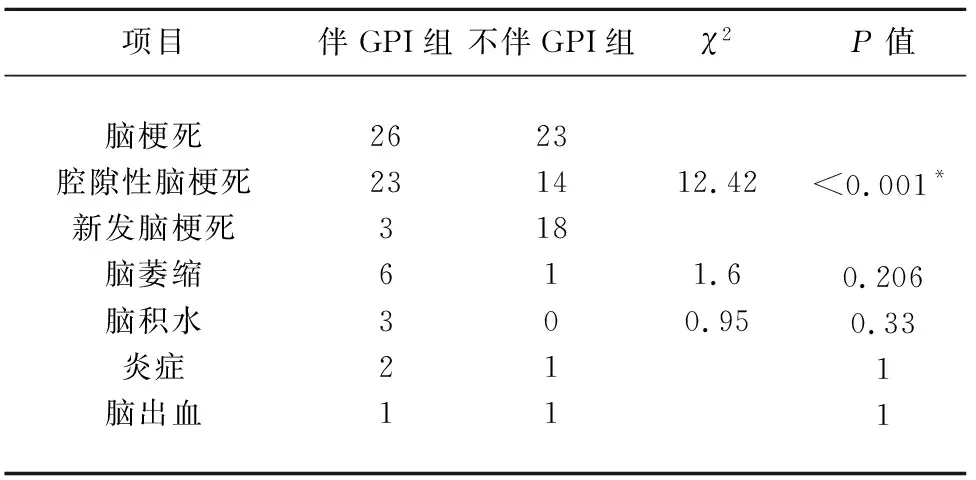
表4 两组患者头部MRI表现
2.5 ROC曲线分析显示血清中性粒细胞数的AUC值为0.679(95%CI0.56~0.79,P<0.05),NLR的AUC值为0.697(95%CI0.58~0.81,P<0.05),脑脊液蛋白的AUC值为0.648(95%CI0.52~0.77,P<0.05)(见图1)。血清中性粒细胞诊断神经梅毒伴GPI的最佳界值为≥5.2×109/L,灵敏度50%,灵敏度81.1%,NLR的最佳界值为≥2.8,此时灵敏度为60.4%,特异度78.4%,脑脊液蛋白量的最佳界值为≥755 mg/L,灵敏度为54.2%,特异度为78.4%。我们分别将分类变量NLR≥2.8,脑脊液蛋白≥755 mg/L,临床表现有无肢体无力作为自变量纳入二元Logistic回归方程[由于中性粒细胞的界值无明显诊断意义(灵敏度50%),故未纳入],得到两变量(NLR+脑脊液蛋白含量)的预测模型的AUC可以达到0.746(95%CI0.64~0.85,P<0.001);另一两变量(NLR+临床表现有无肢体无力)预测模型的AUC值可以达到0.766(95%CI0.67~0.87,P<0.001);三变量(NLR+脑脊液蛋白含量+临床表现有无肢体无力)的AUC值可以达到0.83(95%CI0.74~0.92,P<0.001)(见图2)。
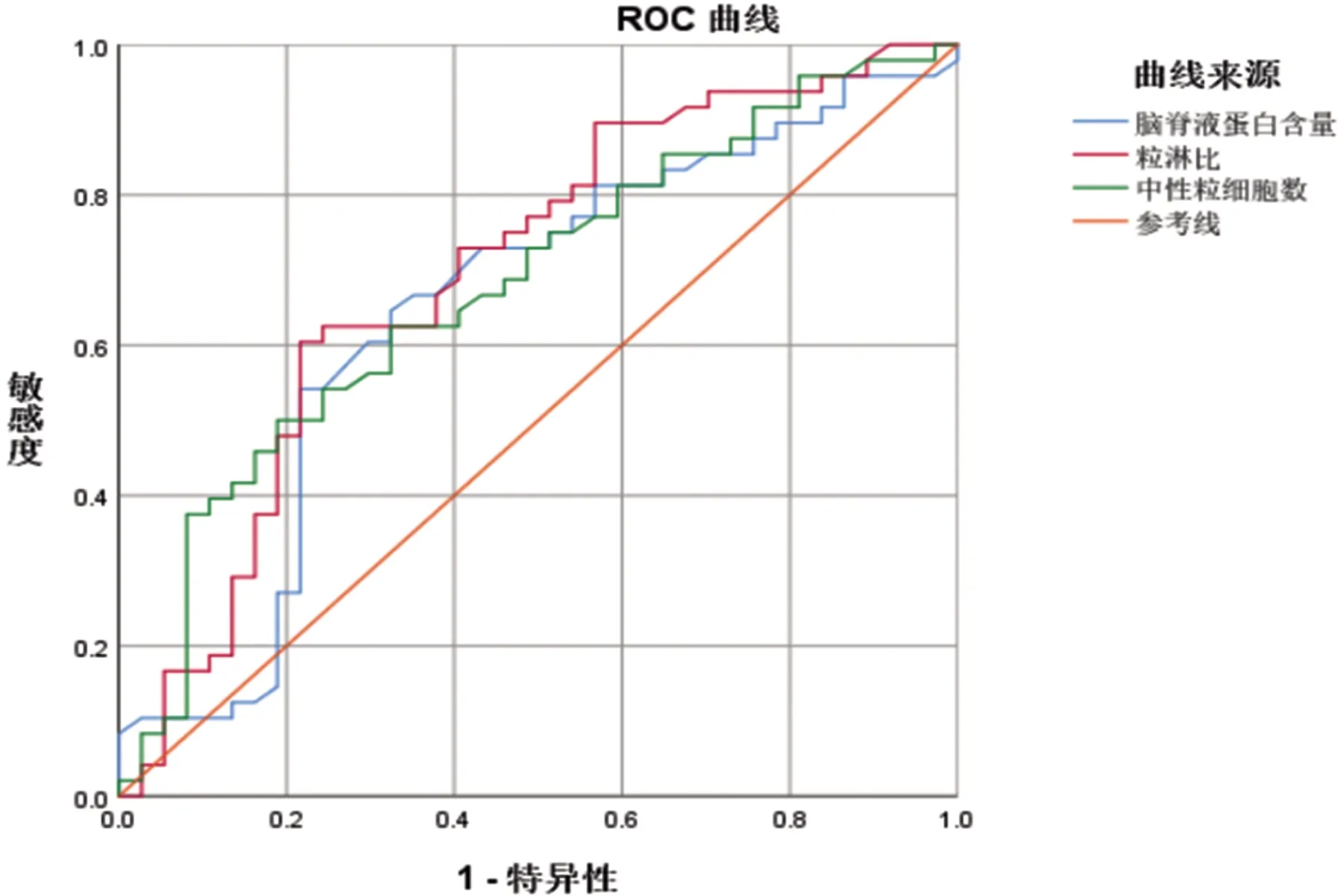
图1 图中为NLR,脑脊液蛋白含量,血清中性粒细胞数的ROC曲线

图2 图中为分类变量NLR≥2.8,脑脊液蛋白≥755 mg/L,临床表现有无肢体无力,以及两变量(NLR+脑脊液蛋白含量)的预测模型、两变量(脑脊液蛋白含量+临床表现有无肢体无力)、三变量(NLR+脑脊液蛋白含量+临床表现有无肢体无力)的ROC曲线
3 讨 论
GPI是神经梅毒晚期最常见的并发症之一,约占神经梅毒病例的38.9%~49%,主要表现为进行性的认知障碍,常伴有精神行为异常[5]。但由于当今抗生素的广泛使用,GPI的临床症状越来越不典型,呈现多样化,给临床医师的鉴别诊断工作增加困难,早期易被误诊为精神分裂症、病毒性脑炎、情绪障碍等,有研究报道误诊率可达63.53%[6],大大增加了患者的医疗负担,也不利于患者的预后。
本次研究发现不伴GPI组患者表现为肢体无力症状的比例显著高于GPI组患者,纳入二元Logistic回归得到有无肢体无力的临床表现可以作为伴GPI神经梅毒患者的独立预测因素(OR=4.86,95%CI1.93-12.2)。结合两组部分患者头部MRI,不伴GPI组表现为新发脑梗死的患者显著多于GPI组,且梗死部位多位于侧脑室旁、基底节区、颞叶等大脑中动脉供血区,这与脑膜血管神经梅毒的特征影像学表现相符[7]。该区域受累较容易出现肢体无力、偏身感觉障碍等症状。从病理生理机制上讲,脑膜血管型梅毒通常在感染梅毒螺旋体的早期(1~10 y)发病[8],由于苍白螺旋体侵入患者脑膜,促使血管周围淋巴浆细胞浸润,造成局灶性动脉内膜炎,易发生脑卒中事件,大脑中动脉是最常见的受累动脉,发生率为66%[9]。而GPI则主要由于病原体入侵脑实质造成,其主要的病理改变是神经纤维损害和神经元的数量减少,常在感染梅毒螺旋体的晚期10~20 y发生[10],且发展为晚期神经梅毒的患者不一定出现过早期神经梅毒的临床症状。两组患者在心血管疾病风险因素上(高血压、糖尿病、血脂、年龄、既往脑梗病史等)均不存在差异,所以我们推测这是两组患者血管本身存在的病理生理状态造成的。
根据我们的研究,神经梅毒患者脑脊液蛋白≥755 mg/L时,其伴发GPI的风险是脑脊液蛋白<755 mg的患者的5.02倍,而当NLR≥2.8时,伴发GPI的风险则是NLR<2.8的患者的4.31倍,但是这两项指标预测神经梅毒患者伴发GPI的概率的AUC分别为0.66、0.68,预测价值较低,于是我们将两项指标同时纳入预测模型,得到双变量模型的AUC为0.75(95%CI 0.64~0.85,P<0.001),有良好的预测价值,进一步将临床表现有无肢体无力作为变量纳入二元Logistic模型,最终得到的三变量模型(NLR+脑脊液蛋白含量+临床表现有无肢体无力)的AUC可以达到0.831 (95%CI0.74~0.92,P<0.001),取得了更好的预测价值。GPI组患者的脑脊液蛋白含量要高于认知正常组,可能与GPI患者的脑(脊)膜中产生的炎症反应更为剧烈[11],或者血脑屏障破坏的较为严重相关[12]。NLR是一种获取容易,价格低廉的评价人体炎症反应程度的指标,而且与中性粒细胞数目这单一指标相比,NLR不大容易受到体液失衡(如脱水)的影响,有研究发现NLR的水平与阿尔兹海默症(AD)呈正相关[13,14],还与患MCI的风险增加呈正相关,且当NLR≥2.07时MCI的风险会比NLR<2.07的人群高6倍[15],还有研究发现NLR与情绪、精神障碍同样存在相关[16],作为一种外周的血清学指标,它如何与认知损害相联系还尚未研究清楚,有的假说认为NLR较高的患者的血管内皮损害更严重,加重动脉粥样硬化,从而使得大脑内小动脉更容易产生梗死,引起脑白质的变性[17],较高水平的血清中性粒细胞数目,提示着人体内免疫系统的较高程度的激活,活化的中性粒细胞通过释放多种细胞因子,激活其他免疫细胞,诱导其穿透血管内皮细胞,迁移至炎症部位,启动炎症因子瀑布[18]。在这些机制作用下,GPI患者的中枢神经系统内促炎因子相对增多,进而诱发了大脑中免疫系统的异常激活,以及氧化应激反应,虽然这是机体的自身保护,但是也对颅内血管,大脑实质造成了损害[19,20]。
GPI的治疗目前以青霉素为主,经过规范化治疗,这种因梅毒螺旋体感染造成的“可逆性认知下降”往往可以得到改善。为了更好提高患者的远期预后以及对治疗的依从性,有研究指出在规范化驱梅治疗的前提下,使用头孢曲松钠与阿立哌唑联合治疗在改善患者精神症状方面取得了良好的效果[21],GPI早期使用多奈哌齐也能通过抑制小胶质细胞的活化,增加乙酰胆碱的含量,来改善患者认知功能[22],由此看来,早期诊断GPI,并早期介入干预治疗,可以使患者的治疗效果大大提高。
本研究的限制:首先,最大的限制在于本研究是一项横断面研究,样本量偏小,不同医师对患者进行的临床评估未能达到统一,且头部MRI的数据缺失较多。其次,此次研究未能纳入炎症因子(如IL-1、IL-8、TNF-α等)数据进行进一步研究,而根据此次研究的结果,我们发现炎症在GPI患者认知功能下降,精神情绪异常的发展进程中起着重要的作用,对炎症因子的研究或许可以更好的揭示其中的关系。
本研究,最终我们总结出当神经梅毒患者血清中NLR≥2.8,脑脊液蛋白含量≥755 mg/L,且临床表现不存在肢体无力时,我们应该警惕其伴发GPI的可能,早期对患者进行认知,精神行为量表的评估,及时施加药物及非药物干预,改善患者症状,以获得更好的预后。此次研究我们发现GPI似乎与外周炎症水平相关,而认知、情绪障碍与人体内炎症水平的相关性已经在许多研究中得到验证[23],未来仍有待对GPI患者的炎症因子(IL-1、IL-8、TNF-α等)等指标进行分析,有利于寻找更有效、更有针对性的药物。如今影像学飞速进展,利用静息态功能磁共振(rsfMRI)、动脉自旋标记灌注成像(ASL)、PET/SPECT等成像技术的研究越来越多,利用这些影像技术研究GPI患者与其他神经梅毒患者,或者其他痴呆类型的患者的差异,可能也将会是未来研究的方向。

