儿童嗜铬细胞瘤围手术期血压管理
柳征 柴成伟 杨纪亮 刘国昌 黄萍 邹焱
1 广州医科大学附属广州市妇女儿童医疗中心儿外科,广州 510120; 2 广州医科大学附属广州市妇女儿童医疗中心心内科,广州 510120
嗜铬细胞瘤(pheochromocytoma,PHEO)起源于肾上腺髓质、交感神经节或其他部位的嗜铬组织,可分泌过多的多巴胺、肾上腺素、去甲肾上腺素等儿茶酚胺及其衍生物,使血管平滑肌收缩,引起血压增高、代谢紊乱及多器官功能障碍。目前国内缺乏有关PHEO准确发病率或患病率的数据,有国外报道显示,该病在人群中的发生比例为0.2%~0.6%[1]。嗜铬细胞瘤的病因尚不完全清楚,多位于肾上腺髓质(80%~90%),也可发生在其他脏器,如腹部交感神经链(如主动脉分叉部)、膀胱、颈部等,多数为良性,约2%为恶性。儿童病例多见于10岁左右,常表现为不明原因的持续性或阵发性高血压,可伴有出汗、头痛、面红、心悸等症状,严重者可导致恶性高血压、肾上腺危象、心肌梗死等,危及生命。现总结广州医科大学附属广州市妇女儿童医疗中心收治的6例嗜铬细胞瘤病例,并进行文献复习,探讨PHEO围手术期的血压管理,以有效预防术中、术后可能出现的并发症,保障患儿手术安全。
材料与方法
2009年1月至2019年12月广州医科大学附属广州市妇女儿童医疗中心共收治6例嗜铬细胞瘤患儿,均为男性,年龄7天至15岁,其中单侧嗜铬细胞瘤5例,双侧1例,无一例肿瘤转移病例。临床资料详见表1。本研究通过广州市妇女儿童医疗中心科研伦理委员会批准(审批编号:穗妇儿科伦批字[2022]第171A01号)。

表1 6例嗜铬细胞瘤患儿临床资料Table 1 Clinical data of six pheochromocytoma children编号性别年龄临床表现影像学检查术中所见术后病理1男11岁心悸、多汗,右侧腹部包块超声:右侧肾上方实性包块,56 mm×46 mm,CT提示右侧肾上腺区占位性病变,考虑术后复发肿物位于腹膜后下腔静脉和双肾静脉正后方,大小约3 cm×3 cm×4 cm,质地中等,边界不清,与下腔静脉有较多粘连。嗜铬细胞瘤2男14岁血压升高、视物不清CT检查提示左肾上腺内可见一占位性病变,大小约3.5 cm×2.7 cm×3.6 cm,考虑嗜铬细胞瘤暴露左肾,见肿瘤来源于左侧肾上腺,肿瘤表面血供较丰富,表面包膜尚完整,大小约5 cm×4 cm×4 cm,肿瘤内侧与左肾动、静脉粘连紧密嗜铬细胞瘤3男12岁反复头痛且进行性加重CT提示双侧肾上腺区占位病变,考虑嗜铬细胞瘤;腹部B超提示双侧肾上腺区实性占位病变肿瘤位于双肾上极,肿瘤与肾脏组织分界明显,质稍韧,与周围组织粘连明显,肿瘤表面供血丰富嗜铬细胞瘤4男7天生后检查发现肾上腺结合部肿块腹部B超提示右肾上腺混合回声包块,考虑腹膜后畸胎瘤可能探查见右肾上腺有一约2 cm×2 cm×2 cm大小肿物,壁较厚,表面光滑,未过中线,下方与右侧肾上腺关系紧密,上极进入肝右叶嗜铬细胞瘤5男5岁腹痛伴血压升高腹部CT提示左肾上腺嗜铬细胞瘤可能性大肿物位于胰腺后方,肿物上极为左侧肾上腺以及脾动、静脉,下方为肾动脉嗜铬细胞瘤6男15岁先心病术后检查发现肾上腺占位腹部B超提示左侧肾上腺占位,考虑嗜铬细胞瘤暴露左侧肾脏,于肾脏上方可见肿物,考虑为肾上腺肿物,边界清楚嗜铬细胞瘤
结 果
6例均行手术治疗,围手术期控制患儿血压,当监测患儿血压高于130/80 mmHg时,提前应用降压药物控制血压。通常确诊本病后予α受体阻滞剂;β受体阻滞剂并非常规使用;对使用α受体阻滞剂后未能控制血压到满意水平的患儿,加用Ca离子通道阻滞剂。使血压降至130/80 mmHg以内,同时避免血压低于80/45 mmHg。术前给予药物控制血压,术中与麻醉团队紧密合作,术后使用血管活性药物。6例围手术期均未出现相应心血管并发症。出院后定期随访(0.3~10年),血压均在正常范围,复查肾上腺B超均提示未见异常。见图1、表2。
图1 嗜铬细胞瘤患儿术后病理结果(HE染色,×40) A-D:嗜铬细胞瘤HE低倍放大; E:混合性嗜铬细胞瘤HE低倍放大; F.嗜铬细胞瘤HE低倍放大Fig.1 Postoperative pathology of six pheochromocytoma children(HE,×40)
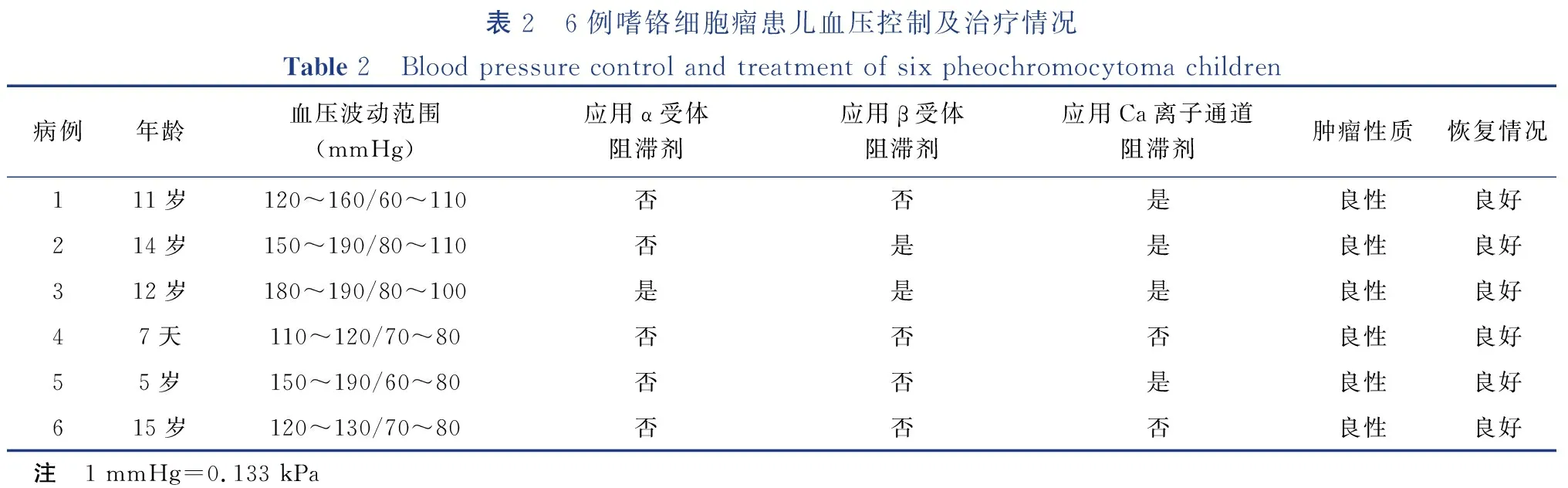
表2 6例嗜铬细胞瘤患儿血压控制及治疗情况Table 2 Blood pressure control and treatment of six pheochromocytoma children 病例年龄血压波动范围(mmHg)应用α受体阻滞剂应用β受体阻滞剂应用Ca离子通道阻滞剂肿瘤性质恢复情况111岁120~160/60~110否否是良性良好214岁150~190/80~110否是是良性良好312岁180~190/80~100是是是良性良好47天110~120/70~80否否否良性良好55岁150~190/60~80否否是良性良好615岁120~130/70~80否否否良性良好 注 1 mmHg=0.133 kPa
讨 论
PHEO是一种罕见的神经内分泌瘤,80%~90%来源于肾上腺髓质[2]。由于嗜铬细胞可合成和储存过量的多巴胺、肾上腺素、去甲肾上腺素等儿茶酚胺及其衍生物,一旦大量释放将会产生威胁生命的心血管并发症[3]。PHEO临床表现多种多样,通常无症状[4]。儿童最常出现与高血压有关的体征和症状是头痛。嗜铬细胞瘤的一般症状包括出汗、视觉不适、恶心、呕吐、体重减轻、多饮和多尿,这些症状在儿童较成人更常见[5]。患有嗜铬细胞瘤的儿童常表现为持续性高血压,但也有文献报道为阵发性高血压[6]。PHEO一经确诊,应尽早手术切除瘤体,治愈率可达90%以上。但若无充分准备即予手术治疗,可能发生危及生命的心血管并发症,手术风险极大。围手术期管理是保证手术顺利实施、患儿如期康复的关键。
一、术前管理
由于PHEO分泌的儿茶酚胺对周围血管可产生收缩作用,因而血管容积显著下降。同时,术中麻醉诱导和肿瘤被牵拉、挤压、切除等,使肿瘤释放的儿茶酚胺水平急剧变化,极易出现血流动力学不稳定,引起高血压危象、低血压危象、心律失常、心肌梗死等并发症,术前优化患儿的血压和血管容积可避免围手术期血流动力学不良事件的发生。有研究表明,术前经药物控制血压的患儿,其术中、术后心血管并发症明显减少[1,7]。PHEO的血压控制目标是:坐位时血压约为130/80 mmHg或更低;立位时收缩压约为100 mmHg,同时避免血压低于80/45 mmHg;心率的控制目标是:坐位时60~70次/min,立位时70~80次/min[3]。因此,PHEO患儿术前可使用α受体阻滞剂、β受体阻滞剂及钙离子通道阻滞剂等药物以调控血压、心率以及血管容积,必要时需给予对症、补液治疗;但其术前降压药物的选择或最佳治疗时间尚无共识[8]。传统上,非选择性α受体阻滞剂一直是围手术前治疗的主要手段[9]。
酚苄明为常用的非选择性α受体阻滞剂,研究表明合适剂量使用2周后行手术治疗可减少术后并发症[10]。与使用选择性α1受体拮抗剂的患儿相比,使用酚苄明者术中血流动力学控制较好,但术后低血压的发生率较高。由于酚苄明可透过血脑屏障,导致中枢神经系统α1和α2受体失活,可引起头痛、嗜睡等副作用,而其他副作用如直立性低血压、心动过速、头晕和晕厥均较选择性α1受体拮抗剂严重,故临床医生更倾向于使用选择性α1受体拮抗剂[1]。
选择性α1受体阻滞剂常用药物包括哌唑嗪、特拉唑嗪和多沙唑嗪,优先作用于α1受体,引起血管扩张;由于α2受体未受抑制,因此可避免严重心动过速的发生。同时,选择性α1受体阻滞剂的阻滞作用是可逆的,在肿瘤切除后不会出现低血压。由于选择性α1受体阻滞剂不能充分控制术中高血压危象,故这类药物应在手术当天使用。
β受体阻滞剂无α受体阻滞作用,可能导致严重血管收缩,从而出现急性心功能不全和肺水肿,故不宜单独使用。β受体阻滞剂应在心动过速出现后2~3 d内使用。非选择性β受体拮抗剂普萘洛尔的用量为20~80 mg/次,每日1~3次[3]。选择性β拮抗剂(如美托洛尔和阿替洛尔)的副作用较非选择性β拮抗剂少。美托洛尔用量为25~50 mg/次,每日3~4次,阿替洛尔的用量为12.5~25 mg/次,每日2~3次。
钙离子通道阻滞剂目前已被用作控制血压的主要手段,或作为术前α受体拮抗剂的辅助用药,对于血压正常或阵发性高血压患儿尤为适用。常用药物包括硝苯地平(30~90 mg/d)、氨氯地平(5~20 mg/d)、尼卡地平(60~90 mg/d)、地尔硫卓(90~240 mg/d)和维拉帕米(80~540 mg/d)[1]。
甲酪氨酸是一种酪氨酸羟化酶抑制剂,可用于抑制PHEO患儿儿茶酚胺的过量合成,在儿茶酚胺水平较高的患儿中特别适用。根据患儿血压及心率情况,于术前1~3周开始使用。由于甲酪氨酸可透过血脑屏障,主要副作用涉及中枢神经系统,包括抑郁、焦虑、嗜睡和胃肠道反应等[3]。其价格昂贵,且获取途径有限,故很少用于临床。
本组6例中,病例1表现为高血压1级,术前予钙离子通道阻滞剂;病例2表现为高血压3级,术前予β受体阻滞剂联合钙离子通道阻滞剂降压;病例3表现为高血压3级高危且难以控制血压,术前采用三联降压;病例4与病例6血压稳定,故未予特殊降压;病例5高血压3级,术前予钙离子通道阻滞剂降压;术中仅病例3出现血压波动,无大量活动性出血,对症治疗后术后恢复较好。
二、术中管理
鉴于术中刺激肿瘤(牵拉、挤压、切除等)可引起儿茶酚胺释放,故麻醉医师应了解术中使用的药物是否有促进儿茶酚胺释放的作用。同时,中心静脉压的监测也很重要[7]。许多患儿即使进行了严格术前准备,仍然会在术中发生高血压危象,需要麻醉医师紧急处理。术中主要并发症为血流动力学不稳定,即肿瘤切除前高血压和切除后低血压。术中血流动力学不稳定的定义为: ①收缩压>200 mmHg; ②收缩压>130%基础收缩压; ③收缩压<80 mmHg; ④收缩压<70%基础收缩压; ⑤心率>120次/min[10]。有研究表明,瘤体大小和术前高水平肾上腺素是PHEO患儿术中发生高血压危象的危险因素[11]。术中发生高血压危象时应使用强效、短效的药物治疗,硝普钠和酚妥拉明是目前治疗本病术中高血压常用的两种药物,具有较高的安全性。硝普钠和酚妥拉明起效时间短、起效快,常用于高血压危象。但硝普钠代谢产物包括氰化物和硫氰盐酸等,可引起较严重的毒副作用,而酚妥拉明可导致心动过速或心律失常。本组6例患儿术中仅病例3出现血压剧烈波动,麻醉医师监测及时并积极应对,予氯维地平控制血压,术中患儿血压逐渐稳定。氯维地平也常用于治疗高血压危象,一般不会产生体位性低血压,也不容易产生快速耐受性,不减少心输出量和肾血流量,但在临床中容易出现水肿[12]。
嗜铬细胞瘤的手术方式及切口选择应根据肿瘤大小和部位而定。腹腔镜技术在临床中运用越来越多。与开腹手术相比,腹腔镜手术后疼痛减少、住院时间缩短、对止痛药的需求减少、术后并发症降低[13]。对于良性PHEO患儿,腹腔镜手术治疗是首选方法。本组病例中,只有病例3和病例4采取经腹腔镜手术治疗,其原因是瘤体小、与周围组织粘连不严重,且肿瘤性质均为良性。
三、术后管理
PHEO患儿瘤体切除后,儿茶酚胺水平突然下降,可能出现低血压、心律失常、心肌梗塞、心力衰竭等并发症,其他并发症包括发热、低血糖、皮质醇缺乏、尿潴留、糖尿病等,术后常需监护[14]。术后低血压的发生率为20%~70%,在一定程度上还可能与术前、术中使用降压药有关[1]。一旦出现低血压,在补充血容量后仍需要应用血管活性药物,如去甲肾上腺素或血管加压素等。术后24 h仍存在高血压者,可能是由于疼痛或自主神经功能不稳定引起,若患儿所有症状得到缓解,但仍存在高血压,可能是肿瘤切除不完全,此时需复查血浆及24 h尿的儿茶酚胺水平和肾上腺素水平。肿瘤切除后,患儿通常会出现代偿性激素缺乏,常发生在切除双侧完全或部分肾上腺后同时发生低血糖和低血压,严重者可出现肾上腺皮质危象,一旦确诊应予激素治疗[15]。本组病例2和病例3术后出现不同程度皮质功能受损,曾使用激素治疗。
综上所述,对于PHEO患儿而言,手术是首选的治疗方法。术前需通过一系列术前检查以评估过量儿茶酚胺是否会对重要脏器产生影响[16]。患儿术前、术中及术后均存在血流动力学不稳定的风险,积极、有效的围术期血压管理能有效预防术中、术后可能出现的并发症,对于保障手术安全、确保手术疗效至关重要。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为柳征、黄萍,论文调查设计为柳征、邹焱,数据收集与分析为柳征、柴成伟,论文结果撰写为柳征、邹焱,论文讨论分析为柳征、柴成伟、杨纪亮、刘国昌、黄萍、邹焱

