器官移植术后淋巴组织增生性疾病的临床回顾性研究
刘彦权,胡晓梅,殷悦,林霖,沈建箴,陈玉婷,唐焕文
1.广东医科大学研究生院第一临床医学院血液内科,广东 东莞 523808;
2.广东省东莞市环境医学重点实验室,广东 东莞 523808;
3.福建医科大学附属协和医院病理科,福建 福州 350001;
4.福建医科大学附属协和医院血液病研究所,福建 福州 350001;
5.福建医科大学附属协和医院影像科,福建 福州 350001
移植术后淋巴组织增生性疾病(post-transplant lymphoproliferative disorders,PTLD)是一类临床罕见、缘于实体器官移植(solid organ transplant,SOT)或骨髓造血干细胞移植(hemapoietic stem cell transplantation,HSCT)术后长期接受免疫抑制治疗而诱发的淋巴细胞或浆细胞恶性克隆性疾病,因发病部位不定,常为结外部位,且EB病毒(Epstein-Barr virus,EBV)在PTLD发生、发展中扮演着重要角色[1]。世界卫生组织(Word Health Organization,WHO)2016年修订的第4版造血和淋巴肿瘤分类[2]将PTLD分为4大类:非破坏性PTLD(含3个亚型)、多形性PTLD、单形性PTLD(含B细胞和T/自然杀伤细胞类型)及经典霍奇金淋巴瘤PTLD。由于PTLD发病率低、临床罕见,且该病疗效欠佳、预后差,在诊治过程中极易出现漏诊、误诊,进而影响移植后患者的长期生存,因此,本文回顾性分析2例PTLD患者的临床资料,分析和探讨PTLD患者的病史特点、临床表现、诊治经过、疗效及预后等,以期提高中国血液肿瘤领域对PTLD的认识。
1 临床资料
病例1:患者,女性,54岁,以“发现外阴肿物半月”为主诉入院。患者于2017年7月因“扩张性心肌病,心功能Ⅲ级”在福建医科大学附属协和医院行“同种异体原位心脏移植术”,术后规律服用“巯唑嘌呤、他克莫司、泼尼松”,爬三层楼仍感气喘。入院前半个月无明显诱因出现外阴肿物,查血常规示:白细胞(white blood cell,WBC)5.7h 109/L,血红蛋白(hemoglobin,Hb)121 g/ L,血小板(platelets,PLT)89h 109/L。泌尿系彩超示:①右肝低回声团块;② 右肾上部低回声结节[转移瘤(metastatic tumor,MT)待排];③左肾中部低回声结节。肺部计算机体层成像(computed tomography,CT)(图1)示:①右肺中叶结节(肺癌可能);② 心膈角淋巴结增大;③胸骨术后改变,双侧胸膜增厚;④ 肝脏团块低密度灶(MT可能);⑤ 左肾上腺结节,警惕转移。后予以完善外阴肿物活检(图2)示:结合临床病史,符合单形性PTLD(弥漫大B细胞淋巴瘤,非生发中心活化B细胞样),免疫组织化学法(immunohistochemistry,IHC)示:CD20、Pax-5、CD23、Mum-1阳性,Bcl-2约70%阳性,c-Myc约40%阳性,CD30约50%阳性,Ki-67免疫染色阳性率约60%,Bcl-6、CD10、TdT、CD3、CD5、Cyclin D1阴性。原位杂交示:肿瘤细胞EBER阳性。骨髓常规示:①未检出淋巴瘤细胞;② 增生性贫血。骨髓病理学检查示:淋巴瘤累及骨髓诊断依据不足。结合上述检查结果,明确诊断为弥漫大B细胞淋巴瘤[非生发中心B细胞样,ⅣA期,国际预后指数(international prognostic index,IPI)3分],先后于2016年6—11月予CHOP方案(环磷酰胺1.16 g,每天1次,第1天;盐酸多柔比星脂质体40 mg,第1天;长春地辛4 mg,每天1次,第1天;地塞米松20 mg,每天1次,第1~5天)6个疗程,化疗顺利,后正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)评估(图3)示:①心脏移植术后改变;② 弥漫大B细胞淋巴瘤显像,右肺病灶残留片絮影,活性抑制,肝S8段残留活性病灶较前缩小。再于2016年12月、2017年2月予CHOP方案巩固治疗2个疗程,化疗顺利,2017年3月—2018年9月,每月复查血常规、血生化等实验室检查均未见明显异常,每3个月行肺部CT、全身浅表淋巴结彩超及全腹彩超等影像学检查均提示淋巴结同前相似,未提示疾病进展,嘱患者定期随访。随后患者于2018年12月无明显诱因出现右颈部淋巴结肿大而返院,查体可触及右颈部、双侧腋窝、腹股沟多个淋巴结,最大位于右颈部,约1.5 cmh 1.0 cm大小,质韧,边界清,活动度可,无压痛,行血常规、血生化、凝血分析等检查均未见明显异常,再予R-CHOP方案(利妥昔单抗0.6 g,每天1次,第1天;环磷酰胺1 g,每天1次,第2天;盐酸多柔比星脂质体40 mg,每天1次,第2天;长春地辛4 mg,每天1次,第2天;地塞米松10 mg,每天1次,第2~6天)1个疗程,化疗顺利,出院后嘱患者定期行血常规及影像学检查。后患者于2019年11月复查颈胸腹平扫+增强CT示:①双侧颈部、锁骨上、纵隔及腹腔肠系膜区、腹膜后多发小淋巴结;② 心脏移植术后改变;③右肺上叶后段结节,余无特殊。遂再予单用R方案(利妥昔单抗0.6 g)1个疗程,化疗顺利,出院后嘱定期复诊至今疾病稳定,无新发病灶。
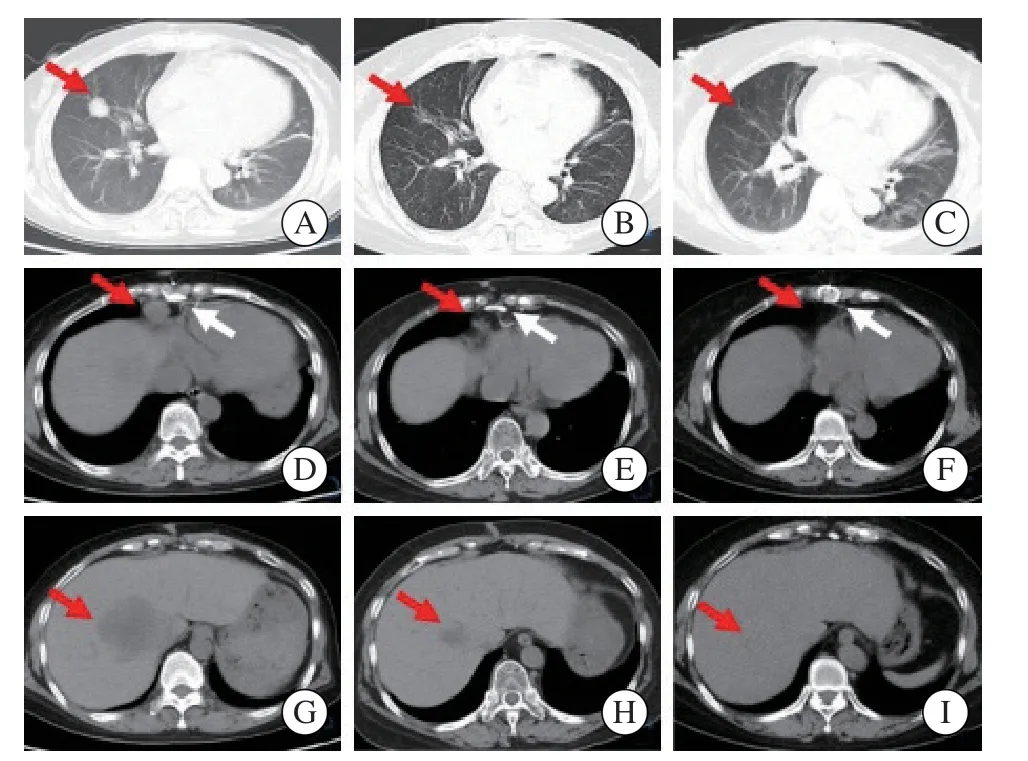
图1 治疗前后胸腹部CT影像Fig.1 CT images of chest and abdomen before and after treatment

图2 病例1病理学活检IHC染色图Fig.2 IHC staining of pathological biopsy of patient 1

图3 病例1的PET/CT影像Fig.3 The image of PET/CT of patient 1
病例2:患者,男性,51岁,以“反复全身多处淋巴结肿大7年余”入院,患者于7年前无明显诱因发现鼻咽部、右侧颈部、左侧腹股沟区肿物,后肿物逐渐增大,遂就诊于福建省立医院,该院完善颈部淋巴结活检示:符合淋巴结反应性增生,T区增生明显,伴有异型增生,与EBV感染有关。IHC示:CD2、CD3、CD5、CD7、CD4、CD8阳性,Ki-67免疫染色阳性率约40%,CD20、CD10、Bcl-6、CD30阴性。原位杂交示:肿瘤细胞EBER阳性。鼻咽部穿刺活检提示弥漫大B细胞淋巴瘤。IHC示:CD20、Pax-5、Bcl-6、c-Myc、Mum-1、CD56阳性,CD30约40%阳性,Bcl-2约60%阳性,Ki-67免疫染色阳性率约40%,CD10、CD3、CD5、TdT、Cyclin D1阴性。原位杂交示:肿瘤细胞EBER阳性。骨髓常规及病理学检查未见异常。PET/CT示:①鼻咽顶后壁及左侧壁黏膜增厚,代谢增高;② 左侧咽旁间隙、双侧颈部、锁骨上窝及左侧腹股沟多发高代谢肿大淋巴结;③脾脏轻度肿大,多发高代谢灶,考虑淋巴瘤浸润。结合上述检查结果,该院诊断为弥漫大B细胞淋巴瘤[非生发中心B细胞样,ⅢB期,年龄调整的IPI 3分,高危组],于2013年12月—2014年4月予R-CHOP方案(利妥昔单抗0.6 g,第1天;表阿霉素0.14 g,第2天;长春新碱2 mg,第2天;地塞米松15 mg,第2~6天)化疗5个疗程,于2014年5月予R-DHAP方案(利妥昔单抗0.6 g,第1天;顺铂0.16 g,第2天;阿糖胞苷3.4 g,第2天;地塞米松40 mg,第2~5天),再于2014年6月在该院行自体造血干细胞移植,总量约480 mL,移植后无不良反应,淋巴结未再增大,疾病稳定。后该患者于2016年初因“慢性乙肝”,自服中草药(具体不详)后致亚急性肝衰竭晚期,赴南京军区福州总医院行异体全肝移植术,术后长期服用他克莫司抑制宿主抗移植瘤排斥反应。2019年10月患者因左侧颈部淋巴结再次肿大于福建省立医院就诊,该院完善左颈部淋巴结活检后诊断为“PTLD(T细胞淋巴瘤)”,该院于2019年11月—2020年2月予ECDOP方案(环磷酰胺1.2 g,第1天;多美素20 mg,第2~3天;长春新碱2 mg,第1天;依托泊苷150 mg,第1天;地塞米松15 mg,第1~5天)化疗4个疗程,中期评估为部分缓解;后于2020年3—4月再予ECDOP方案(同前)化疗2个疗程,出院后患者长期予西达本胺30 mg(每周2次)治疗。
随后此患者于2020年9月无明显诱因再次出现右颈部、右侧腋窝淋巴结进行性肿大,遂转诊至福建医科大学附属协和医院,完善CT(图4)示:①双肺多发肿大淋巴结,性质待定;② 纵隔、双侧锁骨上区及双侧腋窝多发肿大淋巴结。骨髓常规示:有核细胞增生减少;骨髓病理学检查示:淋巴瘤浸润骨髓证据不足。骨髓流式细胞术免疫分析未见明显异常。颈部淋巴结活检(图5)示:结合临床病史,考虑为多形性PTLD伴EBV感染,IHC示:CD20 B细胞阳性,CD2、CD3、CD5、CD7、CD4、CD8 T细胞阳性,CD21示FDC网,Ki-67免疫染色阳性率约30%,CD10、CD30、PD-1、CXCL13阴性;原位杂交示:EBER阳性。TCR、Ig及IGHV基因重排检测均未见异常。明确诊断为多形性PTLD伴EBV感染后,于2020年10—11月予RP-Gemox方案(汉利康0.6 g,第1天;吉西他滨1.78 g,第1天;奥沙利铂178 mg,第1天;培门冬酶3750 U,第2天)化疗2个疗程,于2021年1月予RP2-Gemox方案(汉利康0.6 g,第1天;PD-1200 mg,第2天;吉西他滨1.78 g,第1天;奥沙利铂178 mg,第1天;培门冬酶3750 U,第2天)化疗1个疗程。出院后第3周,患者因“腹胀1周余”返诊,查血常规示:WBC 2.49h 109/L,Hb 60 g/L,PLT 11h 109/ L;血生化示:白蛋白(albumin,ALB)26.9 g/ L,总胆红素(total bilirubin,TBIL)22.7 μmol/L,直接胆红素(direct bilirubin,DBIL)8.7 μmol/L,丙氨酸转氨酶(alanine aminotransferase,ALT)77 U/L,天冬氨酸转氨酶(aspartate aminotransferase,AST)66 U/L,尿酸739 μmol/ L,乳酸脱氢酶(lactate dehydrogenase,LDH)469 U/L,降钙素原(procalcitonin,PCT)20.34 ng/mL,C反应蛋白(C-reactive protein,CRP)24.98 mg/L。凝血功能示:活化部分凝血活酶时间(activated partial thromboplastin time,APTT)57.9 s,纤维蛋白原(fibrinogen,FIB)1.01 g/L。全腹彩超示:①肝、脾肿大;② 前列腺多发钙化灶;③腹腔、腹膜后多发结节(MT?);④ 胆囊显示不清;⑤ 双侧胸腔、腹腔积液。结合相关检查结果及既往诊疗经历,考虑该患者疾病进展,于2021年2月予ZBR方案(利妥昔单抗0.6 g,第1天;奥布替尼150 mg,苯达莫司汀100 mg,第2~3天)化疗1个疗程,住院期间出现发热,查胸部CT示:①双肺多发不规则小结节,较前新增;② 纵隔、双侧锁骨上区及双侧腋窝多发肿大淋巴结,较前相仿。同时完善血培养并予头孢他啶、舒普深、厄他培南抗感染等治疗后感染仍无法控制,疾病进行性恶化,患者家属主动要求出院,患者于出院后第4天死亡。

图4 患者胸部CT影像Fig.4 Lung CT image of the patient

图5 病例2的病理学活检IHC染色Fig.5 IHC staining of pathological biopsy of patient 2
2 讨论
PTLD通常进展快、预后差且死亡率高,是威胁器官移植受者远期生存最严重的不良反应[3]。PTLD常以淋巴细胞恶性克隆性增殖为特点,其临床症状和体征复杂,缺乏特异性,常需病理学活检确诊[4]。本研究纳入的2例患者中,第1例为心脏移植术后长期服用抗排异药物(免疫抑制剂)导致结外恶性淋巴瘤,而另1例则是既往有淋巴瘤病史,经多个疗程化疗联合自体造血干细胞移植后淋巴瘤疾病控制良好,后又因肝脏移植术长期服用抗排异药导致淋巴瘤复发并迅速进展,符合PTLD的发病特点。
器官移植术后患者通常需长期服用抑制宿主抗移植物排斥反应的药物或免疫抑制剂,而在长期免疫抑制状态下,SOT或HSCT受者极易发生以淋巴组织或浆细胞恶性克隆性增殖为特点的恶性淋巴系统肿瘤,其亦属于其他医源性免疫缺陷相关淋巴增殖性疾病[1]。不同移植类型所发生的PTLD不同,SOT后PTLD发生率高达20%,在肠道和多器官移植中的发生率最高(5%~20%),其次是肺和心脏移植(2%~10%),然后是肾脏和肝脏移植(1%~5%)[5]。PTLD在心脏、肺、肠和多器官移植物中的发生率较高与临床为保护患者移植物存活而使用大剂量免疫抑制药物有关[6-8]。此外,在儿童SOT人群中,肾移植PTLD的发生率约2.2%,而肺移植PTLD的发生率约15%[9]。相比之下,HSCT后PTLD的发生率约4%[10]。已有研究[11-12]发现,与SOT相关的PTLD死亡率为50%~70%,而在HSCT中高达70%~90%。
由于PTLD具有高度异质性,包括多种组织(病理)学类型,各疾病形式具有不同的生物学特性及临床表现。值得注意的是,约70%的PTLD发生与EBV感染密切相关[13],根据是否伴EBV感染,又可将PTLD分为EBV相关PTLD和非EBV相关PTLD。相关研究[14-15]表明,由于应用抗排异药,在移植后1年内对人体免疫抑制效应强度最大,发生EBV相关PTLD的概率最高,总发生率可达1%~20%。本研究中的2例患者EBV编码的小RNA(EBER原位杂交)检测均为阳性,表明EBV在PTLD的发生、进展中可能发挥重要作用,与既往研究结论一致。
EBV是一种DNA病毒,其唯一宿主是人类,EBV常侵袭人体B细胞和口咽/鼻咽部上皮细胞,人在感染EBV后多处在“病毒携带”状态,可无特殊临床症状,但极少数者会因自身免疫力低下使EBV在体内扩散,继而引起发热、肝脾或淋巴结肿大,严重者亦可引起脏器功能损害[16]。EBV一般通过飞沫传播,而对于移植受者而言,其还可能经由EBV(+)的供者或输注未去除白细胞成分的血制品获得性感染[17-18]。通常,B细胞可因感染EBV后引起克隆性增生,而机体在免疫正常时可通过EBV特异性细胞毒性T细胞诱导B细胞凋亡触发机制予以调控其增殖和凋亡过程,但由于移植受者因接受免疫抑制治疗,上述生物学调控机制受到干扰甚至被抑制,破坏由EBV诱发B细胞增殖与免疫调控之间的平衡,继而引起异常B细胞恶性克隆性增殖,最终导致PTLD的发生、发展[19-20],为此,长期监测EBV病毒载量对于防治PTLD极为重要。
SOT及HSCT移植术后的PTLD病理学类型较复杂,且PTLD常发生在结外部位,因此,在诊断PTLD之前还需要排除感染性疾病或机体潜在恶性肿瘤等原发、前驱病史,尽早完善EBV检测、血常规、骨髓检查及影像学检查等,将利于PTLD的诊断及分期。然而,活组织病理学检查仍是PTLD诊断的金标准[21]。早在2008年,WHO将PTLD分为早期病变、多形性PTLD、单形性PTLD及经典霍奇金淋巴瘤型,此分类法反映了PTLD病变从多克隆向单克隆逐渐演进,侵袭性亦逐渐增强,最终结局是发展为淋巴瘤的渐进式连续性过程[22-23]。直至2016年,WHO更新了PTLD分类法,其将早期病变细分为浆细胞增生性PTLD、传染性单核细胞增多症样PTLD及旺炽性滤泡增生性PTLD,而其余分类则保持不变[2]。通常,多形性PTLD在儿童患者中常见,而成人PTLD以单形性B细胞淋巴瘤常见,其最常见的病理学类型是弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL),该病理学类型还需结合CD20表达、Ki-67增殖指数及EBER原位杂交等综合判断其预后[24],此外,根据Hans模型,可将DLBCL分为生发中心B细胞样和非生发中心B细胞样,亦对疾病诊断及预后评估有指导意义。然而,与普通恶性淋巴瘤相比,PTLD的疗效及患者预后差,远期生存率低[25]。但并非所有PTLD患者都能准确地划分至相应的分类亚型中,即使同一患者在不同病变部位取材活检后其病理学类型也可能不同,甚至患者同一部位内部可出现不同组织学类型的PTLD[26]。正如本研究的病例2,该患者在外院诊断为单形性PTLD中的T细胞淋巴瘤,而在福建医科大学附属协和医院诊断为多形性PTLD。因此,此类患者应结合影像学检查,确认是否存在多个病灶,多部位穿刺活检可能对于精准治疗和预后评估具有重要意义。
对于PTLD的防治而言,SOT或HSCT的供、受者都需进行EBV检测,必要时可预防性使用抗病毒药物或免疫球蛋白[27-28],而对于PTLD高风险人群,可酌情减少免疫抑制剂的用量并监测EBV DNA载量[29]。由于PTLD具有高度异质性且缺乏临床前瞻性试验的研究,目前学术界对于PTLD的治疗尚未形成统一的治疗标准,仍延续原发恶性淋巴瘤的治疗手段及标准,但由于其早期缺乏特异性临床表现,病情进展迅速,若不及时予以临床处理,PTLD患者死亡率极高。PTLD治疗目标是在保证移植物功能的前提下进行治愈和缓解,降低免疫抑制水平(reduction in immunosuppression,RIS)一直是主要的治疗方式[30],该方式的有效性取决于PTLD亚型、疾病程度和其他预后指标[31],仅不足10%的患者可维持RIS的反应持久性[32],达到治愈目的。Choquet等[33]通过在RIS失败后进行单药利妥昔单抗与SOT相关的PTLD的第一个前瞻性Ⅱ期试验,观察到患者的1年总缓解率(overall remission rate,ORR)为34%,总生存率(overall survival,OS)为67%。对于危险度低或RIS失败的患者,利妥昔单抗单药仍被视为首选[34],单用利妥昔单抗作为诱导治疗的初始反应也被认为是PTLD的预后因素[35]。在>16岁的患者中,以蒽环类药物为基础的化疗方案对PTLD表现出良好的效果,R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松龙)目前是ORR高达90%的B细胞PTLD的首选方案[36]。对于儿童患者而言,采用RCP方案(利妥昔单抗、环磷酰胺和泼尼松)化疗已显示出良好疗效,是儿童PTLD的首选方案[37-38]。
综上所述,PTLD是继发于移植术后缺乏特异性、预后不良且进展快的淋巴组织恶性增殖性肿瘤,影像学检查、活体组织病理学检查及EBV检测是诊断PTLD的可靠手段,而在明确诊断后,通过多学科协作诊疗模式制订以合理降低免疫抑制水平、靶向CD20(利妥昔单抗)的化疗、放疗、EBV特异性细胞毒性T淋巴细胞的过继免疫疗法及上述组合疗法为原则的个性化治疗方案,有可能最大程度地改善患者预后。然而,个性化治疗方案的选择取决于PTLD亚型、PTLD的侵袭性移植类型及患者自身基础条件等,治疗目标是治愈PTLD并保留移植物功能。尽管PTLD罕见且缺乏共识性的治疗方案,但正如本研究中的例1患者采用恶性淋巴瘤的标准治疗方案亦可获得良好疗效,至于PTLD患者的长期预后如何、是否可伴随其他不良反应,仍需更多且更为深入的临床病例研究予以探讨新型化疗方案和免疫疗法。此外,PTLD的规范化诊疗及疗效标准仍有待新的循证医学证据予以支撑和完善。
利益冲突声明:所有作者均声明不存在利益冲突。

