桑叶水提物改善肠肌运动及缓解便秘的作用
段晓峰,王亚文,耿旭芳,赵 甜,李 丽,贾东升,赵 丁,
(1.河北医科大学药学院,河北石家庄 050017;2.河北省农林科学院经济作物研究所,河北石家庄 050051)
便秘是临床常见的消化道疾病,以排便困难、排便量少、粪便干结为主要表现,影响了全世界约20%的人口[1],其中妇女和老年人患病率更高。轻型便秘影响生活质量[2],重型则会诱发癌症[3]。便秘患者常常伴随肠道组织形态、神经系统及神经递质和平滑肌功能的病变[4]。水通道蛋白(AQPs)是具有高度选择性的水通道蛋白家族,肠道内存在其多种亚型,如水通道蛋白3(aquaporin 3,AQP3),可以调节结肠上皮细胞对水的吸收程度[5],在便秘腹泻等胃肠道疾病中有重要地位。目前对于便秘的治疗方法主要为泻药,如大黄[6−7]、番泻叶[8−9]等,但其效果因人而异,可能伴有腹泻等副作用。从大健康角度出发,寻求安全有效的改善便秘的方法,开发药食同源产品不失为重要策略之一。
桑叶是桑科植物桑(Morus albaL.)的干燥叶,首次记载于《神农本草经》,列为中品。桑叶改善肠道的作用较早见于《唐本草》,曰“煎汁服,止霍乱腹痛吐下,利大小肠”。桑树在中国南北均有较大的种植面积,河北省也有丰富的桑叶资源。作为卫生部公布的药食两用植物之一[10],桑叶主要含有黄酮及黄酮苷类[11]、多酚、生物碱类(主要为1-脱氧野尻霉素(DNJ))[12]、多糖类、蛋白质及常量元素[13]等成分[14],具有降糖[15−16]、抗衰老[17]、软便[18]及减肥[19]等功效。桑叶提取物对肠道功能的研究目前仍较少,袁淑青[20]用小鼠肠蠕动抑制模型研究发现,桑叶水提物具有改善小肠推进功能的作用。本团队前期曾综述了桑叶调节肠道功能[21]的作用,发现桑叶改善便秘的系统研究少,资源开发利用更显不足。桑叶目前除霜桑叶入药外,主要用于动物饲料[22−23]、制作桑叶茶、桑叶挂面等食品。
本研究运用离体肠肌功能实验及便秘模型的构建,观察桑叶水提物对健康豚鼠离体回肠张力及便秘大鼠肠肌运动的影响,并通过结肠组织形态及免疫组化等方法探究桑叶水提物改善便秘的作用及相关机制,以期为桑叶资源的进一步开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
桑叶 采自沧州市中捷农场,桑叶水提物由河北医科大学生药教研室提供;SPF 级健康豚鼠8 只,雌雄兼备,体质量300~450 g 由河北医科大学实验动物中心提供,许可证号:SCXK(冀)2018-004;Wistar大鼠34 只,SPF 级,雌性,体质量180~220 g 购自济南朋悦实验动物繁育有限公司,动物许可证号:SCXK(鲁)20190003。饲养环境温度(22±1) ℃,相对湿度45%~65%,12 h/12 h 明暗交替。所有动物实验均遵循3R 原则。氯化卡巴胆碱(CCh) Sigma公司,批号BCBK0156V;Aquaporin 3(AQP3)抗体Arigo 公司,批号70710;兔SP 试剂盒(SP-9001),批号2005E1124、DAB 显色试剂盒,批号212300203北京中杉金桥生物技术有限公司;盐酸洛哌丁胺东京化成工业株式会社,批号4DIIB-GA;硫酸钡Macklin 公司,批号C11467428。
MedLab-U/4C501H 型生物信号采集处理系统南京美易科技有限公司;XH200 型等长收缩换能器(10 g) 北京新航兴业科贸有限公司;SC-15 数控超级恒温槽 宁波市海曙天恒仪器厂;RM2135 型切片机 德国LEICA 公司;CX31 型显微镜 Olympus公司;Image-Pro Plus 图像分析软件 Media Cybernetics 公司。
1.2 实验方法
1.2.1 桑叶水提物制备 称取干桑叶适量,置于60 ℃烘箱烘干1 h,根据预实验经验,取桑叶体积10~12 倍的蒸馏水,浸泡后,煎煮至沸腾,继续小火煎煮60 min,加水二次煎煮,合并两次滤液,小火浓缩,制得生药浓度为1 g/mL 的桑叶水提物(成分含量:总黄酮14.6 mg/g,多糖17.8 mg/g)。
1.2.2 豚鼠离体肠肌张力的测定
1.2.2.1 离体回肠标本的制备 参考方法[24−26],制备离体回肠标本。豚鼠适应性饲养7 d,禁食不禁水16 h,脱颈处死后,迅速剖开腹腔,取距离回盲部8~10 cm 处的一段回肠,用Krebs 液[24,27](全部成分(mmol/L):NaCl 133.13、KCl 4.69、NaH2PO4·2H2O 1.35、MgSO4·7H2O 0.61、无水CaCl22.52、NaHCO316.66、葡萄糖(C6H12O6·H2O)7.57)将肠管冲洗干净,迅速放入盛有冷Krebs 液并通氧的培养皿中,剥离肠系膜及周围脂肪,将肠管剪成约1 cm 长的肠段备用。用棉线将肠管两端对角线结扎,一端固定于L 型钩上,另一端与张力换能器相连,置于盛有10 mL的Krebs 液的浴槽内,浴槽保持恒温(37±0.5 ℃),持续通入95% O2+5% CO2的混合气体(1~2 个气泡/s),施加1 g 前负荷,每隔15 min 换液一次,待肠管稳定后(约60 min)进行实验。
1.2.2.2 桑叶水提物对豚鼠离体回肠收缩活动的影响 按照上述方法制备豚鼠回肠标本,待回肠收缩稳定后,描记一段正常曲线,加入CCh 使其终浓度为1×10−11mol/L,以检验肠段是否有活性,2 min 后冲洗2 次并换液,待曲线恢复到给药前水平,描记一段正常曲线,加入1 g/mL 桑叶水提物100 μL(低剂量),并描记曲线,孵育5 min 后,再给予相同剂量的CCh,并描记曲线,3 min 后冲洗2 次并换液,稳定至少40 min,待曲线恢复至用药前水平(无法恢复及活性异常的肠段不纳入统计),再加入1 g/mL 桑叶水提物300 μL(高剂量),重复操作;观察给药前后2 min 平均张力和收缩幅度的变化。
1.2.3 便秘大鼠模型的建立 Wistar 雌性大鼠34 只适应性饲养7 d,随机分为空白对照组(10 只,3 d 和7 d 时该组均同步取材)、3 d 模型组、3 d 桑叶水提物组、7 d 模型组和7 d 桑叶水提物组各6 只,第8 d 开始造模给药,桑叶水提物组上午灌胃桑叶水提物(5 g/kg/d,参照配伍剂量[28],临床上桑叶常用剂量为3~60 g,按照动物与人的剂量换算[29],桑叶最大生药剂量为5.29 g/kg),下午灌胃洛哌丁胺(10 mg/kg/d,文献中常用剂量为1.5~15 mg/kg,造模时间短,选用相对较大剂量);模型组上午灌胃生理盐水,下午灌胃洛哌丁胺;空白对照组上午、下午均灌胃生理盐水。
1.2.4 排便实验 于给药第4 d 或第8 d 检测第一白便[30]排出情况。动物灌胃80%硫酸钡混悬液4 mL 后单笼饲养,记录排出第一白便所用时间,以反映全胃肠道传输功能。在检测第一白便的同时,观察各组大鼠24 h 内排便情况,收集并记录。
1.2.5 小肠炭末推进实验 造模给药结束后的大鼠,禁食不禁水一夜,实验时每只大鼠灌胃2 mL 炭末混悬液(每50 mL=5 g 炭末+0.5 g 羧甲基纤维素钠+蒸馏水),30 min 后击头处死,剖腹,小心沿肠系膜剪开,摆成一条直线幽门到回盲部的距离记为小肠全长,幽门至炭末前沿的距离为炭末推进距离,计算小肠推进率[31−32],小肠推进率(%)=炭末推进距离/小肠全长×100。
1.2.6 卡巴胆碱诱发离体回肠收缩平均张力的测定造模给药结束后的大鼠,禁食不禁水16 h,按照1.2.2.1 所述方法制备回肠标本,待回肠收缩稳定后,描记一段正常曲线,加入CCh[33−34]使其终浓度为5×10−12mol/L,并描记收缩曲线,作用明显后,冲洗2 次并换液,待曲线恢复到给药前水平,描记一段曲线;再给予相同剂量的CCh,具体操作同上,观察记录给药前后2 min 平均张力的变化。
1.2.7 HE 染色 按照文献[34],进行HE 染色观察结肠组织病理变化。给药结束后,各组大鼠取结肠组织于包因氏固定液固定24 h 后制成蜡块,石蜡切片厚度5 μm,60 ℃烘箱烤片2 h,脱蜡至水,苏木精染10 min,1%盐酸乙醇分化10 s,伊红染1 min,常规脱水透明,中性树脂封片,晾干后显微镜下观察。
1.2.8 免疫组化染色 按照文献[35]方法进行免疫组化染色。切片厚度5 μm,60 ℃烤片40 min,石蜡切片脱蜡至水,pH6.0 的抗原修复液进行抗原修复,冷却3 min,加热至沸腾,反复3 次,冷却至室温,PBS 洗5 min×3 次,按照SP 法试剂盒说明书进行操作,滴加3% H2O2,室温孵育25 min,PBS 洗5 min×3 次,滴加山羊血清工作液封闭,37 ℃孵育40 min,滴加AQP3 一抗(1:200,PBS 代替一抗作阴性对照)置湿盒于4 ℃冰箱过夜,PBS 洗5 min×6 次,滴加生物素二抗工作液(二抗与一抗为同种属),37 ℃孵育35 min,PBS 洗5 min×6 次,滴加HRP 标记的链霉卵白素工作液,37 ℃孵育35 min,PBS 洗5 min×6 次,滴加DAB 显色液,显微镜下观察到组织出现较明显的着色后终止显色,苏木精染5 min,1%盐酸乙醇分化2 s,常规脱水透明,中性树脂封片,显微镜观察。
1.2.9 免疫组化染色统计方法 在显微镜下(40 倍×10 倍),每个组织拍摄8 个互不重叠的视野图片,利用Image-Pro Plus 6.0 软件测量免疫组化染色图片的积分光密度(IOD)以及有效统计区域面积(Area),计算单位面积的阳性表达即为平均光密度(MOD)[36],最后计算每只大鼠8 张图片的均值为该大鼠该种蛋白的表达结果。
1.3 数据处理
所有数据均以均数±标准误(mean±SE)表示,以SPSS 21.0 软件进行统计,给药前后比较采用配对t检验,P<0.05 为有统计学差异;多组间比较采用单因素方差分析,P<0.05 时进一步运用LSD 进行两两比较;不符合正态性或方差齐性检验的数据采用KW H秩和检验,P<0.05 时进一步两两比较,图表的处理采用GraphPad Prism 8.0 软件完成。组织学图片用长基医疗数码成像软件统一条件拍摄,Image-Pro Plus 6.0 进行图像分析。
2 结果与分析
2.1 桑叶水提物对健康豚鼠离体回肠张力的影响
2.1.1 对豚鼠离体回肠自主运动的影响 桑叶水提物对豚鼠离体回肠张力的影响如图1 所示。桑叶水提物的低剂量和高剂量均可促进豚鼠离体回肠的自主运动,低剂量桑叶水提物预处理后促进了CCh 诱导的离体回肠平均张力,而高剂量却有一定抑制作用。

图1 桑叶水提物对豚鼠离体回肠收缩张力的影响Fig.1 Effects of water extract of mulberry leaves on contractile tension of isolated ileum of guinea pigs
观察桑叶水提物在37±0.5 ℃的Krebs 孵育液中对豚鼠离体回肠自主运动的影响,图2 结果显示,与给药前相比,桑叶水提物的低剂量和高剂量均可明显地刺激豚鼠离体回肠的自主运动,表现为平均张力升高,收缩幅度增强,说明桑叶水提物对离体回肠蠕动有明显刺激作用,差异有统计学意义(P<0.01,P<0.05),且有剂量依赖性。

图2 桑叶水提物对豚鼠离体回肠自主运动的影响Fig.2 Effects of water extract of mulberry leaves on autonomous movement of isolated ileum of guinea pigs
2.1.2 桑叶水提物预处理后对卡巴胆碱诱发豚鼠离体回肠收缩平均张力的影响 观察桑叶水提物预处理对CCh 诱发收缩平均张力的影响,图3 结果表现为低剂量桑叶水提物预处理可促进CCh 诱导的离体回肠收缩平均张力,高剂量桑叶水提物则表现为抑制作用,差异有统计学意义(P<0.05,P<0.01)。推测桑叶水提物中可能存在作用相反的成分,发挥整肠作用。梁万年等[37]发现,高良姜总黄酮能有效抑制正常大鼠的肠运动及新斯的明所致的小肠推进亢进。前期预实验发现,含黄酮成分较高的市售桑叶醇提物可抑制豚鼠的肠肌运动,故推测高剂量的桑叶水提物可能由于黄酮类成分含量较高而表现为抑制作用。为了进一步验证桑叶水提物对便秘动物的调节作用,本团队建立了便秘大鼠模型,并利用离体肠肌实验反映便秘大鼠的肠运动情况,以探究桑叶水提物的作用。
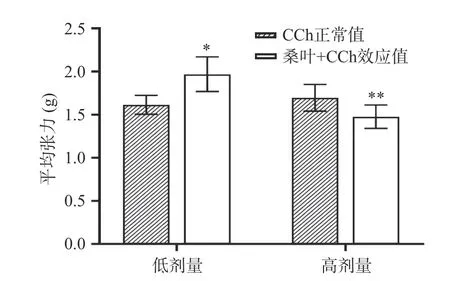
图3 桑叶水提物对卡巴胆碱诱发豚鼠离体回肠平均张力的影响Fig.3 Effects of water extract of mulberry leaves on carbaccholine-induced average tension of isolated ileum of guinea pigs
2.2 桑叶水提物对便秘大鼠常规观测指标的影响
观察各组大鼠第一白便时间及24 h 粪便粒数,结果显示,与空白组相比,造模3 d 模型组第一白便时间显著延长(P<0.05,图4),与模型组相比,桑叶水提物组有所缩短;造模7 d 组作用不明显,但变化趋势相同。与空白组相比,造模3 d 模型组24 h 粪便粒数明显减少(P<0.05,图5),桑叶水提物组有一定回升;造模7 d 模型组24 h 粪便粒数有所减少,桑叶水提物组与模型组相比,明显升高(P<0.05,图5)。而且7 d 模型组第一白便时间较3 d 时有所缩短,推测可能由于随着洛哌丁胺给药时间的延长,对肠道抑制作用减弱,与文献研究结果一致[38]。测定各组小肠推进率,结果显示,与空白组相比,造模7 d 模型组的小肠推进率显著降低(P<0.01,图6),而桑叶水提物组则明显高于模型组(P<0.05,图6)。造模3 d 组作用不明显,但也有相同趋势。

图4 各组大鼠第一白便时间Fig.4 The first defecation time of rats in each group

图5 各组大鼠24 h 粪便粒数Fig.5 The fecal granules number of rats in each group at 24 h

图6 各组大鼠小肠推进率Fig.6 Small intestine propulsion rate of rats in each group
2.3 桑叶水提物对卡巴胆碱诱发便秘大鼠离体回肠收缩平均张力的影响
桑叶水提物对卡巴胆碱诱发便秘大鼠离体回肠收缩张力的影响如图7 所示。与空白组相比,3 d 和7 d 模型组的平均张力均显著降低,且均具有统计学差异(P<0.01)。与模型组相比,3 d 与7 d 桑叶水提物组的肠肌平均张力均明显升高,且有统计学差异(P<0.05,P<0.01),说明便秘大鼠的肠蠕动减慢,可能与兴奋性神经递质减少,平滑肌张力降低有关。这与文献报道[1]便秘后兴奋性神经递质水平降低,抑制性神经递质升高是一致的。

图7 桑叶水提物对便秘大鼠离体回肠平均张力的影响Fig.7 Effect of water extract of mulberry leaves on average tension of isolated ileum of constipation rats
2.4 桑叶水提物对便秘大鼠结肠组织形态及水通道蛋白表达的影响
HE 染色结果,造模3 d 和造模7 d,模型组肌层厚度轻度降低,桑叶水提物组肌层则有变厚的趋势(图8),与已报道结果一致[39],说明便秘大鼠肠蠕动的减慢可能与肠肌变薄有关;AQP3 染色结果可知,造模3 d 时,模型组AQP3 有所降低,桑叶给药后未见改善,可能是造模时间短,机体自身调节等因素引起的不稳定;与空白组相比,造模7 d 模型组的AQP3表达水平有所升高,桑叶组显著低于模型组,甚至低于空白组(P<0.05,P<0.05,图9),说明洛哌丁胺给药后可导致结肠对水分的过度吸收,降低结肠内容物含水率,导致便秘,而桑叶水提物可通过降低AQP3 表达[5,40],抑制水分过度吸收,缓解便秘。

图8 各组大鼠结肠HE 染色(100×)Fig.8 Colon HE staining of rats in each group (100×)

图9 各组大鼠结肠AQP3 免疫组化结果(400×)Fig.9 Immunohistochemical results of AQP3 in colon of rats in each group (400×)
3 讨论与结论
便秘是以排便困难、排便次数减少、粪便干硬为主要表现的消化系统疾病[1,36,41]。有研究[31]总结了便秘相关的动物模型,复方地芬诺酯和洛哌丁胺灌胃法最常见,且造模时间多为7 d,本着将桑叶开发为功能食品或保健品预防便秘的原则,并探讨不同给药时间的效果,本研究通过洛哌丁胺灌胃给药建立轻型便秘模型[42−43],分别为造模3 d 和造模7 d,同时给桑叶水提物干预进行研究。结果表明,造模3 d 模型组第一白便时间与24 h 粪便粒数变化较为显著,并且桑叶给药后可降低便秘大鼠第一白便时间,增加排便量;造模7 d 模型组对应指标变化较小,但桑叶水提物组均有一定改善;造模7 d 模型组小肠推进率较空白组显著降低,桑叶水提物组较模型组显著升高。离体肠肌运动反映了肠道动力功能,可作为评价便秘的良好指标[34]。本团队对各组离体回肠给予相同剂量的卡巴胆碱,结果表明,便秘模型组的离体回肠平均张力明显降低,而桑叶水提物给药组与模型组相比有明显改善,且造模7 d 模型组较造模3 d 模型组降低更为显著。造模3 d 或造模7 d 模型组肌层厚度降低,而桑叶水提物组有所改善。结肠组织AQP3 免疫组化结果显示,造模3 d时模型组有所降低,桑叶给药后进一步降低;而造模7 d 时,模型组AQP3 升高,桑叶给药后明显降低。本实验结果显示,桑叶水提物对不同病程及给药周期,均可通过增加排便,延长小肠推进,增厚肠道肌层,增强肠道收缩张力,降低AQP3,抑制结肠对水分的过度吸收等发挥缓解便秘、润肠通便的作用。
桑叶作为药食同源植物之一,在功能性食品开发领域有较大群众基础和产业优势,但其主要的药理作用和作用机制,尚未得到进一步的验证,导致对桑叶的开发仍处于摸索状态。本研究主要探索了桑叶水提物对便秘的影响,可知,便秘模型组排便减少,肠道蠕动减慢,结肠肌层变薄,AQP3 有一定增多;而桑叶水提物通过增加排便,促进肠道蠕动,使肠肌增厚,降低AQP3 表达水平,抑制结肠对水分的过度吸收等发挥润肠通便的作用。为后续桑叶相关的功能性食品或保健品开发提供数据支持和理论参考。为了进一步探讨桑叶改善便秘作用的主要化学成分,后期将研究桑叶不同提取部位对肠道的影响,包括桑叶总黄酮的涩肠作用等,并通过肠道菌群等研究进一步探讨其改善便秘的作用机制。

