利用电子顺磁共振技术研究美拉德产物对不同自由基清除活性的影响
章银良,黄天琪,王悦,王明雷,李振城,陈科宇
(郑州轻工业大学 食品与生物工程学院,郑州 450001)
美拉德反应(Maillard reaction,MR)是指在一定条件下含羰基的碳水化合物与含氨基的氨基酸、多肽或蛋白质之间的两种基团发生缩合反应,形成的棕黑色聚合产物即美拉德反应产物(Maillard reaction products,MRPs)[1-2]。 MRPs具有还原酮、呋喃、类黑精等物质,因此具有较强的抗氧化活性[3-5]。MRPs中抗氧化活性物质能够很好地提高食品的货架期、抑菌性等性能[6-8]。在食品加工过程中,合理控制美拉德反应条件以此提高抗氧化活性产物的生成,可以减少食品中人工合成的抗氧化剂的使用,提高食品的安全性[9-10]。
电子自旋共振(electron spin resonance,ESR)是一种快速、简单、能直接以谱图的形式反映自由基的种类及数量的技术[11]。可根据自由基的ESR谱图的强度变化来反映物质的抗氧化活性能力。常用的紫外分光光度法在抗氧化活性研究中容易受到样品本身的影响。例如郭学文等[12]在类胡萝卜素的抗氧化活性研究中发现,ESR法与紫外法所测抗氧化活性不一致,可能是番茄红素本身在517 nm处能与DPPH光谱特征峰重叠所致。
在前期研究中,运用紫外分光光度法和ESR法对美拉德反应的单因素结果相差甚大,且随着美拉德反应条件的变化,MRPs的褐变程度也产生变化,这极大程度地干扰到了运用紫外法对MRPs抗氧化活性的最优条件的确定[13]。目前应用ESR技术研究MRPs的抗氧化活性的报道甚少,且应用ESR法测定其他材料的抗氧化活性的指标较为单一,本实验借助芬顿反应以及2种自制合成材料,通过自由基与捕获剂随时间的动态变化,确定最佳测定时间以及MRPs的最佳测定浓度,扩大了MRPs抗氧化活性研究指标,为深入研究MRPs提供了参考依据。
1 材料、设备与方法
1.1 试剂与材料
D-核糖(AR)、D-阿拉伯糖(AR)、L-精氨酸(AR)、L-赖氨酸(AR)、L-甘氨酸(AR):北京索莱宝科技有限公司;氢氧化钠(AR)、无水乙醇(AR):天津市永大化学试剂有限公司;盐酸、双氧水(30%过氧化氢):烟台市双双化工有限公司;1,1-二苯基-2-苦肼基自由基 (DPPH(AR),进口试剂);5,5-二甲基-1-吡咯啉-N-氧化物(DMPO):上海麦克林生化科技有限公司;二甲基亚砜(DMSO)(AR):天津市富宇精细化工有限公司;硫酸亚铁(AR):天津市化学试剂三厂;甲醇(AR):天津市致远化学试剂有限公司。
1.2 仪器设备
SQP电子天平 赛多利斯科学仪器(北京)有限公司;E-scan Bruker电子顺磁共振波谱仪 德国布鲁克科技(北京)有限公司;FE20 pH计 瑞士梅特勒-托利多公司;HH-1智能型数显恒温油浴槽、HH-S水浴锅 巩义市予华仪器有限责任公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;Tecan Spark 20M多功能微孔板读数仪 瑞士Tecan公司;Microsolar 300 氙灯稳流电源、氙灯光源 北京泊菲莱科技有限公司。
1.3 方法
1.3.1 MRPs制备
准确称量1.25 g的一种糖(D-阿拉伯糖、D-核糖)和一种氨基酸(L-赖氨酸、L-精氨酸、L-甘氨酸),共同溶解于45 mL的去离子水中,并分别用4 mol/L的HCl溶液和6 mol/L的NaOH溶液调整pH至10.0,然后用去离子水定容至50 mL,混合均匀。量取10 mL反应液转移至25 mL带盖螺口试管中,密封严实后,置于120 ℃恒温油浴槽中反应1 h。反应结束后快速置于冰水中冷却并进行相关测定,每组反应平行3次,剩余样品置于-20 ℃冰箱中保存备用。
1.3.2 MRPs清除羟基自由基的测定
1.3.2.1 反应时长确定
根据Aleksandra等[14]的研究方法,于2.5 mL离心管中依次加入20 μL DMPO、420 μL去离子水、20 μL 5 mmol/L FeSO4并用涡旋仪振荡40 s。随后添加20 μL 50 mmol/L H2O2并计时。用毛细管虹吸23.77 μL(d=0.93 mm, h=35 mm)样品于90 s开始测量,每隔30 s扫描一个ESR图谱,共测1 h并记录第2条主峰峰高。
测量参数:频率9.790245 GHz,调制幅度1.01 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益为1.00×103,中心磁场3487 G,功率5.00 mW,扫描宽度100 G,调制频率86.00 kHz,横坐标点数512。
1.3.2.2 不同浓度和不同种类的MRPs对羟基自由基清除率的影响
在2.5 mL离心管中依次加入20 μL DMPO、420 μL去离子水、20 μL 5 mmol/L FeSO4并用涡旋仪振荡40 s。再加入20 μL不同浓度的核糖与精氨酸反应产生的MRPs(未稀释、2倍稀释、5倍稀释、15倍稀释、20倍稀释、50倍稀释)以及10倍稀释的不同种类的MRPs,以等量去离子水作为空白组。随后吸取20 μL 50 mmol/L H2O2并计时,用毛细管虹吸23.77 μL样品于150 s开始测量并记录第2条主峰峰高。空白组记为 Ac,实验组记为 As。羟基自由基清除率计算公式如下:
测量参数:扫描间隔时间0,其余参数同上。
1.3.3 MRPs清除超氧阴离子自由基的测定
1.3.3.1 反应时间确定
依照Zhang Jingtao等[15]制备的碳点和钯共修饰自掺杂二氧化钛(CdS/Pd/Ti3+-TiO2)纳米材料,取20 mg纳米材料加20 mL无水甲醇溶液、50 μL DMPO氙灯照射25 min后(冷循环降温),用0.22 μm尼龙膜过滤。用毛细管虹吸23.77 μL滤液于6 min开始测量,每隔1 min扫描一次,共测30 min,并记录第1条主峰峰高。
ESR测定条件;频率9.793810 GHz,中心磁场3487 G,调制幅度2.02 G,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益为1.42×103,氙灯功率为300 W,其余参数同1.3.2。
1.3.3.2 不同浓度以及不同种类的MRPs对超氧阴离子自由基清除率的影响
于2.5 mL离心管中加入250 μL上述光照材料滤液、10 μL不同浓度的核糖与精氨酸反应产生的MRPs(未稀释、5倍稀释、50倍稀释、100倍稀释、200倍稀释)以及50倍稀释的不同种类的MRPs,以等量去离子水作为空白组。用毛细管虹吸23.77 μL(d=0.93 mm, h=35 mm)样品于8 min开始测量并记录谱图二重积分值。空白组记为Ac,实验组记为As。超氧阴离子自由基清除率计算公式如下:
ESR测定条件;扫描间隔时间0,其余参数同上。
1.3.4 MRPs清除羧基自由基的测定
1.3.4.1 反应时长确定
参考Tong Meiping等[16]的方法制备磁性Fe3O4/MoS2纳米复合材料,取20 mg复合材料、500 μL 30% H2O2溶于20 mL DMSO中,磁力搅拌后用0.22 μm尼龙膜过滤,于2.5 mL离心管中依次加入10 μL DMPO、800 μL过滤样品液,并用涡旋仪振荡20 s。用毛细管虹吸23.77 μL样品于2 min开始测量,每隔2 min扫描一个ESR图谱,共测200 min并记录第1条主峰峰高。
测量参数:频率9.791555 GHz,调制幅度1.80 G,时间常数40.96,扫描时间20.97 s,扫描间隔时间99.03 s,接收机增益为3.17×103,其余参数同1.3.2。
1.3.4.2 不同浓度以及不同种类的MRPs对羧基自由基清除率的影响
于2.5 mL离心管中依次加入10 μL DMPO、800 μL上述过滤液并分别加入10 μL不同浓度的阿拉伯糖与甘氨酸反应产生的MRPs(20倍稀释、50倍稀释、100倍稀释、200倍稀释、600倍稀释、1000倍稀释)以及200倍稀释的不同种类的MRPs,以等量去离子水作为空白组。涡旋振动后暗反应30 min用毛细管虹吸23.77 μL样品并测量,并记录第1条主峰峰高,空白组记为Ac,实验组记为As羧基自由基清除率计算公式如下:
ESR测定条件:扫描时间间隔0,其余参数同上。
1.4 数据处理
所有的实验均做3次平行,采用WINEPR-Processing、Origin 8.0、Mathematics 4.0及其相关方法进行处理,并用SPSS软件进行显著性分析(p<0.05表示差异显著)。
2 结果与讨论
2.1 MRPs对清除羟基自由基活性的影响
2.1.1 测量时间的确定
羟基自由基第2条峰峰值强度随时间变化关系曲线见图1。
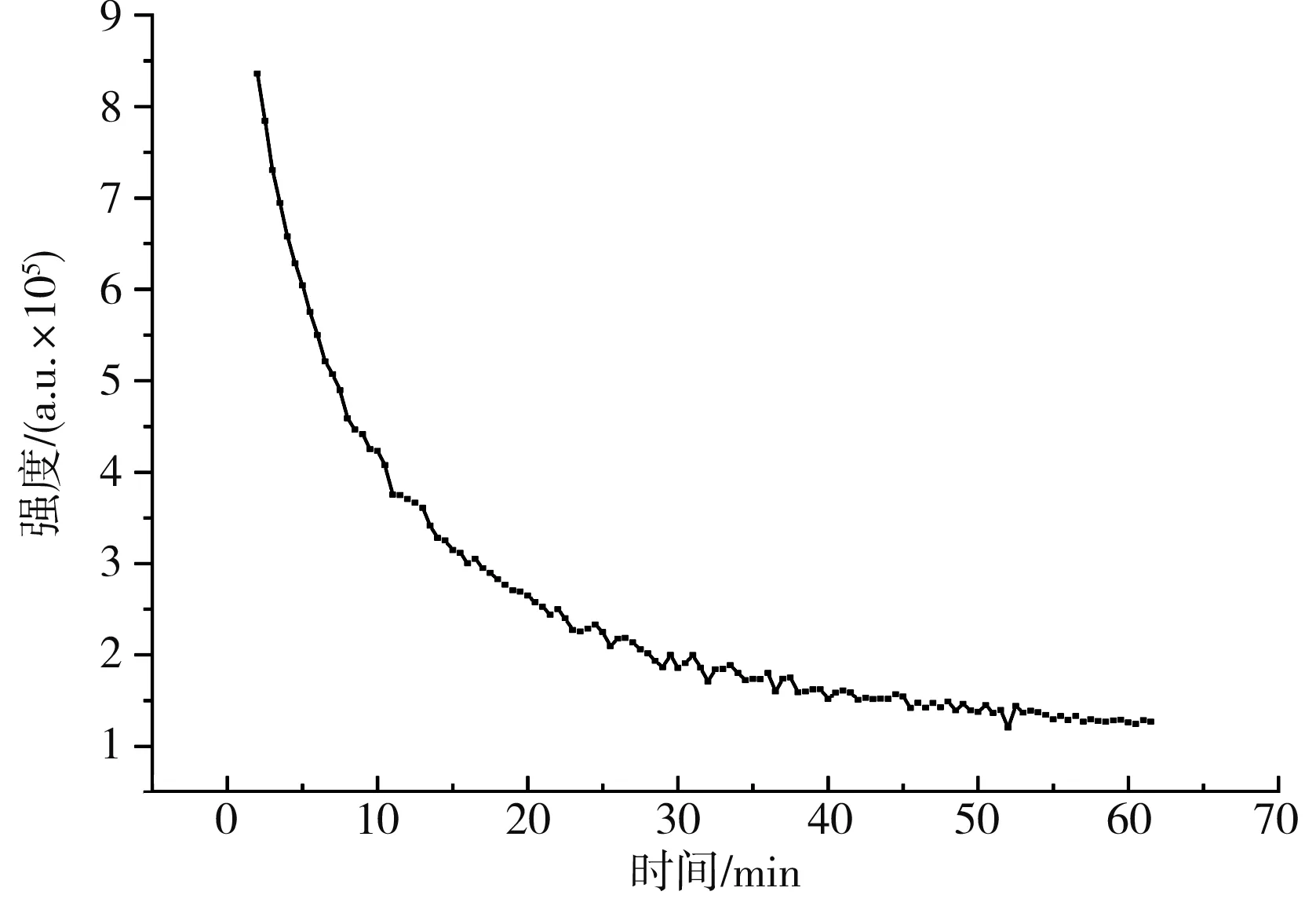
图1 羟基自由基第2条峰峰值强度随时间变化关系曲线Fig.1 The change curve of peak intensity of the second peak of hydroxyl radicals with time
由图1可知,DMPO捕获羟基自由基后不稳定,羟基自由基的含量随着时间的延长呈现出减少的趋势。在30 min内,羟基自由基含量减少迅速,在30~60 min接近平缓。因此,羟基自由基测量可采取两种方式。第一种方法可将混合样品暗反应30 min后测量,此方法所得ESR谱图信号强度较弱。第二种方法即确保每个样品在加入H2O2后3 min之内的同一时间测量,此方法重复性较好且ESR谱图清晰。考虑实际上样所需时间,本实验采用第二种方法混合反应物并计时150 s进行测量。
2.1.2 不同稀释倍数的MRPs对羟基自由基清除率的影响
不同稀释倍数的MRPs对羟基自由基清除率的影响见图2。
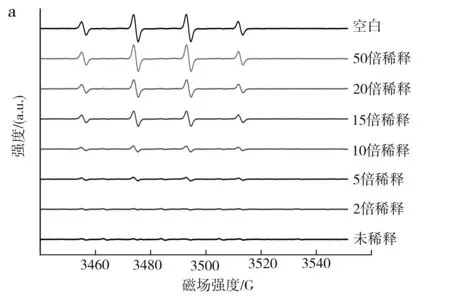
由图2可知,羟基自由基的ESR谱图为中间高、两端低的四重峰。在加入MPRs后,其峰高和面积逐渐减小,但峰形基本保持不变。MRPs对羟基自由基的清除效果较为明显,随着MRPs浓度降低,对羟基自由基的清除率逐渐减小。为了很好地得到羟基自由基ESR谱图的同时又能保证样品之间的清除效果对比明显,采用10倍的MRPs稀释液作为测量不同浓度的MRPs对羟基自由基清除能力影响的反应物。
2.1.3 不同种类的MRPs对羟基自由基清除率的影响
不同种类的MRPs对羟基自由基清除率的影响见图3。

图3 不同种类的MRPs对羟基自由基清除能力的影响关系图Fig.3 Effects of different kinds of MRPs on scavenging ability of hydroxyl radicals
由图3可知,不同氨基酸与糖在同一模拟体系下反应产生的MRPs对羟基自由基的清除效果不同,清除能力由大到小依次为核糖与甘氨酸>阿拉伯糖与甘氨酸>阿拉伯糖与赖氨酸>核糖与赖氨酸>核糖与精氨酸>阿拉伯糖与精氨酸。在所选材料研究范围内发现,MRPs对超氧阴离子的清除效果与氨基酸的种类关系密切,即当糖类固定时,不同氨基酸对羟基自由基清除能力大小依次为甘氨酸>赖氨酸>精氨酸。
2.2 MRPs对清除超氧阴离子自由基活性的影响
2.2.1 ESR反应时间的确定
超氧阴离子自由基第1条峰峰值强度随时间变化关系曲线见图4。

图4 超氧阴离子自由基第1条峰峰值强度随时间变化关系曲线Fig.4 The change curve of peak intensity of the first peak of superoxide anion radicals with time
由图4可知,在6~36 min内,超氧阴离子强度随着时间延长呈现出波动稳定的状态,呈现出波动的原因可能是材料在共振腔内有少量的超氧阴离子自由基产生,而超氧阴离子自由基和DMPO结合的化合物随着时间的延长而减少。在本实验研究中,6~36 min内超氧阴离子自由基强度值的极差值为0.573,因此在光照后需要固定时间再使用。本实验以下研究选取样品测量时间为8 min。
2.2.2 不同浓度的MRPs对超氧阴离子自由基清除率的影响
不同浓度的MRPs对超氧阴离子自由基清除率的影响见图5。
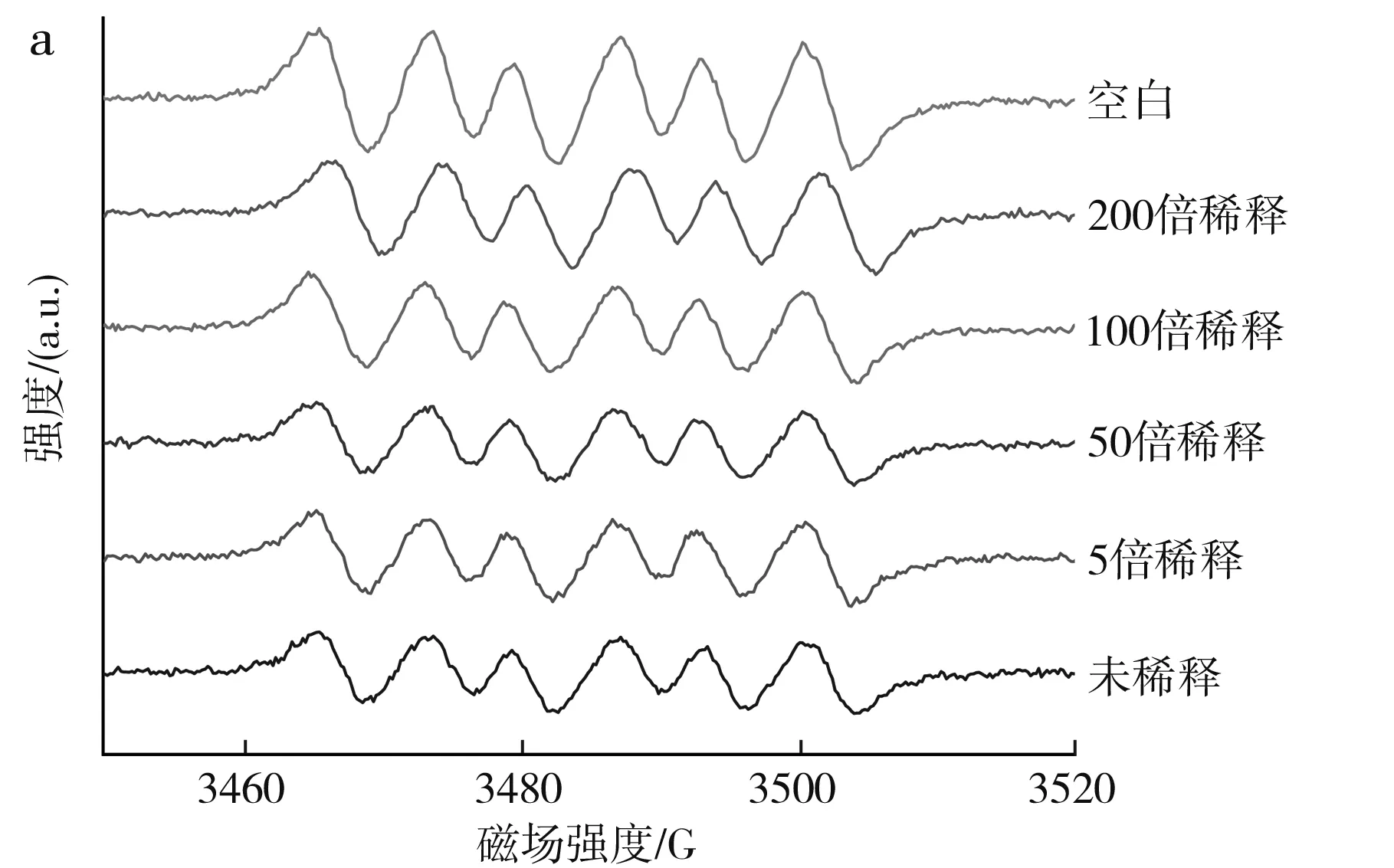
由图5可知,超氧阴离子自由经过DMPO捕获后,其波谱图由6个主要的峰构成,在加入MPRs后,其峰高和面积逐渐减小,但峰形基本保持不变(有少数峰出现分叉主要是检测样品的超氧阴离子浓度过低导致)。MRPs 对超氧阴离子清除效果较为明显,随着MRPs浓度降低,超氧阴离子的自由基的清除率逐渐减小。因此,采用50倍的 MRPs 稀释液作为超氧阴离子自由基清除的反应物,可以很好地得到超氧阴离子自由基的ESR谱图,同时又能保证样品之间的清除效果对比明显。
2.2.3 不同种类的MRPs对超氧阴离子自由基清除率的影响
不同种类的MRPs对超氧阴离子自由基清除率的影响见图6。

图6 不同种类的MRPs对超氧阴离子自由基清除能力的影响关系图Fig.6 Diagram of effects of different types of MRPs on scavenging ability of superoxide anion radicals
由图6可知,不同氨基酸与糖在同一模拟体系下反应产生的MRPs对超氧阴离子的清除效果不同,清除能力由大到小依次为核糖与精氨酸>阿拉伯糖与精氨酸>阿拉伯糖与赖氨酸>核糖与赖氨酸>核糖与甘氨酸>阿拉伯糖与甘氨酸。在所选材料研究范围内发现,MRPs对超氧阴离子自由基的清除效果与氨基酸的种类关系密切,即当糖类固定时,不同氨基酸对超氧阴离子自由基的清除能力大小依次为精氨酸>赖氨酸>甘氨酸。
2.3 MRPs对清除羧基自由基活性的影响
2.3.1 ESR反应时间的确定
羧基自由基峰值强度随时间变化关系曲线见图7。

图7 羧基自由基随时间变化关系图Fig.7 The change curve of carboxyl radicals with time
由图7可知,DMPO捕获的羧基自由基具有相对稳定性,羧基自由基的含量随着时间的延长呈现出先增加后减少的趋势。在2~38 min内,羧基自由基急速增大,于38 min达到最大值。随后呈现缓慢减少趋势,在28~76 min内,羧基自由基增减较为平缓,极差值为0.536。根据本实验样品数量实际情况综合考虑,可采取暗反应40 min进行测量。此时间阶段测量使羧基自由基的ESR图清晰且可以减少由于测量时间的不同造成的实验误差。
2.3.2 不同浓度的MRPs对羧基自由基清除率的影响
不同浓度的MRPs对羧基自由基清除率的影响见图8。
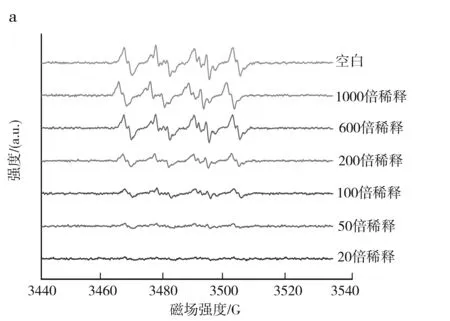
由图8可知,在加入MPRs 后,羧基自由基的ESR谱图的峰高和面积逐渐减小,峰形基本保持不变。MRPs对羧基自由基的清除效果较为明显,随着MRPs浓度降低,羧基自由基清除率逐渐减小。为了很好地得到羧基自由基ESR谱图的同时又能保证样品之间的清除效果对比明显,因此采用200倍的MRPs稀释液作为羧基自由基清除的反应物。
2.3.3 不同种类的MRPs对羧基自由基清除率的影响
不同种类的MRPs对羧基自由基清除率的影响见图9。
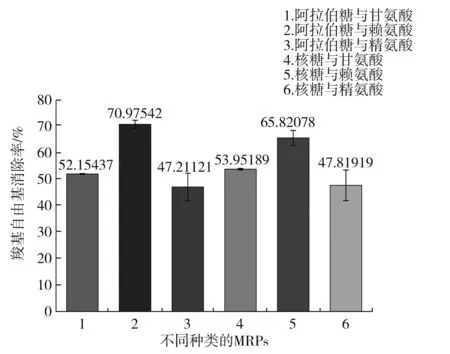
图9 不同种类的MRPs对羧基自由基清除能力的影响关系图Fig.9 Diagram of effects of different kinds of MRPs on scavenging ability of carboxyl radicals
由图9可知,不同氨基酸与糖在同一模拟体系下反应产生的MRPs对羧基自由基的清除效果不同,清除能力大小顺序为阿拉伯糖与赖氨酸>核糖与赖氨酸>核糖与甘氨酸>阿拉伯糖与甘氨酸>核糖与精氨酸>阿拉伯糖与精氨酸。在所选材料研究范围内发现,MRPs对超氧阴离子自由基的清除效果与氨基酸的种类关系密切,即当糖类固定时,不同氨基酸对超氧阴离子自由基清除能力大小顺序为赖氨酸>甘氨酸>精氨酸。
3 结论
MRPs对超氧阴离子自由基、羧基自由基、羟基自由基的清除能力大小不同,说明MRPs具有较好的抗氧化活性,且MRPs清除不同自由基的机理可能不同,这需要进一步实验进行研究。不同种类的MRPs对于同种自由基的清除能力大小与氨基酸的种类以及MRPs的浓度密切相关,证明上述合成的两种自制材料与芬顿反应产生的自由基都可应用于抗氧化活性的研究指标。通过自由基与捕获剂(DMPO)的动态研究发现,不同的自由基与DMPO结合后的稳定性不同,因此测量时间的确定十分关键。

