高原鼢鼠血红蛋白基因鉴定、表达及其分子进化分析*
鲁松松,赵夏下,祁重霞,杜雨薇
甘肃农业大学林学院,甘肃 兰州 730070
高原土著动物的血红蛋白(Hb,hemoglobin)普遍进化出较高的氧亲和力,属于生理适应的经典例子[1]。大量的比较研究结果显示,高海拔啮齿类动物通常具有较低海拔近缘物种更高的血红蛋白或血液氧亲和力[2-4]。低氧条件下,Hb氧亲和力的升高使得动、静脉氧分压差值最大化,从而有效提高机体的氧运输效率[5]。有颌类脊椎动物的Hb 是由2 个相同α 亚基和2 个相同β 亚基组成的异源四聚体,每个亚基包含一个血红素(Heme)辅基,亚铁离子(Fe2+)位于卟啉环中心位置,可逆地与1分子氧气结合以发挥Hb 的运输功能。四聚体结构赋予Hb与配体结合的协同效应和变构效应。Hb氧亲和力的进化改变主要涉及α 和β 亚基的氨基酸突变引起的协同效应(固有氧亲和力)及变构效应(变构因子的敏感度)的改变。
高原鼢鼠Eospalax baileyi是青藏高原特有的地下鼠,隶属鼹形鼠科Spalacidae 鼢鼠属Myospalax凸颅亚属Eospalax。其生存不仅要面临高原和密闭洞穴双重低氧的挑战,同时还受到洞穴高二氧化碳环境的影响。据报道,高原鼢鼠栖息地大气氧分压约为海平面水平的65%,其居住洞穴内(地下18 cm)氧含量约为大气的83%~88%,且CO2含量最高值可达大气含量的48.6 倍[6]。已有的研究表明,高原鼢鼠长期生活在如此严苛的环境中,其形态特征、心肺器官、血液循环系统以及分子水平都表现出适应低氧-高二氧化碳环境的特征,如心脏每搏输出量、肺部单位面积肺泡数、红细胞数和Hb 含量、动静脉氧分压差等氧气运输的各环节均呈现出协同的改变[7-9]。最新的研究结果表明,高原鼢鼠纯化Hb 的固有氧亲和力显著高于小鼠,且加入DPG 和CL-等变构因子后高原鼢鼠Hb 的P50值(Hb 50%氧饱和度下的氧分压)依然显著低于小鼠[10],说明高原鼢鼠升高的Hb 氧亲和力可能是遗传基础改变引起的,是自然选择的结果。值得注意的是,在相同条件下,高原鼢鼠Hb 的固有氧亲和力[P50仅为(706.23 ±7.98)Pa],显著低于其他啮齿类近缘种,如小鼠[(960.26 ±3.99)Pa]、家鼠(约为984.20 Pa)、高原鼠类鹿鼠Peromyscus maniculatus(1 010.80~1 170.40 Pa)及同样营严格地下生活的6 种非洲鼹形鼠(982.87~1 401.82 Pa)[11-13]。高原鼢鼠成体Hb 的P50值与哺乳动物胚胎型Hb(532.00~798.00 Pa)更接近[14]。此外等电聚焦电泳结果显示,高原鼢鼠成体红细胞中表达了2 种主要Hb 组分,一种含量稍高的组分具有较低的等电点(pI,isoelectric point),另一种含量稍低的组分具有较高的pI[10],这与其他哺乳动物完全不同(成体红细胞中仅表达1 种主要Hb 亚型)[1]。为维持机体在不同环境中的氧供需平衡,理论上机体可以通过对具有不同氧合特性的Hb 亚型(氧亲和力不同)的表达调节,从而可逆地调节血氧亲和力,但这种调节机制较常见于鸟类,在哺乳动物中尚未发现[1,15-16]。因此,鉴定两种Hb亚型的组成是目前深入理解和阐释高原鼢鼠Hb适应低氧-高二氧化碳环境机理的关键。
随着测序技术的发展和应用,基因组和转录物组学研究在非模式动物中广泛应用,近期高原鼢鼠基因组和多个组织转录物组数据使用权限的开放,极大地便利了对高原鼢鼠基因组Hb基因的鉴定和表达分析。本文通过比较基因组和转录物组学分析了高原鼢鼠基因组中Hb基因组成及在成体各组织中的表达情况,初步鉴定了两种成体Hb亚型的组成,并通过分子进化及蛋白质理化性质和结构分析深入探讨了高原鼢鼠Hb 进化出较高氧亲和力的潜在机制。本研究首次发现哺乳类动物胚胎型αE基因在成体中表达,这可能是成体高原鼢鼠Hb 具有异常高氧亲和力的主要原因,为哺乳动物低氧适应的研究和高原医学的发展提供理论依据和新的思路。
1 材料与方法
1.1 血红蛋白基因鉴定和基因簇结构分析
从数据库中下载小鼠(NCBI,GRCm39)、银星竹鼠(NCBI,RhiPru_1.0)、以 色 列 鼹 鼠(NCBI,S. galili_v1.0)和 高 原 鼢 鼠(NGDC,plateau_zokor_v2.1)基因组序列及其注解文件(GFF)。基因注解使用BLAST 软件(2.11.0 版)[17],比对到的基因组片段通过GenScan 在线服务(https://www.genes.mit.edu/GENSCAN.html)进行基因、编码区序列(CDS,coding sequence)和蛋白质预测。通过Mega 软件将对齐后的序列进行手动矫正。本文将CDS 序列内提前出现终止密码子和碱基缺失/插入导致的三联密码子错位认定为假基因。对NCBI数据库中存放的基因组、基因簇DNA 序列全长使用Nucleotide 库根据各基因在基因组片段的位置获取。高原鼢鼠Hb基因及基因簇DNA序列全长使用自编Perl语言脚本进行提取。基因簇结构可视化使用GSDS2.0 在线服务完成(http://gsds. cbi. pku.edu.cn/)。
1.2 转录物组数据和转录本从头组装
本文选用NCBI 数据库中高原鼢鼠所有组织样品的转录物组测序数据以评估高原鼢鼠Hb基因的表达, 包括肾脏、 骨骼肌和视网膜组织(PRJNA282349,N=1),以及脑(PRJNA342079,N=3)和肝脏组织(PRJNA211727,N=3)。选用小鼠胚胎及成体组织的测序数据,以验证啮齿类基因组中胚胎型和成体型Hb基因的组成,包括3.5 d(PRJNA674788,N=3)和5.5 d(PRJNA683789,N=3)单囊胚,13~15 d肝脏(PRJNA625751,N=3)、心脏(PRJNA602232,N=3)和脑(PRJNA670344,N=3)组织,成 体 心 脏(PRJNA264588,N=3)、肝 脏(PRJNA668230,N=3)、脑(PRJNA674888,N=3)、骨骼肌(PRJDB10551,N=3)、肾脏(PRJNA543476,N=3)及视网膜(PRJNA435475,N=3)。转录物组测序基础数据使用自编Perl语言脚本进行过滤(删除低质量值的双末端测序reads)。使用Trinity 软件(2.11.0 版)[18]对过滤后的数据分别进行从头组装,得到转录本后,使用上述BLAST法鉴定Hb基因的转录本。从头组装的转录本用于进一步确定基因组注解中预测的假基因及CDS序列的准确性。
1.3 血红蛋白基因系统发生关系重建和分子进化分析
本文分别采用最大似然(maximum likelihood)和贝叶斯(Bayesian)法对Hb基因进行系统发生重建。DNA 全长序列用MUSCLE 软件[19]对齐后,使用Treefinder 软 件(http://www. treeFinder. de/)和Mrbayes 软件(3.2.7a)[20]分别构建最大似然树和贝叶斯树。其中,最大似然树使用Propose Model 插件选择最优替代模型后,采用bootstrap 抽样检验法(1 000 次)评估分枝节点的支持率。贝叶斯树构建参数设置为广义时间可逆(GTR,general time reversible)模型,8 条链同时运行1 000 000 代,采用频率为1 000。舍弃前25%的老化样本(burnin)后,采用多数决定原则统计共有树及其分枝节点的贝叶斯后检验概率(Bayesian posterior probabilities)。
本文以转录本中鉴定的CDS 序列为基础,使用PAML4 软件(4.9j)[21]的分枝位点模型(branch site)分析了高原鼢鼠和甘肃鼢鼠成体表达Hb基因的潜在正选择位点。选用MA模型并指定鼢鼠分枝为前景分枝以检测该分枝中可能的正选择位点,并使用经验贝叶斯法(BEB,bayes empirical bayes)计算正选择位点的后验概率,比较模型选择空模型(null model)。上述模型间差异显著性采用似然比检验(LRT,likelihood ratio test)进行测试。
1.4 血红蛋白基因表达分析
过滤后的转录物组数据使用Bowtie2 软件(2.2.9版)[22]比对到各物种Hb基因的CDS序列上,比对参数设置为-D 20-R 3-N 0-L 20-i S,1,0.50。比对结果使用自编Perl 语言脚本进行reads 数量统计,并计算各组织中Hb基因的表达量。基因表达量表示为每百万reads 比对到CDS 序列每千碱基上的 数 量(RPKM,reads per kilobase per million mapped reads),RPKM<1 时为不表达基因。单样品测序数据仅用于评估基因是否表达。对有生物学重复样品的测序数据(N=3),使用SPSS 软件单因素方差分析(one-way ANOVA)统计差异的显著性(P<0.05时差异显著)。
1.5 蛋白质物理化学性质和结构分析
使用ExPASy 在线服务(www.expasy.org)完成蛋白质pI、总平均亲水指数(GRAVY,grand average of hydropathicity)和氨基酸亲水性/极性等物理化学性质分析。血红蛋白四聚体同源建模使用Modeller软件(9.24 版)[23]完成,同源模板选择小鼠去氧合成体血红蛋白X 射线晶体衍射结构(3HRW,0.28 nm),共构建100 个模型,使用DOPE 和GA341 方法进行评估并选择最优模型用于结构比较。同源结构比较和3D 结构显示使用VMD 软件(1.9.3 版)[24]。血红素“口袋”(heme pocket)体积计算使用GHECOM 1.0 在线服务(https://pdbj.org/ghecom/)完成。
2 结 果
2.1 鼹形鼠科动物α和β基因簇结构
本文对高原鼢鼠、银星竹鼠和以色列鼹鼠3个鼹形鼠科物种基因组中的Hb基因进行了重新鉴定,与已有研究结果相符[25],3种鼠类Hb基因中,α和β两个亚家族基因分别位于两个不同基因组片段且家族成员间相互聚集成簇(图1)。比较分析结果显示,3 种鼠类α基因簇长度不尽相同,其中高原鼢鼠(GWHABJZ00000029:10 108 817~10 119 436 bp)和 银 星 竹 鼠(VZQC01006430:2 529 015~2 541 954 bp)长度相近,约为11 kb;而以色列鼹鼠(NW_008353596:4 698 608~4 724 458 bp)长度与小鼠和人相近,约为26 kb。与小鼠相比(5′-αE,αA1,αQ2,αA2,αQ1-3′),3 种鼹形鼠科物种的α基因家族明显收敛,基因簇中仅保留了3个基因,排列模式为5′-αE,αA,αQ-3′。3种鼠类的β基因簇长度差异较大,分别为高原鼢鼠53 kb(165 907~219 796 bp)、银星竹鼠110 kb(196 599~306 296 bp)和以色列鼹鼠86 kb(752 279~838 350 bp),但基因数量相对保守,均包含7个家族成员。与啮齿目其他鼠类的研究相似[26],3种鼹形鼠科鼠类β基因簇5′端为单拷贝的胚胎型ε基因,3′ 端为至少2 个胚后表达型β基因。

图1 啮齿类动物α和β基因簇结构Fig.1 Genomic structure of the α-and β-globin gene family in rodents
2.2 血红蛋白基因的系统发生关系
基于啮齿类动物α(图2a)和β基因(图2b)DNA序列全长重建系统发生关系,结果显示最大似然树和贝叶斯树具有相似的拓扑结构。在α基因树中,鼹形鼠科鼠类3 个单拷贝α基因分别与小鼠和人 类αA(MLbs = 0.75,Bapp = 0.99)、αQ(MLbs =1.00,Bapp = 1.00)及αE(MLbs = 0.95,Bapp =1.00)形成主要分枝,其中αA和αQ两个主要分枝形成姊妹分枝组成一个根分枝(MLbs= 0.99,Bapp =1.00)。本文在所有啮齿目物种中均未发现与人类αD基因直系同源的基因。上述结果说明,鼹形鼠科鼠类3 个α基因为1∶1 直系同源基因,且啮齿类动物基因组中αD基因已被删除。

图2 啮齿类动物α和β基因系统发生关系Fig.2 Maximum likelihood phylogram describing relationships among the α-and β-globin genes of rodents
在β基因树中,鼹形鼠科鼠类β基因形成4个主要分枝:与小鼠和人类ε基因1∶1 同源的分枝(ε分枝,MLbs=0.79,Bapp=0.99);与小鼠γ基因同源的分枝(包括了鼹形鼠科鼠类γ基因及高原鼢鼠γ2基因,MLbs=0.92,Bapp=1.00);鼹形鼠科鼠类γ 1、银星竹鼠和以色列鼹鼠γ2基因、高原鼢鼠和以色列鼹鼠两个σ假基因(MLbs = 1.00,Bapp = 1.00);鼹 形 鼠 科 鼠 类β1、β2和β3基 因(MLbs = 0.99,Bapp=1.00)。已有的研究结果表明,现存啮齿类动物ε/γ和σ/β基因分别起源于真兽亚纲动物共同祖先中原ε(protoε)和原β(protoβ)基因的一次基因复制事件[27]。与上述结果相符,ε分枝与除小鼠γ1基因外的所有γ基因聚为一个根分枝(MLbs=0.80,Bapp=0.94),同时所有β基因与除高原鼢鼠和以色列鼹鼠两个σ假基因外的所有σ基因聚为一支(MLbs =0.85,Bapp=0.98)。值得注意的是,高原鼢鼠和以色列鼹鼠两个σ假基因和小鼠γ1远离了σ或γ分枝。出现这个结果的原因可能是高原鼢鼠和以色列鼹鼠γ基因(供体)与邻近的σ基因(受体)及小鼠σ基因(供体)与邻近的γ基因(受体)间发生过基因转换事件(染色体不平等交换),使得受体基因在系统发生树中远离原分枝而更接近供体分枝,这种情况在脊柱动物β基因簇中较为常见[28-29]。
2.3 小鼠和高原鼢鼠Hb基因的表达
小鼠胚胎和成体组织Hb基因表达结果(图3、图4)表明,胚胎和成体阶段Hb基因具有不同的表达谱,即使在胚胎发育的不同时期Hb基因的表达谱也明显不同。在胚胎发育早期(3.5~5.5 d),仅检 测 到αA1和αA2两 个 基 因 被 表 达,RPKM 分 别 为3.96 ±2.68 和2.11 ±0.68。在胚胎发育后期(13~15 d),除γ1和两个假基因(σ和αQ1)外其他所有基因均检测到被表达,RPKM 范围为(1.12 ±0.39)~(38 254.00 ±3 295.14)。其中αE、ε和γ基因在胚胎脑组织(14 d)中的表达量最高,RPKM 分别为213.98 ±30.93、1 111.30 ±174.57 和31.29 ±8.99;αA1、αQ2、αA2、β1和β2基因在胚胎肝脏组织(15 d)中的表达量最高,RPKM 分别为38 254.00±3 295.14、30.15 ±2.96、26 120.00 ±2 278.35、30 849.00 ±3 071.05 和24 313 ±2 645.87。在成体阶段,αA1、αA2、β1和β2在心脏、骨骼肌、脑、肝脏、肾脏、视网膜和睾丸中均被表达,RPKM 范围为(4.60 ±1.68)~(389.03 ±190.56),其他基因未检测到表达(RPKM<1)。
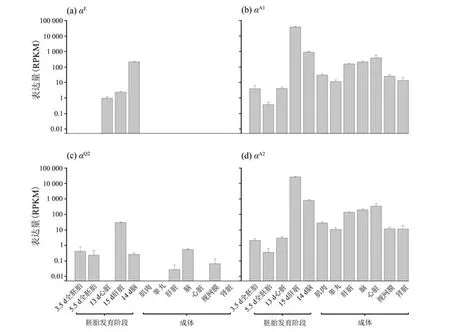
图3 α基因在小鼠胚胎和成体多个组织中的表达水平Fig.3 Expression level of α-globin genes in multiple tissues of mice embryo and adult stages

图4 β基因在小鼠胚胎和成体多个组织中的表达水平Fig.4 Expression level of β-globin genes in multiple tissues of mice embryo and adult stages
在成体高原鼢鼠肝脏和脑组织转录本中,本研究仅鉴定到αA、αE和β1基因的表达及完整的CDS 序列,其他基因RPKM 均小于1 且CDS 序列不完整。如图5 所示,高原鼢鼠肝脏和脑组织中αA(RPKM 分 别 为2 079.70 ±593.66 和1 655.90 ±475.47)和β1(RPKM 分 别 为869.12 ±147.64 和1 361.5±387.91)基因的表达量均显著高于小鼠同源基因的表达量(αA1基因RPKM 分别为157.04 ±13.45 和210.83 ±37.56;αA2基 因RPKM 分 别 为137.15 ±9.55 和200.49 ±34.43;β1基因RPKM 分别为188.88±14.74和53.58±8.64;β2基因RPKM分别为93.29 ±7.27 和44.73 ±8.90)。值得注意的是,在成体高原鼢鼠脑组织中αE基因被检测到表达(RPKM为2.58±0.53),小鼠中该基因仅表达于胚胎期(14和15 d)的肝脏和脑组织。
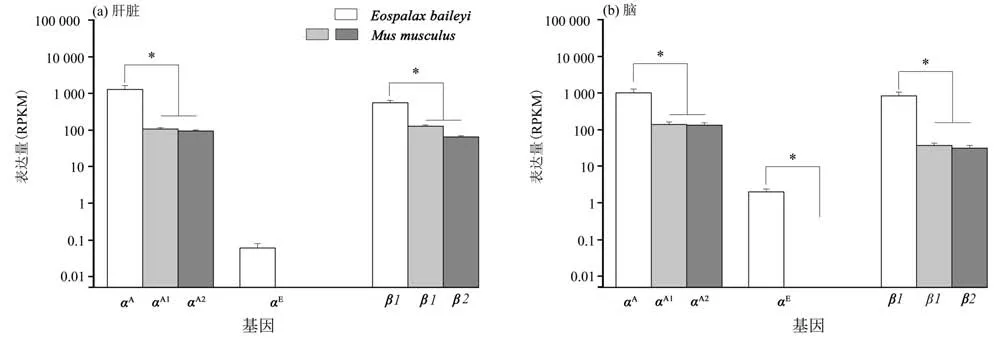
图5 成体小鼠和高原鼢鼠肝脏和脑中血红蛋白基因表达水平(*P<0.05)Fig.5 Expression level of Hb genes in liver and brain of adult mice and plateau zokor(*P<0.05)
2.4 高原鼢鼠成体表达基因的正选择位点
Pu等[10]的研究结果表明,高原鼢鼠血红蛋白α和β 亚基分别具有17 和24 个氨基酸差异,其中α 111、α131、β4、β5 和β115 等5 个氨基酸突变可能是高原鼢鼠Hb 固有氧亲和力升高及与变构因子和CO2敏感度改变的主要因素。本文采用分枝位点模型以高原鼢鼠各基因为前景分枝(foreground),分析了上述突变是否是正自然选择的结果(表1)。αA、αE和β 1基 因Model A0 的lnL值 分 别 为-1 165.27、-1 261.79 和-1 317.58,Model A1 的lnL值分别为-1 161.67、-1 261.79 和-1 312.34。LRT 检验结果显示αA和β1基因拒绝Model A0 模型(P<0.01),说明高原鼢鼠这两个基因的某些位点可能受到正选择。BEB 分析结果显示,αA和β1基因 分 别 有1 个(24Leu)和3 个(43Ser,61Ser 和87His)位点可能具有大于1 的ω值,后检验概率分别为0.933、0.639、0.939和0.711。
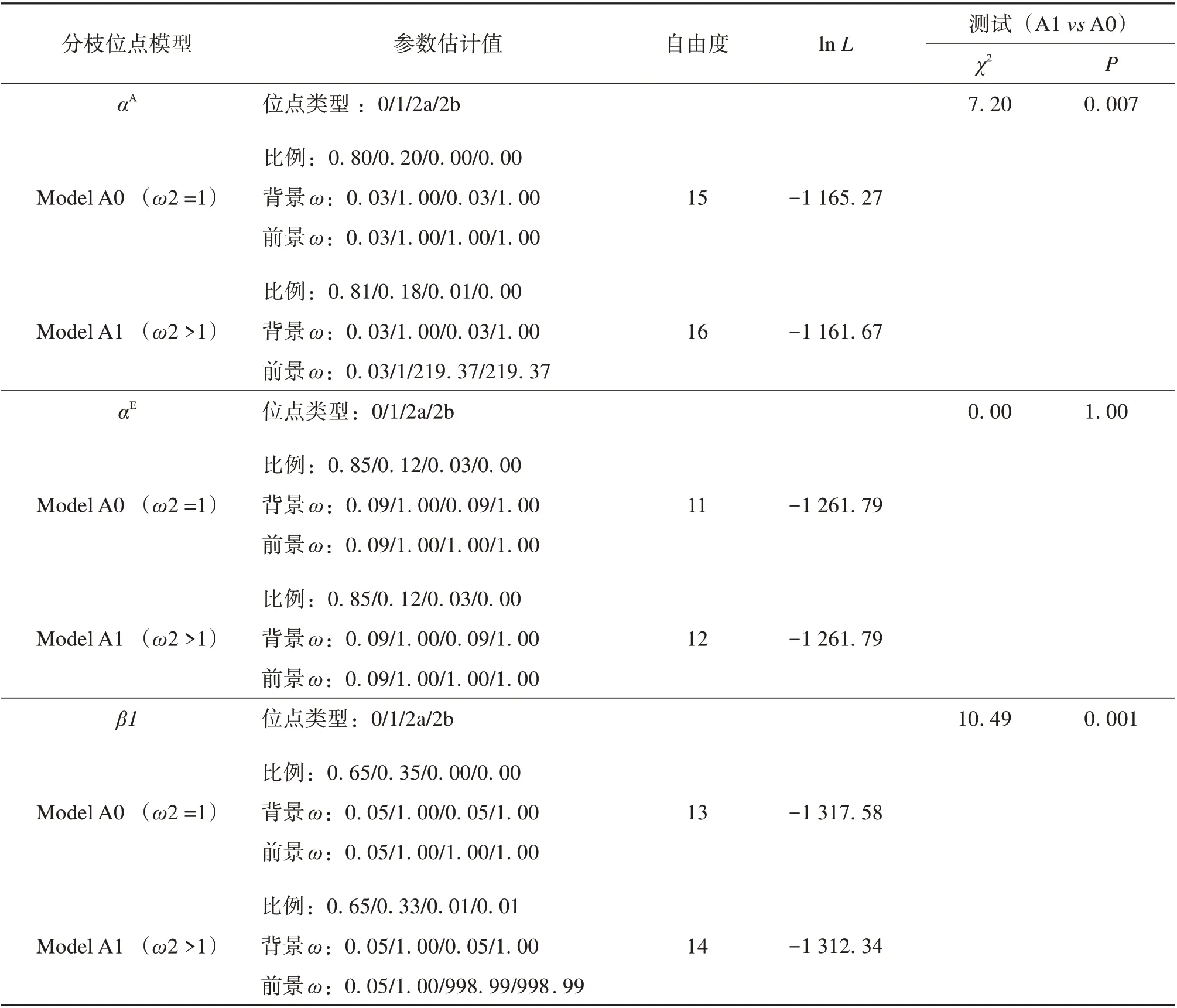
表1 高原鼢鼠成体表达血红蛋白基因的正选择分析Table 1 Maximum likelihood analysis of adult Hb genes from rodents under branch-site models
2.5 高原鼢鼠血红蛋白的物理化学性质和结构
已有研究表明,成体高原鼢鼠至少表达了2种Hb 亚型,其中低等电点的亚型相对含量稍高于另外一种高等电点亚型;成体小鼠只表达一种Hb 亚型,等电点与高原鼢鼠含量高的亚型相近[10]。基于基因表达分析结果,本文推测成体高原鼢鼠的两种Hb 亚型为成体αA型(αAβ1)2和胚胎αE型(αEβ1)2。蛋白质理化性质分析结果(表2)进一步证实了该推测,αA型Hb 是所有已知脊椎动物成体表达的主要亚型,这种模式在成体高原鼢鼠中依然保守,αA型与αE亚型相比具有较低的pI 值(分别为7.17 和7.92)。小鼠成体表达基因预测蛋白质序列结果显示,2 个α(αA1和αA2)和2 个β(β1和β2)基因最终翻译为完全相同的氨基酸序列,故非变性电泳条带只有1条(1个主要Hb组分),其αA和β多肽pI分别为7.97和7.13,这与高原鼢鼠αA型Hb两个亚基的pI 更为接近(7.17 和7.95)。此外,高原鼢鼠所有Hb亚基的GRAVY 数值均较低,说明高原鼢鼠2种Hb亚型的亲水性均较小鼠高。
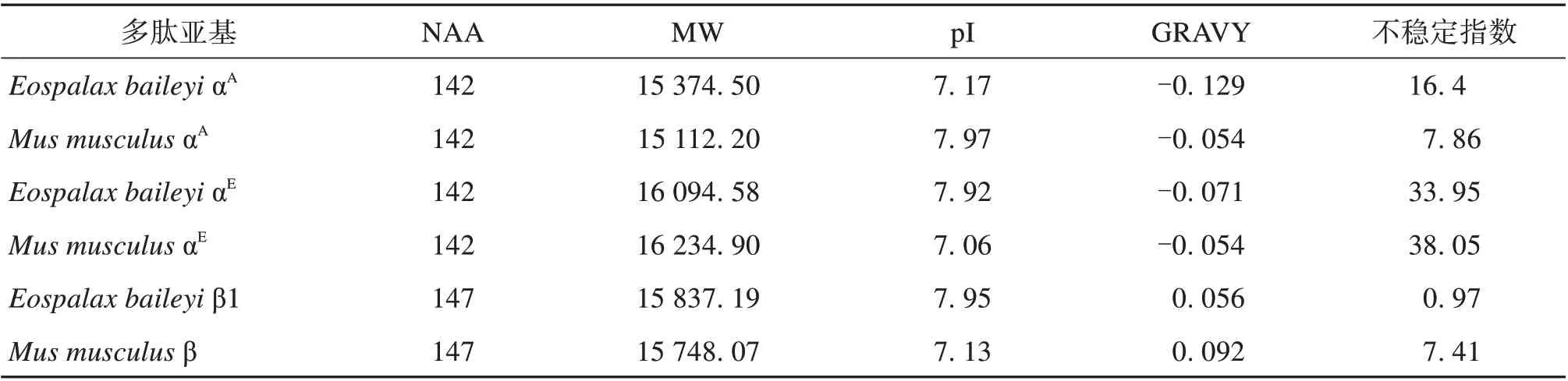
表2 小鼠和高原鼢鼠血红蛋白α和β多肽物理化学性质分析1)Table 2 Predicted physicochemical properties of hemoglobin α and β polypeptides from mice and plateau zokor
蛋白质结构比较分析结果(图6)显示,高原鼢鼠成体Hb β亚基的24个氨基酸突变中有12个(41、43、58、61、68、69、70、72、76、80、86 和87 位)位于血红素“口袋”的开口处,3 个潜在正选择位点刚好也在其中。分子动力学计算结果未检测到明显影响其T 态到R 态转变的因素(氢键或盐键形成或丢失),且这些位点也不是典型的变构因子或CO2的结合位点[10]。进一步分析结果显示(图6~图7),41Tyr-Phe和43Asp-Ser两个氨基酸突变使得该区域亲水性和极性减弱,该区域由无规则卷曲变为更稳定的α 螺旋;70Ala-Ser 和86Ala-Ser 由非极性氨基酸突变为极性氨基酸,增强了该区域的亲水性和极性,这可能是高原鼢鼠β亚基具有较小鼠高的亲水性的主要原因,同时结合87Ser-His 突变,使得86~87 位氨基酸区域由无规则卷曲变为α 螺旋;与43 和86~87 位氨基酸突变相反,80Ser-Asp 的反向突变使得原α螺旋变为无规则卷曲。上述突变造成的区域构象改变,尤其是80 位氨基酸区域α 螺旋的消失可能引起血红素“口袋”的夹角增大,最终使得血红素口袋的体积增大(由小鼠的1.132 0 nm3增加到高原鼢鼠的1.189 4 nm3),有利于提高O2的运输效率。

图6 小鼠和高原鼢鼠α型血红蛋白(αAβ1)2的三维结构模型Fig.6 Models of the three-dimensional structure of(αAβ1)2 of mice and plateau zokor
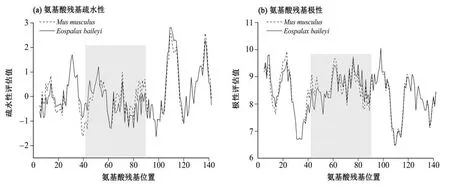
图7 小鼠和高原鼢鼠血红蛋白β亚基氨基酸残基的疏水性和极性Fig.7 The hydrophobicity and polarity of amino acid residues in hemoglobin β polypeptides of mice and plateau zokor
3 讨 论
系统发生关系结果表明,啮齿目动物共同祖先中α和β基因簇排列模式可能为5′-αE,αA,αQ-3′和5′-ε,γ,σ(pesudo),β-3′,在现存不同谱系中α和β基因亚家族经历了较为复杂的基因复制、删除、同源重组和假基因事件[26,30]。本文研究结果显示,鼹形鼠科物种α基因簇高度保守,均保留了3 个单拷贝αE,αA和αQ基因,但β基因簇在3 个物种中分别经历了不同的基因复制、删除、同源重组和假基因化事件。基于系统发生关系重建结构,本文推测鼹形鼠科共同祖先中α和β基因簇中基因排列模式分别为5′-αE,αA,αQ-3′和5′-ε,γ,γ1,σ(pseudo+γ1重组),β-3′,其中原γ基因经过复制后产生γ和γ1,γ1基因(供体)与σ假基因(受体)发生过同源重组。尽管3 种鼹形鼠科物种具有相似的β基因簇排列模式,但它们的γ2基因起源不同,高原鼢鼠起源于共同祖先中γ基因的复制,另外两个物种则起源于γ1基因的复制。高原鼢鼠、银星竹鼠和以色列鼹鼠β基因簇3′端的2~3 个β基因均为物种特异性基因复制事件的产物,其中高原鼢鼠和银星竹鼠β2基因及以色列鼹鼠β3基因产生后不久就经历了假基因化事件。与小鼠和人类相比,3 个鼹形鼠科物种α和β基因簇仍然保留了5′端胚胎特异性表达基因和3′端成体特异性表达基因的排列模式[25-26,30]。
在成体高原鼢鼠转录本中,本文检测到αA、αE和β1三个基因的表达。理论上,这3个基因可以翻译并最终合成成体αA型(αAβ1)2和胚胎αE型(αEβ1)2两种Hb 亚型。与等电聚焦电泳结果相符[10],本研究结果显示预测的αE亚基具有较αA亚基高的pI 值。已有的研究结果表明,所有哺乳动物的αE基因仅在胚胎发育时期被表达,截至目前尚无证据表明哺乳动物成体阶段表达该基因[1,25]。小鼠胚胎和成体时期转录物组数据分析进一步验证和细化了这种模式,即αE基因仅在胚胎发育后期(13~15 d)被表达,而αA基因则在胚胎和成体所有组织中被表达。高原鼢鼠是首个被检测到在成体表达胚胎αE型Hb的哺乳动物,αE型Hb具有较αA型更高的氧亲和力,两种氧亲和力不同的Hb 形成对血氧亲和力调节的一种级联机制,因此理论上成体高原鼢鼠血氧亲和力的调节范围可达两种亚型Hb 固有氧亲和力的极限值[1]。上述结果可部分解释高原鼢鼠成体表达的两种Hb 亚型及其具有异常高的固有氧亲和力的原因。根据基因表达分析结果,成体高原鼢鼠脑组织中αE基因的表达量(RPKM 仅为2.58 ±0.53)远远低于αA基因的表达量1 655.90±475.47,这与电泳结果中蛋白质相对含量的结果差别较大。出现这种结果的原因可能有2个:①αE基因可能在其他未被测序的组织中被高表达,该推测尚需实验进一步验证;②αE基因编码多肽的稳定性可能较高,使得其可以在红细胞内积累到较高的浓度。蛋白质物理化学性质分析结果显示,与小鼠相比,高原鼢鼠αA多肽的稳定性明显降低,而αE和β基因编码多肽的稳定性明显升高,该结果支持第2种推测,即高原鼢鼠通过提高αE和β基因编码多肽的稳定性,最终使αE型Hb积累到与αA型Hb相近的浓度。分子进化和蛋白质结构分析结果进一步佐证,两种类型Hb 的表达对成体高原鼢鼠适应极端低氧环境是有利的,其中高氧亲和力的αE型Hb 有利于肺部毛细血管从低氧环境中装载更多的氧气,而低氧亲和力的αA型Hb则有利于氧气释放到需氧组织的过程。
分子进化分析结果表明,高原鼢鼠αE基因相对保守未检测到正选择位点,但αA和β基因均显示有显著的正选择位点。蒲鹏[31]已较为深入地研究了氨基酸突变对高原鼢鼠αA型Hb 结构的影响,本文主要探讨了Hb β 亚基血红素“口袋”开口处12 个氨基酸突变可能对结构造成的影响。结果表明氨基酸突变对β 亚基结构最突出的影响是43 和86~87位氨基酸突变,这些突变通过形成两个α螺旋使血红素口袋区域更加稳定,同时80 位氨基酸突变使得开口夹角处α螺旋消失,部分缓解了该区域的张力使得血红素“口袋”的开口略微增大。此外,70Ala-Ser 和86Ala-Ser 两个突变明显增加了β 亚基潜在的亲水性。因此,本文推测高原鼢鼠Hb β 亚基的12个氨基酸突变是其稳定性提高的关键因素,同时氨基酸突变引起的亲水性升高,均有利于αE型Hb组装以及积累到较高浓度。
综上所述,高原鼢鼠成体表达的两种Hb 亚型分别为(αAβ1)2和(αEβ1)2;其异常高的氧亲和力可能主要由(αEβ1)2高表达引起;Hb β 亚基血红素“口袋”开口处12 个氨基酸突变对提高β 亚基稳定性和亲水性起到关键作用。本文对αE型Hb 最终积累到较高浓度推测及两种Hb 亚型的实际氧亲和力尚需实验进一步证实。

