BALP、PTH联合IGF⁃1检测在肾性骨病早期诊断中的临床意义
黄雯 杨启 王兴纯 唐熙
肾性骨病(Renal osteopathy,ROD)在临床中常见于终末期肾脏疾病患者,尤其是在维持性血液透析患者中肾性骨病发病率可高达100%[1]。近年来肾性骨病发病率呈逐渐增高趋势,是影响肾脏疾病患者生活质量及生存率的重要因素,因而备受临床关注。临床中常用骨穿刺活检来诊断肾性骨病,作为有创性检查,骨穿刺活检费用较高,重复性差,导致患者接受度不高,也不适用于病情的实时评估[2]。近年来许多血清指标被应用于肾性骨病的早期诊断及筛查中,且获得了较为理想的临床使用效果。骨源性碱性磷酸酶(Bone derived alkaline phosphatase,BALP)属于碱性磷酸酶同工酶中的一个亚型,常用于评估骨形成情况,可反映机体骨代谢状态,对肾性骨病早期筛查有一定使用价值[3]。甲状旁腺激素(parathyroid hormone,PTH)属于多肽类激素,可直接参与体内钙磷调节,其水平变化与机体骨代谢情况密切相关[4]。胰岛素样生长因子⁃1(Insulin like growth factor⁃1,IGF⁃1)可促进骨细胞分化,延缓细胞凋亡,是促进骨骼生长的重要代谢因子[5]。本文主要分析BALP、PTH、IGF⁃1 在肾性骨病中的表达情况,并了解三者联合对肾性骨病的诊断价值。
1 资料与方法
1.1 一般资料
选取2019年3月至2021年6月四川护理职业学院附属医院收治的119 例ROD 患者作为ROD组,其中男73 例,女46 例,平均年龄(48.58±6.55)岁,平均病程(3.69±0.88)年;原发性疾病:慢性肾炎51 例,高血压肾动脉硬化35 例,糖尿病肾病19例,慢性肾盂肾炎14 例。纳入标准:①符合《ROD诊断标准》中相关诊断标准[6];②临床资料完整。排除标准:①原发性肾功能不全者;②合并自身免疫疾病者;③合并其他慢性疾病者;④临床资料缺失。另选取同期102 例健康体检者作为对照组,入选者肝肾功能正常,其中男61 例,女41 例,平均年龄(48.21±6.13)岁,两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院医学伦理委员会批准通过,受试者已签署知情同意书。
1.2 方法
1.2.1 BALP、PTH、IGF⁃1 检测方法
入选者均在空腹条件下抽取静脉血液5 mL,3 000 r/min 离心10 min,离心半径为10 cm,获取上清液待检。使用电化学发光法检测BALP,试剂由贝克曼库尔特商贸(中国)有限公司提供;使用免疫放射比浊法检测PTH,试剂由北京科美生物技术有限公司提供;使用酶联免疫吸附法检测IGF⁃1,试剂由美国R&D 公司提供。
1.2.2 骨密度测量
入选者均进行X 线检查测量骨密度,仪器为Challenger 双能X 线骨密度测量仪(美国BMS 公司生产),测量区域:L3、L4 椎体、股骨近端的股骨颈、大转子、Ward's区,测量由同一医生及同一仪器进行。
1.3 统计学方法
采用SPSS 20.0 统计软件建立数据库,计量资料采用()表示,行t检验;采用Pearson 进行相关性分析BALP、PTH、IGF⁃1 与骨密度水平相关性,绘制受试者工作特征(ROC)曲线分析BALP、PTH、IGF⁃1 单独及联合检测对肾性骨病的诊断价值,并计算曲线下面积(AUC),以P<0.05为差异具有统计学意义。
2 结果
2.1 两组BALP、PTH、IGF⁃1 表达水平比较
ROD 组BALP、PTH 水平明显高于对照组,IGF⁃1 水平明显低于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组BALP、PTH、IGF⁃1 表达水平比较(±s)Table 1 Comparison of the expression levels of BALP,PTH and IGF⁃1 between the two groups(±s)
组别对照组ROD 组t 值P 值n 102 119 BALP(U/L)36.65±5.21 93.65±10.26 50.766<0.001 PTH(μg/L)1.21±0.32 7.54±0.96 63.615<0.001 IGF⁃1(μg/L)241.21±15.24 132.25±15.57 52.371<0.001
2.2 两组骨密度比较
ROD 组腰椎(L3、L4)、股骨近端骨(股骨颈、大转子、Ward's 区)密度均明显低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组骨密度比较(±s)Table 2 Comparison of bone mineral density between the two groups(±s)

表2 两组骨密度比较(±s)Table 2 Comparison of bone mineral density between the two groups(±s)
组别对照组ROD 组t 值P 值n 102 119腰椎L3 1.06±0.15 0.88±0.12 9.905<0.001 L4 1.09±0.22 0.76±0.18 12.262<0.001股骨近端骨股骨颈0.91±0.21 0.69±0.18 8.386<0.001大转子0.98±0.09 0.71±0.06 26.561<0.001 Ward's 区0.93±0.11 0.79±0.09 10.404<0.001
2.3 BALP、PTH、IGF⁃1 与骨密度相关性
BALP、PTH 与肾性骨病患者骨密度为负相关(rBALP=-0.623,rPTH=-0.541,P均<0.001),IGF⁃1 与骨密度为正相关(r=0.448,P=0.003)。
2.4 BALP、PTH、IGF⁃1 单独及联合检测对肾性骨病的诊断价值
依据ROC 曲线可知,BALP、PTH、IGF⁃1 联合检测对肾性骨病早期诊断敏感度和特异度分别为0.853、0.725,AUC=0.817(95%CI:0.721~0.896),明显高于三者单独诊断(P<0.05)。见表3、图1。
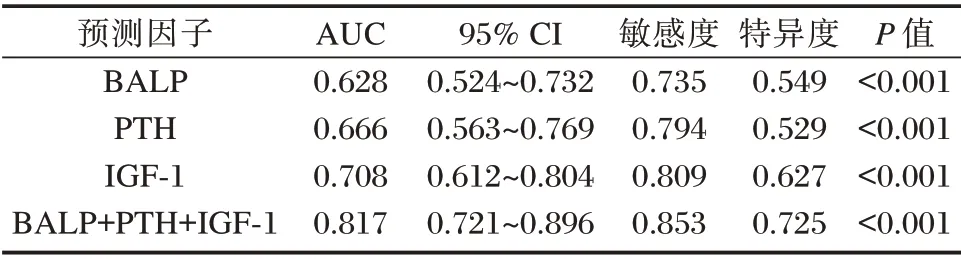
表3 BALP、PTH、IGF⁃1 单独及联合检测对肾性骨病的诊断价值Table 3 The diagnostic value of BALP,PTH and IGF⁃1 alone and in combination in the diagnosis of renal bone disease

图1 BALP、PTH、IGF⁃1 单独及联合检测对肾性骨病的诊断ROC 曲线图Figure 1 ROC curve of BALP,PTH,IGF⁃1 alone and combined detection in the diagnosis of renal bone disease
3 讨论
本研究结果显示,肾性骨病患者腰椎及股骨近端部位密度明显低于健康人群,说明患者骨密度下降明显,这也可能是患者进一步发展成为骨质疏松、肾性骨营养不良的病理基础。因此,为延缓患者病情进展,早期对患者做出诊断有积极的临床意义[7]。
全身不同部位的骨组织时刻都在进行着骨形成及吸收的过程,临床中称为骨转化[8]。在这一过程中所产生的代谢产物则是骨转化的标志物,对临床评估骨转化有重要的参考价值。近年来临床致力于寻找灵敏度高、重复性好以及无创的评价肾性骨病患者骨代谢情况的指标。BALP、PTH、IGF⁃1 是其中常用的检测指标,对机体骨质代谢、骨质疏松评估均有一定的参考价值[9]。BALP 在成骨细胞中产生,在细胞内以四聚体的形式存在,并通过磷酸肌醇、聚糖酯固定在细胞外膜[10]。体外研究显示,BALP 在成骨细胞表面主要以固定的完整不溶形式(疏水性)和非固定的可溶形式(亲水性)存在,在血液中BALP 主要表现为亲水性,其表达水平变化与成骨细胞释放率、肝脏降解率有关[11]。研究显示,BALP 可更好地反映慢性肾功能不全患者骨重建情况[12]。李宁等[13]研究也表明肾性骨病患者BALP 表达水平明显上升。PTH 是甲状旁腺主细胞内所合成的多肽类激素,可直接参与机体钙磷代谢以及骨密度代谢。研究显示,在肾功能损害过程中多数患者可出现甲状腺功能亢进,PTH 水平也明显升高,进而导致骨吸收增加,矿物缺失明显[14]。刘琳娜等[15]研究显示,PTH 过多产生可导致骨组织骨改建活跃,同时促进纤维性骨炎形成,破坏成骨与破骨动态平衡,进而导致肾性骨病发生。IGF⁃1 在成骨细胞内合成,为骨组织含量最高的生长因子。以往研究显示,IGF⁃1 参与肾性骨病患者骨形成、骨修复以及骨重塑[16]。国外研究通过观察10 例维持性血液透析患者治疗过程中动静脉血液中IGF⁃1 表达情况发现,这些患者血液中IGF⁃1 水平明显降低,出现肾性骨病者IGF⁃1 水平明显低于未发生肾性骨病者,且IGF⁃1表达水平与患者骨密度之间为正相关性[17]。
在本研究结果中可知,与健康对照组相比,肾性骨病患者BALP、PTH 水平明显升高,IGF⁃1 水平明显降低。结合上述文献可知,BALP、PTH、IGF⁃1可能参与肾性骨病的发生过程。通过绘制ROC 曲线可知,BALP、PTH、IGF⁃1 对肾性骨病有一定的诊断价值,且三者联合诊断可明显提高对肾性骨病诊断的灵敏度与特异度,可为临床诊断提供可靠的参考依据。此外,通过相关性分析可知,BALP、PTH 与患者骨密度为正相关,IGF⁃1 与骨密度为负相关,提示BALP、PTH、IGF⁃1 作为血清学指标不仅可反映出患者骨代谢情况,同时也可反映出患者骨代谢异常程度以及骨密度变化。
综上所述,BALP、PTH、IGF⁃1 与肾性骨病患者骨密度密切相关,三者联合检测可提高对肾性骨病的诊断效能,可能可作为预测肾性骨病发生的非侵入性检查指标。

