基于网络药理学探讨补肺汤治疗慢性阻塞性肺疾病的作用※
李剑庆 王 慧 刘 雨 谭光波▲
慢性阻塞性肺疾病(COPD)具有较高发病率及死亡率,是世界范围内导致死亡的主要原因之一,世界卫生系统为此耗费大量的医疗资源[1]。COPD 以持续的呼吸困难、咳嗽、咳痰等呼吸道症状和进行性气流阻塞为主要临床特征,是可预防和治疗的疾病。目前公认吸烟是导致COPD 的主要原因,但不是唯一的原因[2]。COPD具有多种致病机制,如弹性蛋白酶活性过高、氧化应激、细胞凋亡和自身免疫等[3]。当前,COPD 的诊断主要仍依赖于检测气流受限程度,治疗手段主要包括使用支气管扩张剂、吸入糖皮质激素等以改善气流受限和减轻症状,但对延缓疾病恶化的效果并不十分理想[4],且副作用较多。以支气管扩张剂对症治疗并不能从根本上减轻持续气道炎症引起的肺气肿进展[5]。目前西药对COPD 稳定期患者的治疗效果和安全性欠佳,长期吸入支气管扩张剂和糖皮质激素的维持疗效有限[6,7]。相比之下,中医药在COPD 的治疗中显示出一定的优势,能明显改善COPD 患者的临床症状,且安全性可观,患者较易接受。寻找具有多靶点、多层次的中药配合治疗COPD具有重要意义。
补肺汤出自《永类钤方》,方由桑白皮、熟地黄、人参、紫菀、黄芪、五味子组成,主治劳嗽,其组方特点在于肺肾双补、金水相生,无论是肺虚在先,引起肾虚,还是肾虚在先,继而肺虚,均可收效。其对于慢性肺系疾病迁延不愈、肺肾两虚者疗效甚佳。临床上,补肺汤能有效缓解COPD患者的症状,改善肺功能,提高患者的运动耐量和生活质量。但其确切作用机制迄今尚不清楚。中药组方是由多种中草药共同构成的,其化学成分多样而复杂,寻找特定有效的疗效靶点是一项亟待解决的任务。网络药理学是系统研究中药配方的关键技术手段之一,其可以揭示草药和配方的药理作用,以及基于多学科整合的分子机制,如高通量组学、计算机技术、药理学和网络数据库检索[8,9]。本研究应用网络药理学及生物信息学技术预测补肺汤治疗COPD的药效物质基础和分子机制,从中药组方多靶点、多通路入手,探讨补肺汤治疗COPD潜在的作用机制,为开展关于补肺汤的基础实验和临床应用提供理论依据。
1 资料与方法
1.1 筛选补肺汤的活性成分及相关靶点以“黄芪、桑白皮、熟地、人参、紫菀、五味子”为检索词,使用ADME参数筛选,以类药性(DL)≥0.18及口服生物利用度(OB)≥30%为筛选条件,检索时间为2021年9月,在TCMSP数据库[10](http://lsp.nwu.edu.cn/tcmsp.ph)中检索补肺汤的中药及其活性成分,并基于TCMSP数据库平台,找到有效成分所对应的相关靶点。因桑白皮在TCMSP 数据库中未查及,选用TCMBAT 数据库[11](bionet.ncpsb.org.cn/batman-tcm/),以Score cutoff≥30,Adjusted P-value<0.05 筛选,获得有效成分及相应的靶点。
1.2 利用Uniprot 数据库对潜在靶点进行标准化TCMSP数据库获得的蛋白靶点名称多样且冗长,为了将所获得的目标靶点名称规范化,将检索的每味中药的靶点取合集,整合出补肺汤的潜在靶点,并利用UniProt 数据库[12](http://www.uniprot.org/) 中 的UniProtKB 功能,按照“Reviewed”“Human”筛选,将以上获得的补肺汤潜在蛋白靶点名称与数据库一一配对,一并转换为Gene symbol,即相应基因名称。
1.3 筛选COPD 的疾病相关预测靶点以“COPD”及“chronic obstructive pulmonary disease”作为关键词进行检索,利用DisGeNET 数据库[13](www.disgenet.org/),以阈值score>0.9 为筛选条件获取疾病靶点;利用Genecards 数据库[14](www.genecards.org/),设置阈值Relevance score>20 为筛选条件获取疾病靶点;基于GEO数据库[15]筛选COPD差异基因,以“Homo sapiens”为组织来源,筛选正常人作为对照组,同时临床样本为肺泡灌洗液、血清、肺组织的数据集,最终选用GSE 76925 和GSE 106986 两组数据集,并以adj.P.Val<0.05、差异倍数≥4 为筛选条件,获得表达差异基因靶点。最后将差异表达基因与另外两个数据库收集的疾病靶点合并,删除结果中重复的靶基因后,作为COPD疾病预测靶点。
1.4 构建“药物靶点-疾病靶点”交集,获取核心靶点采用Venny 2.1 绘图工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)将上述获得的药物治疗COPD潜在靶点与疾病预测靶点取交集,生成韦恩图,获得补肺汤治疗COPD的核心靶点。
1.5 构建“药物-有效成分-核心靶点-疾病”网络图,获取关键靶点为了进一步明确补肺汤治疗COPD的核心靶点间相互作用关系,将获得的核心靶点上传到String 数 据 库[16](cn.string-db.org/),选 择“Homo sapiens”,以score≥0.7为筛选条件,获得核心靶点互作关系数据图,并将获得的互作数据集和上述筛选的中药成分及靶点数据导入Cytoscape 3.8.2。利用Cytoscape 3.8.2 的Network Analysis 进行网络拓扑分析,构建可视化互作图。针对核心靶点,按照Degree值,筛选出≥2倍中位数的核心靶点,再用cytohubba程序按从大到小选取该排名前30的结果作为关键靶点。
1.6 核心靶点的GO功能注释和关键靶点的KEGG通路富集为了进一步了解生物学功能,将核心靶点和关键靶点分别导入DAVID 6.8 数据库[17](david.ncifcrf.gov)。对核心靶点进行GO功能注释,对关键靶点进行KEGG通路分析,均以FDR<0.05(即校正P值)为筛选条件,获得GO和KEGG富集分析数据,并将结果绘制成柱状图或气泡图。
2 结果
2.1 补肺汤的活性成分和潜在靶点通过对TCMSP和TCMBAT数据库检索,筛选符合检索标准的有效成分,得到黄芪20个成分、熟地黄2个成分、五味子8个成分、人参22个成分、紫菀19个成分、桑白皮17个成分。收集有效成分相应的预测靶点,合并去重后,共获得补肺汤潜在靶点354个。
2.2 COPD 疾病预测靶点的筛选通过对3 个疾病靶点数据库的检索,筛选符合检索标准的疾病预测靶点,共获得DisGeNET预测靶点900个、Genecards预测靶点1169 个、GEO 差异表达基因140 个。合并去重后,共获得与COPD相关的疾病预测靶点1716个。
2.3 “药物-有效成分-靶点-疾病”的数据整理与调控网络的构建利用Venny 2.1作图工具,将上述获得的补肺汤潜在靶点与COPD 疾病预测靶点取交集,共获得143 个核心靶点(见图1)。将143 个核心靶点导入String 数据库,获得PPI 数据图(见图2),结果共有143个节点,产生了1017条边。将蛋白互作数据与上述获得的中药、有效成分及预测靶点一并导入Cytoscape 3.8.2,构建“药物-有效成分-核心靶点-疾病”网络图(见图3)。其中各节点的大小与度值大小呈正相关,节点连接度(degree)越大,节点越大,发生的反应越多,靶点可能越具有重要作用。通过网络拓扑结构分析发现,Degree 排名前5 位的药物活性成分分别是:槲皮素(MOL000098)、山奈酚(MOL000422)、木犀草素(MOL000006)、异鼠李素(MOL000354)、β-谷甾醇(MOL000358)。按degree 大小取前10 个活性成分作表展示(见表1)。
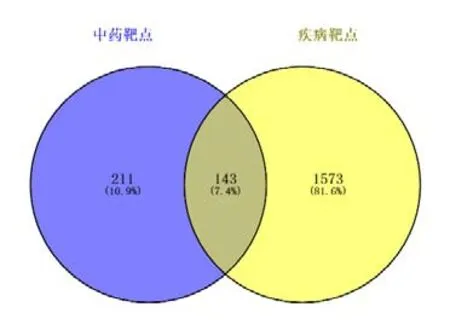
图1 补肺汤-COPD靶点韦恩图
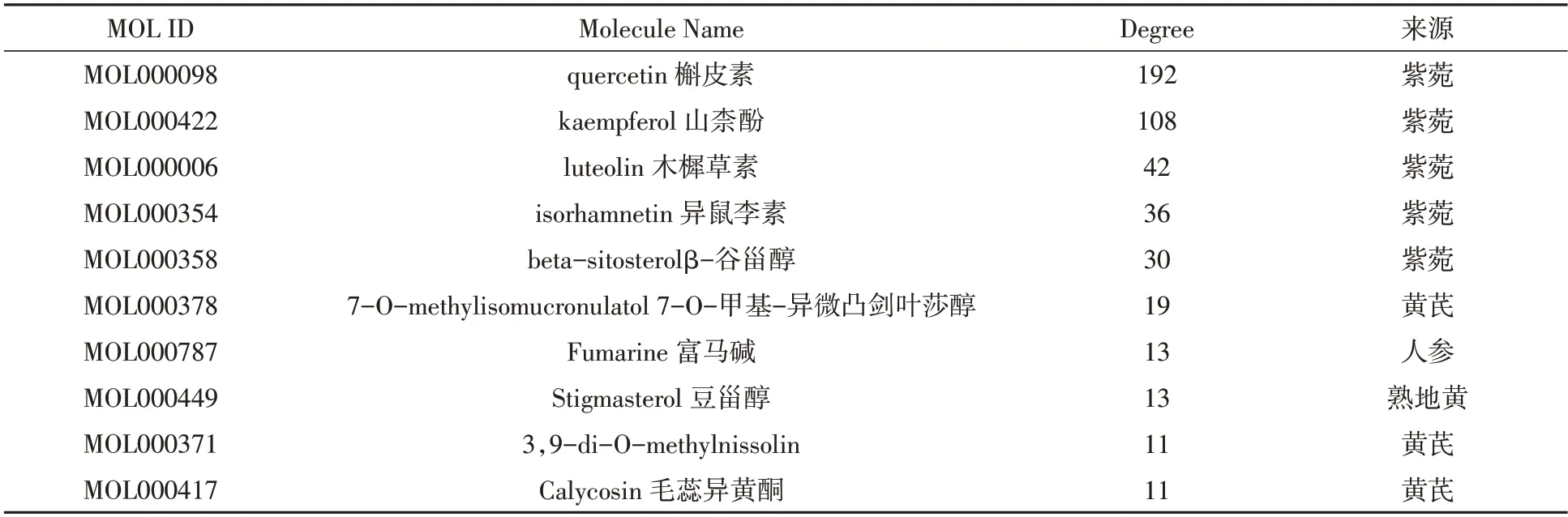
表1 Degree值前10个活性成分
图2 核心靶点PPI数据图
图3 “药物-有效成分-核心靶点-疾病”网络图
2.4 核心靶点GO 功能分析将核心靶点上传到DAVID 6.8数据库进行GO功能分析,其中包括分子功能(Molecular Function,MF)、细 胞 组 分(Cellular Component,CC)、生物学过程(Biological Process,BP)。结果显示,显著富集到生物过程的共计289个,主要涉及对缺氧的反应、对凋亡过程的负调控、RNA聚合酶II启动子转录的正向调控、基因表达的正向调控、外源性凋亡信号通路、对脂多糖的反应、衰老等;显著富集到细胞组分的共计31个,主要涉及细胞质、膜筏、受体复合体、质膜、内质网腔、血小板α颗粒管腔、胞外区等;显著富集到分子功能的共计46个,主要涉及酶结合、蛋白结合、蛋白同源二聚体活性、药物结合、转录因子结合、泛素蛋白连接酶结合、细胞因子活性等。选取各类GO富集前十位结果进行图表展示,见图4~6。
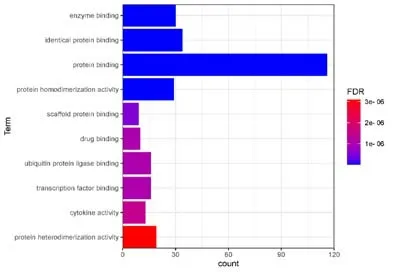
图4 分子功能(MF)
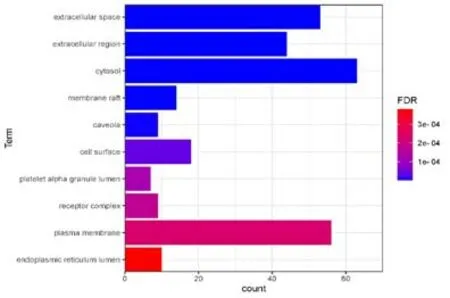
图5 细胞组分(CC)
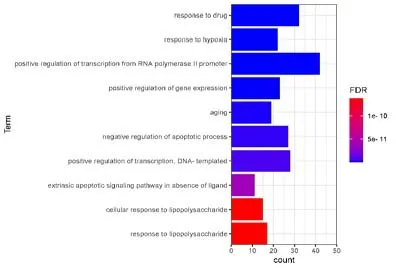
图6 生物学过程(BP)
2.5 关键靶点KEGG 信号通路分析应用Cytoscape 3.8.2 中cytohubba 进行关键靶点筛选,按照Degree 值≥2 倍中位数(即Degree≥44),得到核心靶点共37个,再从中选取排名前30的靶点作为关键靶点,分 别 为TNF、AKT1、TP53、JUN、IL6、EGFR、IL1B、RELA、VEGFA、CASP3、MAPK1、MMP9、MYC、IL10、CXCL8、STAT1、ESR1、MAPK14、EGF、HIF1A、CCL2、MAPK8、NFKBIA、CCND1、FOS、AR、IL2、CAV1、CASP8、PTGS2。为了进一步明确关键靶点所起的重要作用,将关键靶点上传到DAVID 6.8 数据库进行KEGG 信号通路富集分析。结果显示,显著富集的通路主要涉及TNF信号通路、MAPK信号通路、Toll样受体信号通路、NOD 样受体信号通路、单纯疱疹病毒感染、癌症信号通路等共计110个。据FDR列出排名前15的信号通路作图,见图7。
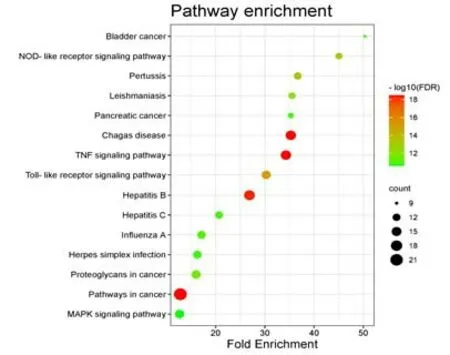
图7 KEGG通路富集
3 讨论
COPD 的主要特征为进行性气流受限,主要表现为进行性的胸闷、喘息或伴咳嗽、咳痰,临床多以虚证为主,虚实夹杂。补肺汤是临床上常用来治疗COPD肺肾两虚证患者的有效方剂,由桑白皮、熟地黄、人参、紫菀、黄芪、五味子组成。其中人参归脾、肺、心经,可大补元气、益肺生津;熟地黄归肝、肾经,可滋肾水,补真阴,俾金水相生;黄芪补气固表以御外邪;紫菀、桑白皮下气消痰以祛邪;再合五味子酸敛肺气。全方肺肾双补,攻补兼施,散中有收,故对COPD 肺肾两虚证患者有稳定的疗效。目前关于补肺汤治疗COPD的作用机理尚不甚明确,中药组方存在多种化学成分相互作用、相互调节,其中成分多而复杂,深入研究其发挥作用的具体成分和靶点具有重要意义。
通过对“药物-有效成分-靶点-疾病”的网络构建与分析,发现度值排名前5的有效成分为槲皮素、山奈酚、木犀草素、异鼠李素和β-谷甾醇。目前关于槲皮素的研究较多,已知槲皮素属于植物类黄酮化合物,其广泛分布于植物中,包括苹果、葡萄、洋葱、茶、西红柿和银杏等,是一种有效的抗氧化和抗炎剂[18]。基质金属蛋白酶(MMPs)在COPD患者中表达增加,在肺气肿的发生、发展中起重要作用。有研究显示,在弹性蛋白酶或脂多糖处理的肺气肿小鼠中,槲皮素能明显抑制MMP9 和MMP12 的水平,并降低MUC5AC mRNA 表达,改善肺部氧化应激和炎症,防止肺气肿的进展[19]。急性加重是COPD 患者发病和死亡的主要原因,鼻病毒感染可能加速COPD患者肺部疾病的进展。在一项对鼻病毒感染小鼠模型的研究中,与对照组相比,槲皮素处理的小鼠能减轻鼻病毒感染引起的肺弹性回缩、肺部炎症、杯状细胞化生,同时能抑制巨噬细胞和CD8+T细胞在肺部的聚集,提示槲皮素能有效地减缓鼻病毒诱导的COPD小鼠模型肺部疾病的进展[20]。另外,目前糖皮质激素抵抗也是COPD 治疗过程中亟待解决的问题,香烟烟雾(CS)造成的慢性炎症和氧化应激很可能导致这种皮质类固醇的耐药。有研究发现,烟草烟雾提取物(cigarette smoke extract,CSE)暴露下的u937细胞(人类单核细胞)会降低对皮质类固醇的敏感性,而槲皮素处理后则显著逆转了这种效果,恢复到非刺激细胞对皮质类固醇反应性的相同水平[21],提示槲皮素在治疗COPD耐药等方面有可能成为一种新的治疗药物。山奈酚也具有显著的抗炎作用,有研究显示,山奈酚对NF-kB与氧化应激的激活有明显的抑制作用[22]。有研究者还发现,山奈酚能通过阻断Tyk-STAT信号通路,明显抑制LPS诱导的气道上皮细胞炎症反应[23]。促炎细胞因子和趋化因子(TNF-α、IL-1、IL-6和IL-8)广泛参与COPD的发病[24],木犀草素和异鼠李素则能通过降低肺损伤小鼠血清及BALF 中IL-1β、IL-6、TNF-α水平以减轻肺损伤程度[25,26]。补肺汤可能通过减轻气道炎症、氧化应激及调节免疫和对皮质醇的敏感性在COPD联合治疗中发挥疗效。
在对核心靶点的GO功能分析中发现,补肺汤治疗COPD可能通过调控组织缺氧、负调控细胞凋亡、对脂多糖的反应以及细胞衰老等生物过程改善COPD的发生、发展。其中关键靶点包括TNF、AKT1、TP53、JUN、IL6、EGFR、MMP9、NFKBIA、MAPK1等,大多已经被证实在COPD 的发病机制中具有重要作用。进一步的KEGG 信号通路分析发现,补肺汤还可能通过调控TNF信号通路、MAPK信号通路、Toll样受体信号通路、NOD 样受体信号通路、单纯疱疹病毒感染等途径在COPD的治疗上起作用。得益于广大科研人员的探索,这些关键靶点与信号通路在COPD发病中的作用也逐步被人们了解。
众所周知,NFκB在促进炎症产生的过程中至关重要,是最重要的炎症信号通路之一。长期暴露于CS会使肺组织内的NF-κB过度激活,从而进一步诱导下游炎症级联反应的产生,导致气道重塑加重和COPD 临床症状反复[27,28]。补肺汤可能通过调控NF-κB的活化以减轻肺部炎症。TNF-α是一种多效性细胞因子,可启动许多下游信号通路,包括NF-κB激活、MAP 激酶激活以及诱导凋亡、坏死和活性氧的产生[29]。有研究利用TNF-α转基因小鼠在肺部过度表达TNF-α,进而促使小鼠出现COPD 类似的肺气肿改变,提示TNF-α在COPD的发生、发展中起着重要作用[30]。弹性蛋白酶与抗弹性蛋白酶失衡是COPD 的公认机制之一,肺组织弹性蛋白裂解失控会使肺泡失去弹性,加重结构破坏,进而导致肺气肿的产生。基质金属蛋白酶(MMPs)是一组能够降解多种细胞外基质的内切蛋白水解酶,其中MMP-9是该家族中主要的促弹性组织解离的酶,能直接诱导肺内弹性蛋白的降解,导致胶原蛋白的减少而出现肺气肿[31]。补肺汤可能通过下调MMP-9、TNF-α的表达而进一步抑制肺组织弹性蛋白的降解以延缓COPD肺气肿的进展。
Toll样受体(TLRs)是一组细胞表面和亚细胞跨膜蛋白,属于宿主先天免疫系统的模式识别受体(PRRs)类,在识别细菌、病毒等微生物病原体时起到传导的作用。病原体相关分子模式(PAMPs)可以通过与TLR结合,诱导下游特定的信号级联反应(包括激活NF-κB、MAP 激酶和IRF 信号通路等),以调节先天和获得性免疫、组织修复和再生过程[32]。近来的研究表明,TLRs在COPD发生、发展中扮演着重要角色,其中TLR-4在维持COPD 炎症反应中显得更为重要[33]。CS 与TLRs作用后,促发跨膜信号转导,再通过激活NF-κB通路诱导释放IL-6、IL-8、COX-2、PGE2等大量炎性因子。这些炎症因子一方面可引起局部细胞直接损伤,另一方面还可作为内源性配体募集炎症细胞,形成炎症正反馈循环,从而放大和维持肺部炎症[34]。NOD样受体,与Toll 样受体类似,也是机体固有免疫应答的重要组成部分,能够识别PAMPs 或内源性损伤相关分子模式(DAMPs),进而通过活化PRR来调控炎症反应。在关于NOD样受体的研究中,又以对NLRP3炎性小体的认识较为深入。NLRP3炎性小体主要由三部分组成,即NLRP3 蛋白、凋亡相关斑点样蛋白(CARD)和半胱氨酸天冬氨酸蛋白酶前体蛋白(pro-caspase-1)。在经过一系列上游信号传导与pro-caspase-1招募后,被激活的caspase-1将促炎因子(主要为IL-1β和IL-18)前体剪切加工成为成熟体,再释放至细胞外,进而引起炎性反应[35]。然而若caspase-1活化过多,引起炎性细胞因子过度分泌,可发生细胞炎症性死亡,进而产生细胞因子风暴,加重炎症损伤,导致细胞焦亡[36]。有研究发现,同样暴露于CS下,与对照组相比,NLRP3基因敲除组小鼠肺组织中caspase-1活化、IL-18表达水平及炎症损伤均较野生型正常小鼠明显降低,表明炎症小体在CS诱导的气道炎症中具有关键作用[36]。同时也有研究[37]报道,COPD患者痰液和血清中IL-18、IL-1β及肺组织中NLRP3 mRNA的表达均显著高于对照组,并且与COPD稳定期相比,急性加重期患者血清IL-1β水平明显升高。补肺汤可能通过调控NOD样受体、Toll样受体及细胞焦亡途径以改善COPD患者的肺部持续的炎症损伤,对戒烟后的COPD持续状态可能有益。
MAPKs 信号通路主要由P38MAPK、JNK 以及ERK1/2 这3 条信号通路组成。MAPKs 广泛参与细胞的生长繁殖、分裂死亡以及细胞内各种生化反应过程中。有文献[38]证实,JNK和p38MAPK的激活会促使细胞凋亡,而ERK1/2的激活会抑制细胞凋亡。进一步研究[39]显示,CSE 诱导的A549 细胞ERK、JNK 和p38MAPK磷酸化水平显著升高,并且肺泡上皮细胞凋亡增加[39],提示MAPK 通路的激活与肺泡细胞凋亡有关。补肺汤可能通过抑制肺泡细胞凋亡阻止肺内气道破坏与重构,以改善患者气流受限。
综上所述,通过对补肺汤的网络药理学和生物信息学分析,发现其作用于COPD 的主要有效成分包括槲皮素、山奈酚、木犀草素、异鼠李素和β-谷甾醇等,关键靶点主要包括TNF、AKT1、TP53、JUN、IL6、EGFR、MMP9、NFKBIA、MAPK1等,参与的重要信号通路包括TNF信号通路、MAPK信号通路、Toll样受体信号通路、NOD样受体信号通路等,涉及的生物过程主要为组织缺氧、细胞凋亡、衰老及对脂多糖的反应等。该网络药理学分析为补肺汤治疗COPD 提供了一定的理论依据,但研究也存在一定缺陷,包括各类数据库收录的信息有限、数据更新不及时、有些尚未经过验证等,故这些结果需要在后续的临床和基础研究中进一步证实。

