加热模式对添加葡萄糖氧化酶鲢鱼糜凝胶特性的影响
程梦颖,张海萍,刘友明*,熊善柏
(华中农业大学食品科学技术学院,国家大宗淡水鱼加工技术研发分中心(武汉),湖北 武汉 430070)
鱼糜制品因具有高蛋白、低胆固醇以及富含不饱和脂肪酸等特点,深受广大消费者的喜爱。对于热诱导鱼糜凝胶而言,热加工是制备鱼糜制品过程中的重要工序,加热模式的不同对鱼糜凝胶形成能力有重要影响。目前,传统的加热模式是二段式水浴加热,其中凝胶化温度和熟化方式对鱼糜蛋白的变性和凝胶形成能力有重要影响。在凝胶化阶段,主要利用内源性转谷氨酰胺酶(glutamine transaminase,TG)的作用使肌球蛋白最大的亚基聚合或共价结合,形成致密的凝胶网络结构,而不同的凝胶化温度和时间对鱼糜凝胶特性有不同影响。在熟化阶段,熟化方式的不同可能会导致鱼糜组织蛋白酶活性有所区别,目前家用较多的熟化方式有水浴、蒸制和微波加热。有学者发现加热方式的不同对鱼糜凝胶特性有一定影响。
随着消费者习惯和观念的变化,预制调理食品受到越来越多的关注。开发新型独具特色且适合家庭烹饪的鱼糜调理制品,可丰富鱼糜制品的种类,为消费者提供更多选择。淡水鱼糜具有凝胶形成能力差的缺点。研究表明,加入适量葡萄糖氧化酶(glucose oxidase,GOD)会提高鱼糜的凝胶特性。同时,实验室前期实验表明,适当的氧化会促进鲢鱼糜凝胶的交联。本研究以GOD促氧化交联的鲢鱼糜为原料,研究不同加热模式对鲢鱼糜凝胶品质的影响,并通过低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)分析鲢鱼糜凝胶水分状态的变化,结合扫描电子显微镜观察凝胶微观结构,确定适宜的加热模式,以期为制备高品质的鲢鱼糜调理制品提供理论依据。
1 材料与方法
1.1 材料与试剂
冷冻鲢鱼糜(AAA级) 洪湖市井力水产食品股份有限公司。
GOD(10U/g) 上海源叶生物科技有限公司;NaCl、尿素(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
AUY220分析天平 日本岛津公司;HH-6数显恒温水浴锅 常州国华电器有限公司;K600(3250)食物调理机 德国博朗电器公司;722型分光光度计 上海舜宇恒平精密科学仪器有限公司;FJ-200高速分散均质机上海标本模型厂;Ultrascan XE型色度仪 美国Hunter Lab公司;TA-XT Plus质构仪 英国Stable Micro System公司;AVANTI J-26高速冷冻离心机 美国Backman公司;NMI20 LF-NMR成像仪 上海纽迈电子科技有限公司;JSM-6390 LV扫描电子显微镜 日本Hitachi公司。
1.3 方法
1.3.1 不同加热模式鱼糜凝胶的制备
参考方海砚等的方法制作鱼糜凝胶。将冷冻鱼糜于4 ℃解冻,将解冻后鱼糜调节水分质量分数至78%,用食品调理机预斩拌2 min后,加入质量分数2% NaCl和0.5‰ GOD,斩拌4 min后用真空包装机排气,再灌入肠衣(直径25 mm),采用两段式加热模式进行加热。加热模式设置:第1段凝胶化温度分别设置为4、25、40 ℃;第2段熟化方式分别设置水浴加热、沸水蒸制、微波加热。微波加热时需将鱼肠肠衣除去。不同加热模式具体参数见表1。制成鱼糜凝胶后于流水下冷却30 min(微波加热制成的凝胶放入塑封袋进行冷却),置于4 ℃冰箱贮藏过夜。

表1 不同加热模式参数Table 1 Parameters of different heating modes
1.3.2 鱼糜凝胶强度测定
参考米红波等的方法,将样品从冰箱中取出,在室温下平衡30 min,切成高度20 mm的圆柱体,用质构分析仪测定样品凝胶强度。测定参数:探头P/0.25S,压缩距离15 mm,测前速率5 mm/s,测试速率l mm/s,测后速率5 mm/s,穿刺曲线上的第1个峰值即破断力,每个样品至少做5 个平行。凝胶强度为破断力与凹陷深度之积。
1.3.3 三氯乙酸(trichloroacetic acid,TCA)-溶解肽含量的测定
参考付湘晋等的方法,称取1 g样品与9 mL提前预冷的5% TCA溶液混合,6 000 r/min均质1 min,放入4 ℃冰箱中静置1 h,12 000 r/min离心15 min,采用Lowry法测定上清液中的蛋白质含量,TCA-溶解肽含量以每克样品所含酪氨酸物质的量表示(μmol/g)。每组样品至少测定3 个平行。
1.3.4 白度测定
参考Petcharat等的方法,将鱼糜凝胶切成厚度约5 mm的圆片,采用色度仪测定样品亮度值(*)、红度值(*)和黄度值(*),测定前用标准白板对色差仪校正。按式(1)计算白度():

1.3.5 持水性测定
参考马海建等的方法,将样品切成厚度约5 mm的薄片,准确称质量,记为/g,用2 层滤纸包裹放入10 mL离心管中,4 000 r/min离心10 min,离心结束后取出样品再次称质量,记作/g。按式(2)计算持水性:

1.3.6 LF-NMR弛豫时间的测定
参考李睿智等的方法,将样品在室温下恒温30 min,切成高度20 mm的圆柱并转入核磁管中,采用CPMG脉冲序列进行自旋-自旋弛豫时间、峰面积比测定。参数设定:质子振动频率22 MHz、90°脉宽14 μs,采样带宽100 kHz,90°与180°脉冲间隔时间200 μs,重复扫描次数8,重复采样等待时间4 500 ms。检测结束所得CPMG指数衰减曲线采用Multi xp InvAnalysis软件进行反演,得到峰面积比例。
1.3.7 鱼糜凝胶LF-NMR成像方法
参考杨文鸽等的方法,采用LF-NMR成像软件及MSE序列采集鱼糜凝胶的横向图像,测试条件:扫描3 层,层厚3.0 mm,层间距3.0 mm;稳定时间1 000 ms,回波时间9.42 ms;重复扫描次数16,K空间像素大小192h256。利用成像软件(上海纽迈电子科技有限公司)对质子密度图不同灰度值区域赋予不同颜色,得到鱼糜凝胶水分子质子密度伪彩图。
1.3.8 鱼糜凝胶微观结构的观察
参考吴晓丽等的方法并略作修改,将制备的样品切成2 mmh2 mmh1 mm的薄块,用2.5%戊二醛固定2~7 h后,用乙醇溶液进行梯度洗脱15 min,再用醋酸异戊酯洗脱20 min。将处理好的样品经临界点干燥,喷金处理后,然后用扫描电子显微镜观察微观结构,电子束加速电压为3 kV。
1.3.9 扫描电镜图片处理
按照Dàvila等的方法对扫描电镜图片进行阈值化和二值化处理,然后采用图像分析软件ImageJ 1.42q及其插件FracLac-2.5 Release 1 d分析扫描电镜图片。分形维数和平均孔隙当量直径参考朱玉安等的方法计算。孔隙当量直径可以直观反映鱼糜凝胶的孔隙大小;分形维数反映鱼糜凝胶体系的空间复杂程度,分形维数越大说明体系越复杂,分形维数越小,说明体系的均匀性越好。
1.3.10 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参考Wasson等的方法,略作修改。取18 mL 95 ℃ 5 g/100 mL SDS溶液加入2 g切碎的鱼糜凝胶中,均质后于85 ℃水浴1 h,8 000 r/min离心10 min,取上清液,调整蛋白质量浓度为2 mg/mL。取200 μL 2 mg/mL蛋白溶液加入40 μL含(或不含)5%-巯基乙醇蛋白上样缓冲液,混合均匀后沸水浴加热3 min,进样体积为10 μL。用5%浓缩胶、10%分离胶。使用0.125 g/100 mL考马斯亮蓝R-250溶液染色,使用脱色液(体积分数50%甲醇-10%醋酸-40%蒸馏水)脱色。
1.4 数据处理
每组实验样品做3 次平行。使用SPSS 23和Origin 2018软件进行差异显著性分析,显著性水平为0.05。
2 结果与分析
2.1 加热模式对鱼糜凝胶质构特性的影响
由图1可知,在凝胶化阶段,高温短时(40 ℃、1 h)模式下鱼糜凝胶的破断力和凝胶强度最高,而低温长时(4 ℃、8 h)鱼糜的破断力最低,中温中时(25 ℃、3 h)鱼糜的凹陷深度和凝胶强度最低。可能的原因是,中温中时和低温长时模式下,鱼糜蛋白凝胶交联不完善,蛋白分子不能完全伸展,形成松散、稳定性差的凝胶网络结构,鱼糜凝胶化不充分,从而降低了鱼糜凝胶强度。值得注意的是,在低温长时模式下,鱼糜凝胶的凹陷深度较大,可能是因为低温诱导形成的凝胶三维结构延展性更好。

图1 加热模式对鱼糜凝胶强度的影响Fig.1 Effect of heating mode on gel strength of surimi gel
在熟化阶段,与传统水浴加热相比,沸水蒸制鱼糜凝胶的凹陷深度和凝胶强度均无显著变化(>0.05),而在微波加热条件下鱼糜凝胶的破断力和凝胶强度显著增大(<0.05),此时鱼糜凝胶破断力和凝胶强度分别达到530.25 g和586.94 ggcm,相比水浴加热分别提高了43.17%和53.75%。这可能是因为微波加热能使鱼糜蛋白的交联度更高,形成更致密的网络结构,从而提高了鱼糜凝胶强度。
2.2 加热模式对鱼糜凝胶TCA-溶解肽的影响
TCA可溶性肽主要来源于鱼糜中蛋白质的降解,其含量的变化可准确反映蛋白质的酶解情况。如图2所示,在凝胶化阶段,低温长时(4 ℃、8 h)模式下鱼糜凝胶TCA-溶解肽含量最低,而高温短时(40 ℃、1 h)鱼糜的TCA-溶解肽含量最高,可能是因为随着凝胶化温度的升高,鱼糜内源性蛋白酶活性增加,在酶解作用下肌原纤维蛋白等大分子被降解成小分子肽,从而使TCA-溶解肽的含量升高。

图2 加热模式对鱼糜凝胶TCA-溶解肽的影响Fig.2 Effect of heating mode on TCA-soluble peptide content of surimi gel
在熟化阶段,微波加热条件下鱼糜凝胶的TCA-溶解肽含量显著低于其他两种加热方式(<0.05),而沸水蒸制与水浴加热的TCA-溶解肽含量无显著差异(>0.05)。这可能是因为TCA-溶解肽主要由组织蛋白酶分解蛋白产生低分子质量肽形成,而微波加热使鱼糜在加热过程中快速通过劣化带,从而抑制了鱼糜蛋白被组织蛋白酶降解,因此TCA-溶解肽含量较低。
2.3 加热模式对鱼糜凝胶色度的影响
由表2可知,在凝胶化阶段,高温短时(40 ℃、1 h)模式下形成的鱼糜凝胶的最大,达到79.81,鱼糜凝胶*、*也达到最大值,而*较低。有研究表明鱼糜凝胶的变化与鱼糜蛋白变性程度密切相关,可能是由于肌红蛋白的变性和持水性的改变,在凝胶化温度为40 ℃时凝胶蛋白的变性程度对保持鱼糜白度较为适宜。

表2 加热模式对鱼糜凝胶色度的影响Table 2 Effect of heating mode on color parameters of surimi gel
在熟化阶段,改变熟化方式对鱼糜凝胶影响显著(<0.05)。微波加热鱼糜的*和显著高于水浴加热和沸水蒸制(<0.05),可能是因为微波加热使鱼糜凝胶快速通过凝胶劣化温度段,蛋白质变性减弱,导致高于其他熟化方式,有研究表明,微波加热会改善鱼糜凝胶的。
2.4 加热模式对鱼糜凝胶持水性的影响
由图3可知,在凝胶化阶段,高温短时(40 ℃、1 h)模式下鱼糜凝胶的持水性最高,达到71.92%,低温长时(4 ℃、8 h)模式下鱼糜凝胶的持水性最低。这可能是因为在凝胶化温度为4 ℃和25 ℃时,形成的网络结构对水分的束缚较弱,导致鱼糜凝胶的持水性降低;在凝胶化温度为40 ℃时,凝胶蛋白之间产生疏水相互作用,使凝胶结构更加有序,从而增加凝胶化过程中保留水分的能力,提高持水性。
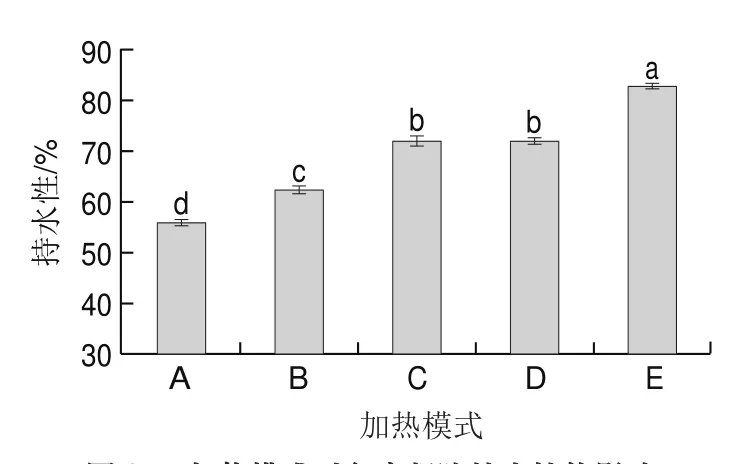
图3 加热模式对鱼糜凝胶持水性的影响Fig.3 Effect of heating mode on water-holding capacity of surimi gel
在熟化阶段,沸水蒸制鱼糜凝胶持水性与水浴加热鱼糜无显著差异(>0.05),而微波加热条件下鱼糜凝胶的持水性较水浴加热鱼糜显著提高(<0.05)。可能是因为微波加热对蛋白质交联促进作用较强,使更多水分被束缚,从而提高鱼糜凝胶的持水性。有报道也发现微波加热制成的鱼糜凝胶持水性高于传统水浴加热鱼糜,有助于形成高品质鱼糜凝胶。
2.5 加热模式对鱼糜凝胶水分状态的影响
2.5.1 加热模式对鱼糜凝胶弛豫特性的影响
如表3所示,鱼糜凝胶水分子可分为3 种状态:表示结合水,表示不易流动水和表示自由水。在凝胶化阶段,中温中时(25 ℃、3 h)和高温短时(40 ℃、1 h)模式下鱼糜凝胶峰面积比例较高;低温长时(4 ℃、8 h)模式下鱼糜凝胶峰面积比例最低,为85.87%。这可能是因为,在凝胶化温度为25 ℃和40 ℃时有利于鱼糜蛋白交联,可以截留自由水转化为不易流动水,使鱼糜凝胶中不易流动水含量相对增加。

表3 加热模式对鱼糜凝胶水分子T2峰面积比例的影响Table 3 Effect of heating mode on T2 peak area percentage of water in surimi gel
在熟化阶段,对比水浴加热,沸水蒸制鱼糜凝胶峰面积比例增加,但无显著差异(>0.05),而微波加热条件下鱼糜凝胶峰面积比例显著增加(<0.05),这可能是因为微波加热条件下鱼糜形成致密网络结构,束缚更多自由水,使其转换为不易流动水。Mao Weijie等报道表明,微波加热鱼糜制品的不易流动水含量较水浴加热鱼糜更高。
2.5.2 不同加热模式下鱼糜凝胶水分子质子密度伪彩图
鱼糜凝胶伪彩图中,绿色区域对应凝胶基质中的不易流动水,橙色和红色则表示局部高水平的自由水,通过颜色变化说明水分子在凝胶中分布状态。如图4所示,在凝胶化阶段,低温长时(4 ℃、8 h)和中温中时(25 ℃、3 h)模式下鱼糜凝胶伪彩图中橙色和红色较多,高温短时(40 ℃、1 h)模式下橙色和红色较少,表明此模式下鱼糜凝胶中自由水含量降低,而不易流动水含量增加。

图4 不同加热模式下鱼糜凝胶水分子质子密度伪彩图Fig.4 Pesudo-color map of water proton density of surimi gels under different heating modes
在熟化阶段,对比水浴加热,沸水蒸制和微波加热鱼糜凝胶图像中绿色明显增多,且橙色和黄色逐渐消失,说明水分子在鱼糜凝胶中的分布更均匀有序,这可能是因为微波加热使鱼糜凝胶形成更加致密的网络结构,截留水分使不易流动水含量提高。
2.6 加热模式对鱼糜凝胶微观结构的影响
由图5可知,不同加热模式下鱼糜凝胶微观结构明显不同。在凝胶化阶段,低温长时(4 ℃、8 h)和中温中时(25 ℃、3 h)模式下形成的鱼糜凝胶网络粗糙,而高温短时(40 ℃、1 h)模式下鱼糜凝胶网络结构较致密。

图5 不同加热模式鱼糜凝胶微观结构(×10 000)Fig.5 Microstructure of surimi gels under different heating modes (× 10 000)
由表4可知,高温短时(40 ℃、1 h)模式下鱼糜凝胶网络结构的孔隙当量直径和分形维数最小,说明此时鱼糜凝胶网络结构更加均匀致密,这可能是因为此条件下蛋白结构充分展开、相互交联,促进鱼糜凝胶形成更致密有序的网络结构。研究表明鱼糜凝胶结构越致密均匀,持水性越好,这与前述持水性结果一致(图3)。
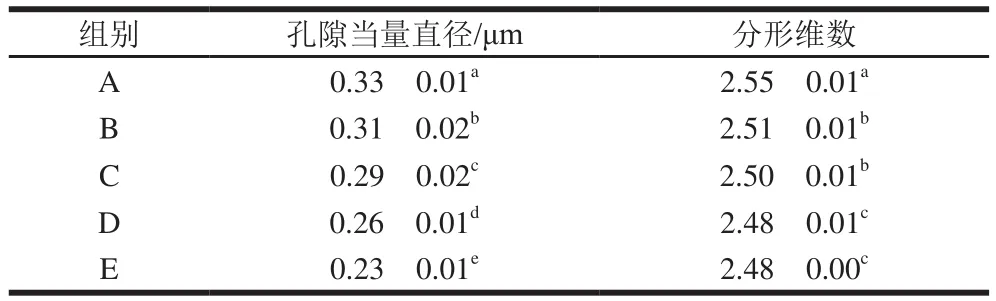
表4 不同加热模式鱼糜凝胶的孔隙当量直径和分形维数Table 4 Equivalent pore size and fractal dimension of surimi gels under different heating modes
在熟化阶段,传统水浴加热鱼糜凝胶网络结构孔洞较大,表面粗糙松散,而微波加热条件下鱼糜凝胶呈现清晰的空间网络结构,表面平整,质地致密,且此条件下鱼糜凝胶网络结构的孔隙当量直径与分形维数均最小,且与水浴加热相比显著降低(<0.05)。这可能是因为微波加热能够有效促进蛋白质聚集交联,使鱼糜凝胶形成较为均匀致密的网络结构,增强了凝胶强度。
2.7 加热模式对鱼糜蛋白交联的影响
如图6所示,在凝胶化阶段,低温长时(4 ℃、8 h)和中温中时(25 ℃、3 h)鱼糜凝胶的肌球蛋白重链(myosin heavy china,MHC)条带没有明显变化,在高温短时(40 ℃、1 h)模式下MHC条带明显变浅,可能是因为此时内源性蛋白酶活性增强,导致肌球蛋白降解。从还原型SDS-PAGE图可以看出,分子质量超过250 kDa的条带变浅,说明此时鱼糜蛋白存在二硫键交联,而低温长时(4 ℃、8 h)和中温中时(25 ℃、3 h)模式下在进样口处蛋白聚集较多,说明此时蛋白交联主要为非二硫键作用。同时,在高温短时(40 ℃、1 h)模式下,肌球蛋白轻链条带有明显减弱的现象。

图6 加热模式对鱼糜凝胶SDS-PAGE的影响Fig.6 Effect of heating mode on SDS-PAGE pattern of surimi gel
在熟化阶段,水浴加热较微波加热处理后的MHC条带颜色浅,这可能是因为传统水浴加热在凝胶劣化区滞留时间长,鱼糜中的组织蛋白酶具有热稳定性,引起MHC降解,而微波加热速率快可以快速通过凝胶劣化区并抑制内源蛋白酶的活性,使肌球蛋白不易被水解。通过还原型SDS-PAGE可以看出,在加入-巯基乙醇后,分子质量超过250 kDa的条带明显减弱,说明熟化阶段二硫键在促进蛋白质交联中起主要作用,而在进样口处也有少量聚集体,说明熟化过程中也有非二硫键的作用。
3 结 论
在凝胶化阶段,高温短时(40 ℃、1 h)模式下形成的鱼糜凝胶质构特性最好,形成了均匀紧密凝胶网络结构;在熟化阶段,微波加热条件下形成的鱼糜凝胶强度、和持水性均达到最大值,鱼糜凝胶的网络结构表面光滑且均匀致密。综合考虑,40 ℃水浴加热1 h+微波加热3 min的加热模式显著改善了添加GOD的鲢鱼糜凝胶性能,为开发新型鱼糜调理制品提供了理论基础。

