大豆蛋白纳米纤维对铁纳米颗粒的稳态化作用
刁聪聪,詹宏栋,孙晓宇,赵谋明,周非白*
(华南理工大学食品科学与工程学院,广东 广州 510640)
目前,缺铁性贫血是一项严重的营养缺陷和公共卫生问题,影响全世界近20亿人的生活。缺铁性贫血人口少数分布在发达国家,大部分分布在发展中国家,在非洲、中东等地区最为常见,其中以儿童、孕妇、肥胖人群和患有基础性疾病人群占比最大。缺铁会严重影响人体健康,造成虚弱、疲劳、工作能力低、认知效率降低的现象,严重影响儿童的脑发育和视觉发育;也会增加孕妇早产和低体重儿的发生率。为了降低缺铁性贫血的发生率和危害程度,预防和改善缺铁性贫血,提出“食品铁强化”措施。
铁强化食品在工业生产中存在一定困难。水溶性好、生物利用度高的铁强化剂,如硫酸亚铁会对食品的感官性质产生不良影响;而对食品感官影响较小的铁强化剂如焦磷酸铁、铁粉则具有溶解性差且生物利用度低等问题,导致人体肠道有害菌比例的增加,产生腹泻、腹痛等不良肠胃反应,同时未吸收的铁也会在肝脏、肾脏等脏器堆积,造成脏器负担。因此,铁强化剂在食品感官和生物利用度方面很难兼顾。铁纳米颗粒是一种新型的铁强化剂,具有较高的生物利用度和较低的反应活性,但是其胶体稳定性差,容易在水相体系发生氧化聚集,形成黑色沉淀,严重限制了其在食品工业中的应用。
高纵横比的纤维结构具有较强的活性物质荷载能力和耐破裂特性,近年来在药物或敏感性营养物质的递送领域受到广泛关注。Jansens等发现乳清蛋白纤维具有低纳米直径和高表面疏水性,以其作为载体,可以显著性增强以姜黄素为代表的水不溶性活性化合物的分散性。Shen Yi等利用-乳球蛋白制备纳米纤维,发现其可作为铁纳米颗粒的抗氧化纳米载体和胶体稳定剂,为扩展铁纳米颗粒在食品工业中的应用提供了新思路。大豆蛋白富含人体所必需的8 种氨基酸,是一种优质的植物蛋白。已有研究发现大豆蛋白在pH 2条件下经热处理可以发生自组装,形成呈细长卷曲状的纤维结构。本实验以大豆分离蛋白(soy protein isolate,SPI)为原料,通过5 h酸热处理制备SPI纳米纤维(SPI fibrils,Fib SPI),系统研究纤维形成前后蛋白结构的变化,并进一步制备铁纳米颗粒,探究Fib SPI对铁的稳态化作用,旨在为构建新型植物基铁强化剂递送体系提供理论和方法指导。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粕(蛋白质约45%) 山东禹王实业有限公司;食用大豆油 益海嘉里金龙鱼粮油食品股份有限公司;磷钨酸 天津大茂化学试剂厂;吐温80、牛血清蛋白、细胞色素C、抑肽酶、杆菌肽素、1-10菲咯啉、硫磺素T(thioflavin-T,ThT)、六水合氯化铁、七水合硫酸亚铁、硼氢化钠 美国Sigma-Aldrich公司;甘油、丙烯酰胺、过硫酸铵四甲基乙二胺、三羟甲基氨基甲烷(Tris)、考马斯亮蓝R250 美国Geniview公司。所有试剂均为分析纯。
1.2 仪器与设备
ME204电子天平、pHS-25 pH计 瑞士Mettler Toledo公司;MS-M-S-10磁力搅拌器 大龙实验仪器有限公司;THZ-82A恒温振荡器 常州澳华仪器有限公司;CR22N高速冷冻离心机、F7000荧光分光光度计、HT7700场发射透射电镜 日本Hitachi公司;Alpha2-4LDplus真空冷冻干燥机 德国Martin Christ公司;Milli-Q Advantage A10超纯水系统 美国Millipore公司;Ultra-Turrax T25高速剪切机 德国IKA公司;UH-150A超声波细胞破碎仪 天津Autoscience公司;ST 16R高速冷冻离心机、Varioskan Flash全波长扫描多功能读数仪 美国Thermo Fisher Scientific公司;Mini-PROTEIN 3 Cell电泳仪 美国Bio-Rad Laboratories公司;C300化学发光分子成像系统 美国Azure Biosysterms公司;UV754N紫外-可见分光光度计 上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 SPI的制备
采用碱溶酸沉的方法提取SPI。低温脱脂豆粕,超微粉碎,过筛(60 目),与去离子水按1∶10的质量比混合分散,调pH 8.0(2 mol/L NaOH溶液),室温搅拌2 h,离心(8 000h,20 min,20 ℃),收集上清液调pH 4.5(2 mol/L HCl溶液),4 ℃静置30 min,离心(8 000h,20 min,4 ℃),收集沉淀,称量并分散于7 倍质量的去离子水,缓慢调pH 7.5。蛋白充分分散后于4 ℃透析48 h,期间多次换水,冷冻干燥备用。
1.3.2 Fib SPI的制备
参考Wan Zhili等的方法稍有改动。配制质量分数2%(去离子水)的SPI分散液,充分水化,调节pH值至2.0(2 mol/L HCl溶液),4 ℃下放置过夜;将其于90 ℃搅拌(150 r/min)加热处理5 h,冰浴冷却,既得Fib SPI。搅拌加热处理过程中固定时间点(0、5、15、45、90、120、180、300 min)取样,用于纤维形成分析和还原力测定。
1.3.3 ThT荧光光谱分析
利用ThT荧光光谱法评估蛋白的成纤维情况。参考Gao Guiqi等的方法,将ThT(0.8 mg/mL)充分溶于磷酸缓冲液(PBS:10 mmol/L,pH 7.0,含150 mmol/L NaCl),过滤(0.22 μm),获得ThT母液,置于4 ℃冰箱贮存备用。
使用PBS将ThT母液稀释50 倍得到ThT工作液,将40 μL纤维分散液(20 mg/mL)与4 mL ThT工作液混合均匀,反应2 min后使用荧光光度计进行荧光强度测定。测定参数:激发波长为440 nm,发射波长为492 nm,狭缝为5 nm,电压为700 V。工作液现配现用。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参考Laemmli的方法有所改进。取一定量的蛋白粉末与非还原性样品缓冲液(配制20 mg/mL SDS,体积分数25%甘油,0.05%溴酚蓝;将其溶于60 mmol/L pH 6.8 Tris-HCl缓冲液)混合均匀;蛋白质充分溶解后,取10μL上清液(含20 μg蛋白)上样。凝胶电泳在恒流25 mA下进行,分离胶和浓缩胶的丙烯酰胺分别为12%和5%。电泳结束后,凝胶染色及脱色后于凝胶成像系统进行成像处理。
1.3.5 还原力
取一定量蛋白分散液与FeClg6HO(0.1 mol/L)混合使Fe与蛋白质量比为1∶5,加入1,10-菲咯啉(过量),反应15 min,使用酶标仪测定样品波长512 nm处光密度以代表样品的还原能力,记为OD,空白组使用去离子水代替蛋白分散液。
1.3.6 蛋白质分子质量分布
采用凝胶排阻色谱分析样品的分子质量分布。使用超纯水稀释SPI和Fib SPI样品(5 mg/mL),过膜(0.45 μm),进样量为10 μL。采用0.1 mL/min流速,洗脱液为5 mmol/L磷酸缓冲液(包含50 mmol/L NaCl,pH 7.2),在280 nm波长处测定吸光度()。标准蛋白为细胞色素C(12.33 kDa)、抑肽酶(6.51 kDa)与杆菌肽素(1.42 kDa)。
1.3.7 形貌观察
样品的形貌特点通过透射电镜进行观察。配制质量分数0.1%的样品分散液和质量分数1%的磷钨酸溶液。吸取10 μL的样品分散液,滴至微栅铜网上,室温吸附2 min后用滤纸吸走残液,酒精灯烘干,再取10 μL磷钨酸溶液于铜网,染色2 min,滤纸吸附多余磷钨酸溶液,自然晾干。使用场发射透射电镜进行形貌观察。
1.3.8 铁-大豆蛋白纳米纤维复合物(Fe FibSPI)的制备
配制蛋白分散液(20 mg/mL),与0.1 mol/L FeClg6HO混合均匀,加入适量NaBH溶液使结合在纤维表面的Fe(III)发生原位还原,形成铁-大豆蛋白纳米纤维复合物(Fe FibSPI);其中Fib SPI分散液、FeClg6HO和NaBH的最终为0.45%、0.015 mol/L和0.026 mol/L,铁和蛋白质质量比为1∶5;同时以SPI分散液代替Fib SPI分散液制备Fe SPI。
使用相同浓度的NaBH单独还原FeClg6HO,将其过滤,干燥,即得铁纳米颗粒(Fe NPs),作为空白对照。
1.3.9 测定Fe(II)离子含量
采用1,10-菲咯啉法测定铁含量,并加以修改。稀释新鲜制备的Fe FibSPI、Fe SPI分散液,加入过量1,10-菲咯啉,测定其波长512 nm处吸光度,通过标准曲线(以FeSOg7HO为标准样)计算样品Fe(II)离子含量。
1.3.10 保留率
将Fe FibSPI、Fe SPI分散液置于自然光下,室温贮存并测定样品贮存过程中Fe(II)离子含量的变化,保留率根据式(1)计算:

式中:为贮存放置后分散液中Fe(II)质量浓度/(mg/mL);为新鲜样品分散液中Fe(II)质量浓度/(mg/mL)。
1.3.11 Fe FibSPI对乳液稳定性的影响
以1 mg/mL吐温80为乳化剂,加入质量浓度为100 g/L的大豆油,使用高速剪切机进行预乳化(8 000 r/min,2 min),即得粗乳液;随后,40 MPa高压均质10 min,得到乳液样品。将新鲜制备的乳液分装于塑料样品瓶中,加入0.2 mg/mL叠氮钠防止微生物污染,同时加入Fe FibSPI、Fe SPI(10 mg Fe/100 g乳液),室温自然光源下贮存,评估乳液稳定性。实验以未处理的乳液作为空白对照,同时对比了FeSO以及FeCl源铁强化剂的影响。
1.3.11.1 色度测量
使用色度仪,以新鲜制备的空白乳液为基准校正,24 h后测定各样品组色度的变化,记录读数,即为Δ*。
1.3.11.2 乳液粒径测定
采用激光粒度仪通过静态光散射技术对乳液贮藏过程中粒径的变化进行测定,用纯净水作为分散溶剂。参数设置为:油滴的折射率1.473;油滴的吸收率0.001;分散剂的折射率1.330。乳液的粒径以体积平均粒径表示。
1.3.11.3 共轭二烯(conjugated diene,CD)值测定
测定贮存过程中乳液CD值的变化。取0.1 mL乳液与0.9 mL异辛烷-异丙醇(3∶1,/)有机溶剂混合,涡旋振荡10 s(重复3 次)以充分提取乳液中的油脂,然后于3 500h、20 ℃离心5 min,取0.2 mL上层有机相与4.8 mL异辛烷-异丙醇(3∶1,/)混合,在234 nm波长下测定吸光度,用异辛烷-异丙醇(3∶1,/)调零,按式(2)计算CD值。

式中:为吸光度;为摩尔吸光系数(25 200 L/(mol•cm));为比色皿厚度/cm;为CD的浓度/(mmol/L)。
1.4 数据统计分析
进行3 次重复实验,采用SPSS 11.5(SPSS Inc.,Chicago,IL,USA)统计分析软件进行单因素方差分析,比较样品在5%水平上差异的显著性,采用Prism 8.0软件作图。
2 结果与分析
2.1 Fib SPI结构形成过程中的形貌变化
如图1所示,SPI主要由结构不规则、大小不均一、粒径约100 nm的类球形纳米颗粒组成(图1A)。酸性条件下加热处理300 min后形成了长度约300 nm、高约5 nm短纤维聚集体(白色箭头)(图1B),即Fib SPI,此结果与前人研究一致。此外,图1B中仍可以观察到少部分纳米颗粒和未完成折叠的“核”(黑色箭头)存在,说明部分类球状结构没有形成纤维结构。
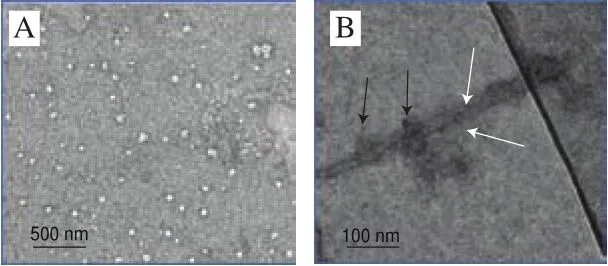
图1 SPI(A)、Fib SPI(B)微观形态Fig.1 TEM images of SPI (A) and Fib SPI (B)
2.2 Fib SPI结构形成动力学分析
ThT可与纤维团聚体的-折叠结构表面存在结合位点,在荧光光谱中产生强吸收峰,因此ThT荧光光谱常用于监测蛋白纤维形成的过程;实验测定酸热处理过程中(0、5、15、45、90、120、180、300 min)蛋白样品与ThT结合后荧光强度的变化,结果如图2所示。在初始阶段(0~15 min),酸性条件下加热处理导致样品荧光强度急剧增加,15 min后其荧光强度增长速度逐渐减慢,并逐渐趋于平缓,与王金梅等报道类似。Loveday等发现蛋白质纳米纤维的形成过程主要包括滞后阶段、生长阶段和固定阶段,包含蛋白部分变性、成核、聚合、延伸和终止几个步骤。本研究发现SPI形成纳米纤维结构的过程中没有滞后期,初期荧光强度快速增加,可能与蛋白发生去折叠反应有关,大量的-折叠结构暴露,成核聚集,可作为“构筑单元”,参与纤维结构形成的生长阶段。随后,荧光强度逐渐平稳,可能与去折叠的蛋白分子迅速连接,使纤维聚集快速生长有关。同时,在加热时间延长的情况下,样品具有强分散性,且始终澄清透明。

图2 加热过程中Fib SPI形成动力学分析Fig.2 Kinetic analysis of Fib SPI formation at different heating times
2.3 SDS-PAGE与分子质量分析
进一步利用非还原型SDS-PAGE分析SPI成纤维过程中蛋白亚基组成的变化。如图3所示,随着加热时间的延迟,7S组分首先发生降解,随后11S组分逐渐被水解。具体来说,加热初期(0~45 min),7S发生快速的降解,其特征亚基(、’)条带消失,同时随着7S的降解,ThT荧光强度上升,表明7S亚基的降解可能为-折叠结构的形成提供组成单元,是纤维形成过程的储备阶段。加热后期(90~300 min),11S的AB亚基开始降解且出现大量小于20 kDa的肽,但是相应的ThT荧光强度没有发生持续增加,表明7S的降解可能是蛋白发生自组装的前提,而11S的降解没有参加纤维结构的重组过程,且以肽作为构建块参加纤维形成的固定阶段。

图3 加热过程中SPI的SDS-PAGE(非还原)Fig.3 SDS-PAGE patterns (non-reduced) of SPI at different heating times
同时利用高效液相色谱法对SPI和Fib SPI的分子质量进行测定,如表1所示。经过长时间加热处理后,相比于SPI,Fib SPI的分子质量比例变化显著,出现大量小于3 kDa的小肽组分,同时大于10 kDa的组分比例降低。结果进一步证明随着加热时间的延迟,SPI发生降解,产生大量小分子肽和氨基酸组分,与非还原型SDS-PAGE的实验结论相对应。
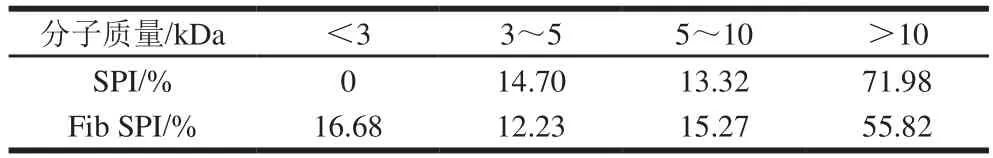
表1 SPI、Fib SPI分子质量比例Table 1 Molecular mass composition of SPI andFib SPI
结合非还原型SDS-PAGE、分子质量比例实验结果发现:在纤维形成过程中,7S及11S组分和其特征亚基先后发生降解,产生大量低分子质量的多肽和氨基酸组分,影响成纤维过程;其中7S的降解利于折叠结构的形成,而11S降解促进纤维生长。
2.4 Fib SPI结构形成过程中还原能力的变化
对比分析SPI成纤维过程中样品还原力的变化,由图4可知,随着加热时间的延长,样品的还原能力整体呈上升趋势,并在300 min达到最大,表明SPI纤维化有利于提升样品的抗氧化性,其可能与亚基降解及小分子肽段的形成有关。已有研究发现,乳清蛋白在纤维化的过程中会暴露具有还原性和抗氧化性的氨基酸或小肽基团,使形成的纳米纤维结构较原始蛋白具有更强的抗氧化活性,更利于维持易氧化物质的稳态。
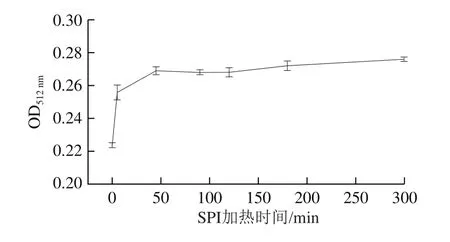
图4 加热过程中SPI的还原能力Fig.4 Reducing power of SPI at different heating times
2.5 Fe FibSPI复合物的形成
如图5A所示,利用强还原剂NaBH还原FeCl可制备得到铁纳米颗粒(Fe NPs)。Fe NPs在水相体系中很容易发生氧化聚集,胶体稳定性差,不利于在食品中直接应用。基于蛋白纤维的结构特性及强还原能力,在NaBH-FeCl体系中加入Fib SPI,使Fe NPs直接在Fib SPI表面形成,制备得到Fe FibSPI复合物。利用蛋白纳米纤维的结构特性可以防止Fe NPs发生胶体聚集沉淀,如图5B所示;同时,蛋白的还原能力有利于将铁保持在Fe(II)状态。
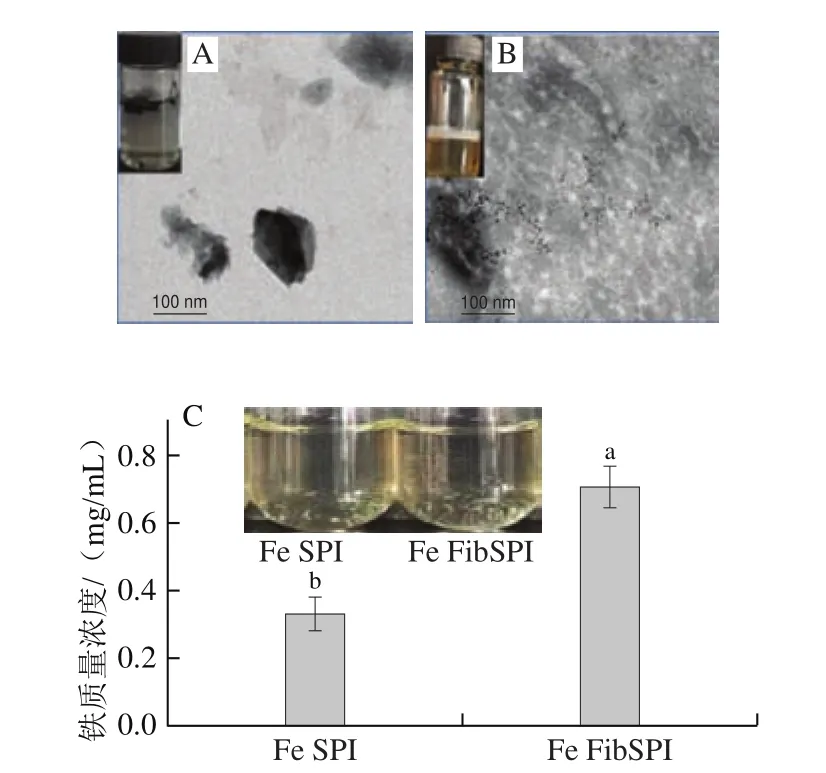
图5 Fe NPs(A)、Fe FibSPI(B)微观形态和Fe SPI、Fe FibSPI的Fe(II)含量(C)Fig.5 TEM images of Fe NPs (A), Fe FibSPI (B) and iron contents in Fe SPI and Fe FibSPI (C)
为了比较不同蛋白结构在Fe NPs荷载的性能差异,实验分别采用SPI及Fib SPI作为Fe NPs的递送载体,对比样品中Fe(II)的含量。如图5C所示,样品体系水分散性较好,均呈现较高光学透明度;这些结果表明,蛋白的存在防止了Fe NPs的不可逆聚集及其随后在溶液中的沉淀现象;相比Fe SPI,Fe FibSPI含有较高的Fe(II)含量,可能与纤维蛋白具有高纵横比,提供更多Fe NPs的还原空间有关,所制备得到的Fe FibSPI在液体食品中体现了一定的应用前景。
2.6 Fe FibSPI的稳定性评价
将Fe SPI与Fe FibSPI分散液放置于室温贮存,贮存过程中Fe(II)的保留率一定程度上可以反映样品稳定性,结果如图6所示。放置1 周后,Fe SPI与Fe FibSPI分散液中Fe(II)的保留率均在90%以上,且样品间没有显著差异(>0.05);贮存一个月后,Fe NPs分散液中不溶性黑色聚集物溶解,体系明显变浑浊,颜色变为橙色,可能与贮存过程中铁纳米颗粒发生强烈的氧化反应有关;而SPI与Fib SPI稳定的Fe NPs均保持良好的水分散性,呈现高透明度,两者外观无明显差异,不过Fe FibSPI中Fe(II)保留率显著高于Fe SPI,表明FibSPI在稳定Fe NPs表现出更优异的性能,可能与纤维的高分散结构及其较高还原能力有关。
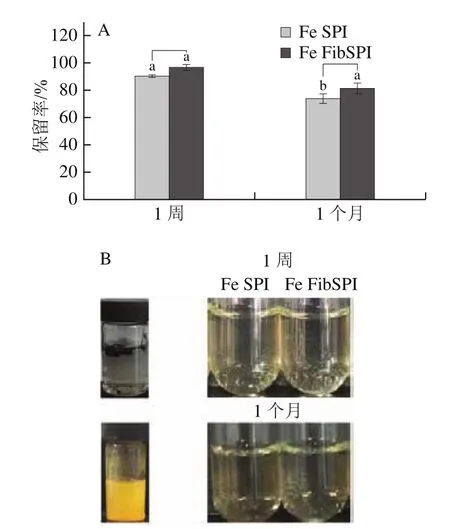
图6 Fe SPI、Fe FibSPI贮存过程中Fe(II)的保留率(A)和状态(B)Fig.6 Retention rates (A) and status (B) of Fe (II) in Fe SPI and Fe FibSPI during storage
2.7 Fe FibSPI对乳液稳定性的影响
许多生物利用度高的铁强化剂不方便在食品中直接添加使用,比如硫酸亚铁本身极易氧化,易对食品品质造成不良感官影响,尤其是当体系有油脂存在时,Fe(II)作为诱导剂可极大加速脂质氧化,降低了食品品质及贮存期。因此实验进一步以水包油乳液为含油食品体系模型,探究Fe SPI以及Fe FibSPI对乳液体系色度及物化稳定性的影响。实验以常见2 种水溶性铁强化剂即硫酸亚铁和氯化铁为对照铁强化剂。
2.7.1 乳液色度的变化
如图7所示,相比于新鲜乳液,Fe SPI及Fe FibSPI对乳液色度的影响较FeSO或FeCl小;同时,乳液上方有少量颜色浮渣存在,以添加FeSO的乳液最为明显;可能是相比于水溶性铁化合物如FeSO和FeCl,Fe SPI以及Fe FibSPI的蛋白载体降低了Fe(II)的反应活性,从而降低乳液颜色改变,Shen Yi等的报道中有类似发现。

图7 经不同铁强化剂处理的乳液ΔE*ab(A)和颜色(B)Fig.7 ΔE*ab (A) and color (B) of emulsions added with different iron fortifiers
2.7.2 乳液粒径的变化
乳液贮藏过程中粒径的变化一定程度上可反映其物理稳定性,一般认为,在一定的贮存时间内,如果乳液的粒径不发生明显变化,说明其抗聚结稳定性好。如图8所示,与空白乳液相比,铁强化乳液其粒径均在贮存过程中出现不同程度的增加,表明铁强化剂会降低乳液的贮存稳定性。相比于添加FeCl、Fe SPI的乳液,经Fe FibSPI强化的乳液粒径变化较小,表明同等情况下可显著性提高乳液的贮存期。
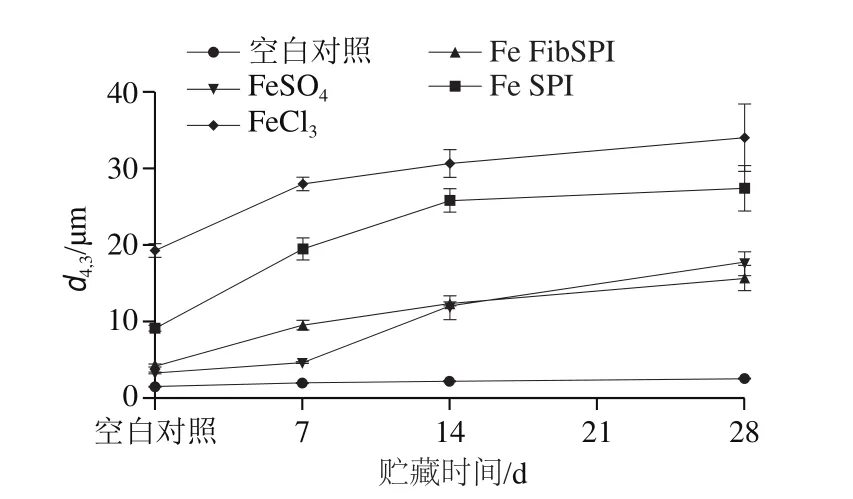
图8 不同铁强化剂处理的乳液粒径Fig.8 Change in mean droplet diameter of emulsions added with different iron fortifiers during storage
2.7.3 乳液的脂质氧化
油脂氧化稳定性也是评价乳液品质的重要指标。实验通过测定乳液贮藏过程中CD值的变化监测油脂的二级氧化产物的生成情况,初步探究不同源铁强化剂对乳液氧化稳定性的影响。
由图9所示,与空白乳液相比,在贮存过程中铁强化乳液的CD值出现不同程度的增加,FeCl和Fe SPI强化乳液具有较高的CD值,而Fe FibSPI强化乳液具有较低的CD值,这可能与样品中蛋白具有强抗氧化能力,降低以Fe(II)作为诱导剂的油脂氧化有关。对比不同铁强化乳液中脂质氧化程度,Fe FibSPI在以乳液为代表的含油液体食品基质中展现出了较好的应用前景。
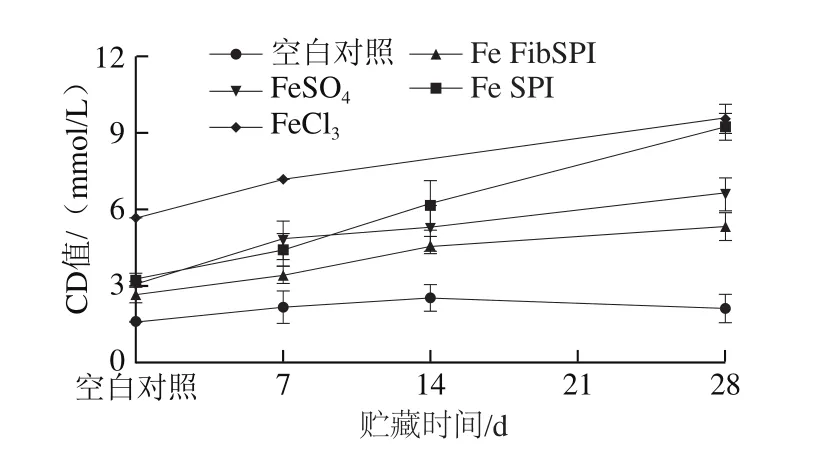
图9 经不同铁强化剂处理的乳液的CD值Fig.9 CD of emulsions added with different iron fortifiers
3 结 论
SPI在酸性条件下加热处理,7S、11S依次发生降解,球形蛋白质分子去折叠,产生了大量具有还原特性小肽组分,形成了稳定性强、还原性高的大Fib SPI结构。对比SPI,Fib SPI具有更大的活性负载空间,Fe NPs能够在蛋白纳米纤维表面形成以Fe(II)状态存在的Fe FibSPI复合物。使用这一具有良好胶体稳定性和强还原特性的Fib SPI递送Fe NPs,可以明显提高Fe NPs水分散性,形成透明度高的Fe FibSPI分散液。与传统的铁强化剂相比,Fe FibSPI强化乳液可显著降低传统铁强化剂对乳液颜色、贮藏稳定性及氧化稳定性的不良影响,为构建新型植物基铁强化剂递送体系以预防或降低缺铁性贫血发病率提供了一定理论和方法指导。

