流场对MEC生物阴极CO2还原性能与产物的影响
徐沛,贾璇,王勇,亓雪娇,赵玉娇,李鸣晓
(1 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012;2 北京工商大学,国家环境保护食品链污染防治重点实验室,北京 100048)
化石燃料的急剧消耗不仅使得全球能源危机日益加重,还造成温室气体猛增,气候变化成为全球性问题。根据国际能源署统计,2015年全球CO排放量为32.4Gt,其中我国排放量占全球总排放量的28%。2020 年,我国在联合国大会上提出“碳达峰”、“碳中和”的目标,成为全球碳减排的动力站,碳捕集、利用与封存(carbon capture,utilization and storage,CCUS)技术成为研究热点。目前CCUS技术主要分为物理法和化学法,利用物理吸附和化学吸附等手段对CO进行捕集,而微生物电化学法作为一项新兴的CCUS技术,其有着绿色、环保和效率高等优势。近年来,有学者采用微生物电解池(microbial electrolysis cell,MEC)进行CO捕集与利用。通过MEC 生物阴极的功能微生物电催化作用将CO转化为低碳能源CH或高附加值的小分子平台化合物,如甲酸、乙酸和丙酸等。Liu 等研究发现MEC 可以有效地对生物沼气中的CO进行捕集转化,转化率最高可达22.7%。
利用MEC进行CO捕集和还原的过程发生在生物阴极上。研究表明,生物阴极的电子和质子利用效率是限制MEC 还原CO效率的关键因素。因此,提高生物阴极的电子和质子利用效率是提高MEC还原CO性能的关键。流场是流体在某时刻的空间分布和连续介质运动,有研究表明良好的流场可以改善反应器内的传质效果,提高微生物活性,增强反应器性能,而水力循环条件是影响反应器内部流场的重要因素之一。目前,关于流场的研究主要集中在厌氧消化领域,Chou等研究发现水力循环优化膨胀颗粒污泥床反应器的内部流场,进而增强了基质和污泥之间的传质过程,提高了对苯酚的去除效率。Gao 等采用停留时间分布和计算流体力学等方法优化MEC 中的内部流场,使反应器的产甲烷性能和有机物去除性显著提高。Tavares等提出在厌氧多相流工况下,水力循环产生的剪切力有利于物料表面生物膜的形成,从而提高了厌氧发酵速率。黄如一等进一步验证了水力循环在发酵启动阶段的加速作用,表明了水力循环在启动阶段的重要性。综上所述,流场通过改善传质过程,从而对提高产甲烷性能、加快污染物降解以及加速厌氧发酵阶段有着重要的影响,然而流场对MEC 生物阴极还原CO性能及其产物的影响还未有报道。
本文旨在探究流场提高MEC生物阴极CO还原性能和定向调控产乙酸的重要作用。通过改变阴极室内流场环境,通过质子、电子利用效率计算及微生物群落演替分析,阐明流场与MEC生物阴极CO还原性能、产物的响应规律,为碳达峰、碳中和战略的实施提供理论依据和技术支撑。
1 材料与方法
1.1 反应器搭建
实验采用双室型MEC,有机玻璃材质,反应器尺寸为210mm×210mm×150mm,单室有效容积为0.5L,阴阳极室由Nafion117 质子交换膜(PEM)隔开。阴极和阳极材料均为石墨毡(10cm×10cm×0.5cm),且垂直放置在阳极和阴极室中,外加直流电源(Keithley2280S-32-6 型)0.8V,采用数据采集系统(Keithley Instruments 2700,USA)记录电压值,反应器结构如图1所示。

图1 MEC反应装置示意图
1.2 MEC启动与运行
在MEC 启动和运行阶段,分别设置循环组和对照组。循环组通过蠕动泵连接阴极室的进水口和出水口,阴极液循环流速为60mL/min;对照组不进行阴极液的循环。循环组和对照组的阳极均为静态放置。MEC 反应器均采用间歇式进料模式,运行周期为4天。在启动阶段开始前,分别取150mL的厌氧颗粒污泥和300mL 的营养液加入MEC 的阴极室和阳极室,接入的第一个周期不施加恒电压,待第二个周期接入电源后,即为启动周期的开始。阳极和阴极共同营养液成分为:NaHPO,4.09g/L;NaHPO,2.54g/L;NHCl,0.31g/L;KCl,0.13g/L。阳极室以1.00g/L 的CHCOONa 作为碳源,阴极室以1.50g/L的NaHCO作为碳源,维生素与微量元素溶液配方参照文献[16]。当电流密度和阴极产物消耗电子量连续3 个周期保持稳定后视为启动成功。MEC 启动成功后去除阴极和阳极室中的厌氧颗粒污泥,进入稳定运行阶段。
1.3 分析方法
乙醇和挥发性脂肪酸(甲酸、乙酸、丙酸、正丁酸和异丁酸)含量分析,采用高效液相色谱法(HPLC,Agilent 1260 Infinity 型,美国),使用210nm 紫外检测器和Hi-plexH 色谱柱(安捷伦,尺寸7.7′300mm,粒径8μm) 测定。流动相为0.005mol/L HSO,流速为0.006mL/min。气体成分及含量测定使用气相色谱仪(Shimadzu,GC 2010 Pro,日本),色谱条件为:色谱柱采用填充柱(Shimadzu,Molecular Sieve,60/80 mesh),TCD 热导检测器,柱温50℃,进样口温度100℃,检测器温度110℃,电流30mV,载气为高纯氩气,进样量1mL。
采用高通量测序技术对MEC 阴极生物膜、阴极液和接种物进行检测。 使用338F (5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R (5′-GGACTACHVGGGTWTCTAAT-3′) 对16SrRNA 基因V3-V4 可变区进行PCR 扩增,扩增程序如下:95℃预变性3min,27 个循环(95℃变性30s,55℃退火30s,72℃延伸30s),然后72℃稳定延伸10min,最后在4℃进行保存(PCR 仪为ABI GeneAmp®9700 型)。 PCR 反应体系为: 5×缓冲液4μL,2.5m mol/L dNTPs 2μL,上游引物(5μmol/L) 0.8μL,下游引物(5μmol/L) 0.8μL,DNA 聚合酶0.4μL,模板DNA 10ng,ddHO补足至20μL。每个样本3 个重复。本文中出现的高通量样品编号为:接种物(A)、循环组阴极生物膜(C2)、对照组阴极生物膜(C1)、循环组阴极液(S2)以及对照组阴极液(S1)。
1.4 计算方法
电路电流根据电阻电压通过欧姆定律计算得到,并换算成基于MEC 阳极面积的电流密度。电流密度计算如式(1)。

式中,为电流密度,mA/m;为数据采集器监测到的电压,mV;为外部电阻,Ω;为电极面积,m。
阴极生成产物所消耗的电子量计算如式(2)。

式中,为产物所消耗的电子量,C;为生成产物的物质的量,mol;为1mol 产物所需要的电子数(8mol e/mol CH,8mol e/mol 乙酸);是法拉第常数,96485C/mol。
外电路转移电子量的计算为式(3)。

式中,为外电路转移电子量,C;为在时间时的电流值,A。
总电子利用效率的计算如式(4)。

式中,为整体电子利用效率,%;为产物所消耗的电子量,C;为外电路转移电子量,C。
2 结果与讨论
2.1 流场对MEC阴极产物的影响
如图2(a)所示,未加流场的对照组在启动和运行过程中甲烷产量呈现比较稳定的状态,甲烷平均产量为0.429mmol。而循环组在启动阶段甲烷产量逐渐上升,甲烷平均产量达到0.463mmol且在第四周期达到最大值(0.800mmol)。这一结果表明在启动阶段前期通过阴极内循环的方式可以提高MEC的产甲烷性能,加快反应器的启动。主要原因可能是当反应器内有足够的剪切力时,厌氧微生物之间用于代谢物快速运输的扩散距离可以缩短,从而对反应器产甲烷性能产生积极影响。然而,在之后的3个周期(第五、第六和第七周期)中,循环组的甲烷产量显著降低,阴极开始产乙酸[如图2(b)所示],这与启动阶段前3个周期的实验结果相反,可能由以下原因导致其结果:首先,在启动阶段初期,由于两组实验启动时接种的厌氧颗粒污泥相同,颗粒污泥富含丰富的产甲烷菌;其次,启动开始的3个周期是阴极生物膜形成阶段,此时嗜氢型产甲烷菌利用氢传递途径产甲烷,两组实验产甲烷情况相近,循环组由于流场的影响略高于对照组。随着反应器启动成功,循环组阴极生物膜结构在流场作用下发生改变,由图6(a)可知,产乙酸菌丰度逐渐提高,同时循环组阴极也检测到乙酸的产生。

图2 阴极甲烷和乙酸产量

图6 阴极生物膜和阴极液中细菌在属水平上的分布
由图2(b)可知,在整个启动和运行周期内,循环组的平均乙酸产量(0.303mmol)远高于对照组(0.0425mmol)。循环组的乙酸产量总体呈现上升趋势,并在第7周期达到最大值(0.630mmol)。而对照组的乙酸产量先上升后下降,且最大值(0.0400mmol)在第4周期取得。据文献报道,与纯产甲烷菌的培养相比,混合接种法可能会产生乙酸等其他副产物。并且在循环组启动后期,剪切力可能会破坏产甲烷菌与其他细菌之间的空间结构,从而削弱了MEC 的产甲烷性能,从而使得阴极产物逐渐由甲烷转变为乙酸。
综上所述,循环组在启动阶段的阴极总CO还原产物(甲烷、乙酸)要显著高于对照组,并且促使MEC生物阴极还原CO产物逐渐由甲烷转变为乙酸,表明流场不仅提高了生物阴极CO还原能力,还改变了CO转化途径。
2.2 流场对MEC阴极电子和质子利用的影响
图3(a)显示的是两组反应器在整个运行周期内(28 天)电流密度随时间的变化过程。由图3(a)可知,在一个运行周期内,两组反应器的电流密度随时间呈现先上升后下降的趋势。在整个运行周期中,循环组的电流密度逐渐上升,在第四周期达到峰值(0.350A/m)且在之后保持稳定状态,此时的甲烷产量也达到最大(0.800mmol),生成甲烷所消耗的电子量为617.850C。结合前文以及表1可知,在第七周期,循环组中的乙酸产量达到最大值(0.630mmol),此时生成甲烷和乙酸所消耗的电子量为176.430C 和483.950C,该消耗电子总量与第四周期的相近。这说明阳极基质氧化产生的质子和电子并没有完全转化为甲烷。对照组的电流密度整体保持稳定的水平,峰值为0.260A/m,整体生成甲烷所消耗的电子量约330.900C,该值大约是循环组的1/2。
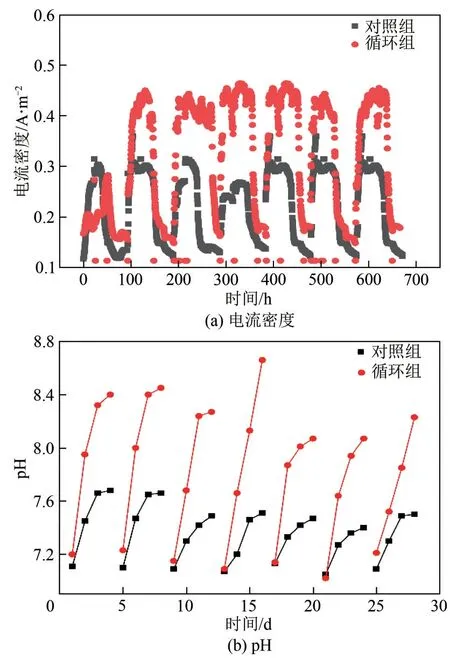
图3 两组反应器在整个运行周期内电流密度以及pH变化
由表1可以得出,通过积分计算外电路转移电子量,在第四周期,对照组和循环组的外电路转移电子量分别为446.470C 和759.380C,此时两组反应器中的阴极产物总量分别为0.580mmol、0.920mmol。再结合循环组和对照组的分别为79.33%、89.33%,表明水力循环方式增大了外电路转移电子量以及相应的阴极产物量,并且总电子利用效率也提高了10%。
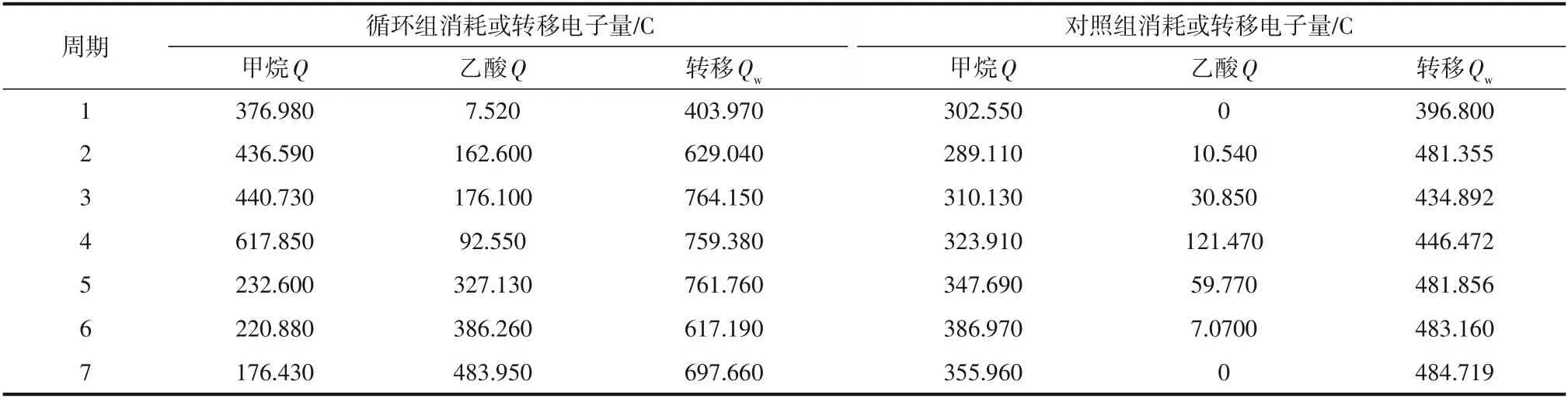
表1 阴极产物所消耗电子量Q、外电路转移电子量Qw
通过计算产甲烷和产乙酸所消耗电子量发现,在对照组中,产甲烷所消耗电子量占比先降后升,波动范围为72.7%~100%,平均产乙酸所消耗电子量占比为8%。而在循环组中,产甲烷所消耗电子量占比呈现下降趋势。第一周期,产甲烷所消耗电子量占比为98%,产乙酸所消耗电子量占比为2%。第七周期,产甲烷所消耗电子量占比为36.4%,产乙酸所消耗电子量占比为63.6%,平均产乙酸所消耗电子量占比为38%,表明随着运行周期的不断推进,电子的利用途径逐渐从产甲烷过程转变为产乙酸过程。
图3(b)为两组反应器在整个运行周期内(28天)pH 随时间的变化趋势。由图3(b)可知,循环组的pH 范围为7.09~8.66,该范围高于对照组(7.05~7.68)。有文献表明阴极液pH升高可能与阴极生物电催化过程质子消耗有关,pH 随着产物总量的增大而增大。在第四周期,循环组的pH 达到峰值(8.66),此时阴极产物(乙酸、甲烷)总量达到最大值,表明当阴极采取水力循环的启动方式时,阴极的质子消耗量显著提高。
可见,水力循环方式不仅提高了MEC 生物阴极的总电子利用效率(10%),还提高了质子的消耗量,增加了MEC 阴极乙酸产量,提高了MEC 生物阴极产乙酸性能。
2.3 流场对MEC阴极微生物群落的影响
2.3.1 MEC阴极微生物群落多样性
表2列举了两组反应器阴极和阴极液的微生物群落Alpha 多样性统计数据。由表2 可知,无论是对照组还是循环组,微生物群落的丰度和多样性都比接种物有所提高,表明MEC 阴极的驯化过程对微生物群落结构有着重要的影响。相比于对照组,循环组中阴极和阴极液的Ace 指数和Chao 指数均有所下降,表明流场导致MEC 阴极和阴极液的微生物群落丰度明显降低。循环组和对照组的阴极Shannon指数分别为4.141和3.637,阴极Simpson指数分别为0.0350和0.0680,表明循环组的阴极微生物多样性要低于对照组。而两组中的阴极液微生物多样性呈现相反的趋势,与图4中阴极和阴极液中的古菌分布趋势相吻合。这表明阴极水力学条件会影响到其优势菌群的富集,但是同时也会导致其微生物多样性和丰度有所下降。
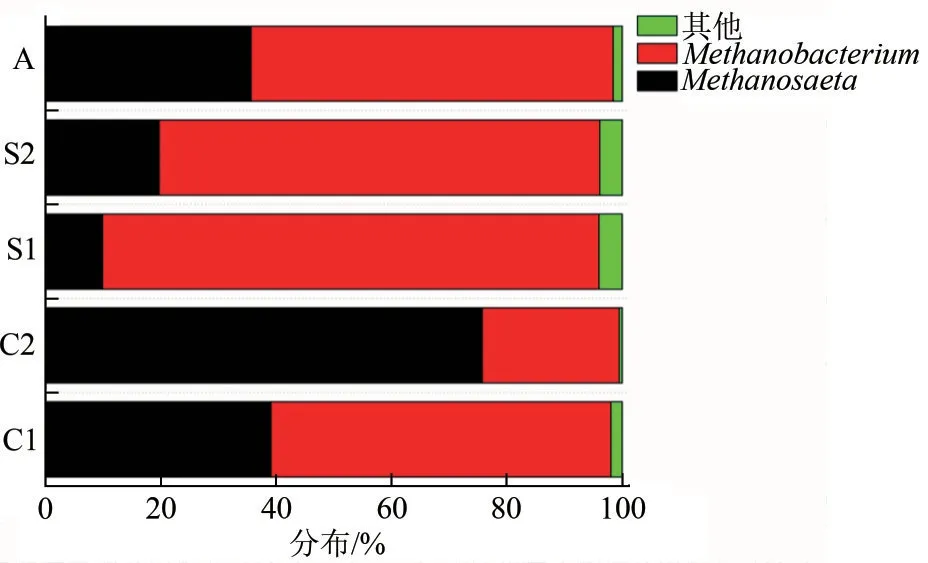
图4 阴极生物膜和阴极液中古菌在属水平上的分布(丰度≤0.2%都被归类于“其他”)

表2 微生物群落Alpha多样性比较
2.3.2 MEC阴极微生物群落结构演替
接种物(厌氧颗粒污泥)、不同反应器阴极生物膜以及阴极液中古菌在属水平上的分布如图4所示。由图4 可知,接种物中的嗜氢型产甲烷菌()和嗜乙酸型产甲烷菌()相对丰度分别达到62.8%、35.7%。将厌氧颗粒污泥接种到MEC 中后,阴极生物膜和阴极液中的古菌相对丰度均发生了显著的变化,类似现象也在还原CO产甲烷BES 中被发现。对照组中阴极生物膜上的嗜氢型产甲烷菌相对丰度最大(59%),其次是嗜乙酸产甲烷菌(39%),这一趋势与其阴极液中的产甲烷菌丰度变化保持一致。但是在循环组的阴极生物膜上,嗜乙酸型产甲烷菌的丰度最大,其占比达到了76%,而嗜氢型产甲烷菌丰度为24%。这一趋势与其阴极液中的优势产甲烷菌丰度(9.9%、86.1%) 有着显著的差别。并且相比于接种物,循环组生物阴极上的嗜乙酸型产甲烷菌丰度提高了大约2倍,其原因可能是嗜乙酸型产甲烷菌的耐剪切能力较强。这一现象与Hoffmann等的研究结果一致,甲烷丝菌属()在厌氧生物膜中是以长丝状生长,可以在高剪切力的厌氧反应器中生长。并且结合前文内容,循环组后期出现了MEC 阴极产乙酸的现象,产乙酸环境也有可能导致嗜乙酸型产甲烷菌的富集。度发生了明显的变化。在循环组中,阴极生物膜上的菌群丰度(59.3%)占绝对优势,而阴极液中的相对丰度只占到20.4%,其丰度与(20.1%)相当。相反的是,对照组中丰度(35.4%) 大约是阴极液(11%)的3倍。可见,流场的变化对生物阴极细菌丰度有显著影响。Guo 等研究表明,、和会参与产酸过程,这可能是MEC阴极CO还原过程产乙酸的原因。

图5 阴极生物膜和阴极液中细菌在门水平上的分布(丰度≤0.2%都被归类于“其他”)
如图6所示,在属水平上,按照微生物的主要功能,将细菌菌群分为三大类:与乙酸代谢相关类、与氢气相关类和其他具有重要功能种群。第一类(乙酸相关类)主要指的是具备产酸或酸降解的细菌;第二类(氢气类)主要指的是具备嗜氢或产氢功能的细菌;第三类(其他类)主要指的是在MEC 还原CO中具有重要功能的种群。从图6(a)可知,循环组阴极生物膜上(Cathode2) 的和相对丰度分别达到11.1%和20.1%,总占比达到31.2%,远远大于对照组和接种物中的丰度。和为均可利用有机碳和氮的化学自养型微生物,这两种细菌的富集可能是因为循环组阴极室大量乙酸的积累。循环组和对照组中主要的产酸菌是和,总相对丰度分别为11.3% 和7.5%。这两种菌都是在厌氧条件下产酸的功能微生物。循环组中的总占比为6.6%,高于对照组(5.9%)。是与产甲烷古菌互养的细菌,参与种间直接电子传递。
由图6(b)可知,接种物中(3.1%)为优势菌,经过驯化后,循环组和对照组中相对丰度显著提高,成为优势菌,分别达到7.5%和17.3%。是一种以氧化H作为能源的自养细菌,对体系中的质子和电子利用有着促进作用。
由图6(c)可知,循环组中阴极生物膜和阴极液中的相对丰度占比分别达到1.2%和3.5%,而在对照组中,该菌在阴极生物膜和阴极液中的占比(8.2%、3.3%)呈现相反趋势,表明流场对该菌在MEC 的分布有一定的影响。是一种硫酸盐还原菌,研究发现其与氢营养型产甲烷菌存在互养关系。此外,据报道的外膜中含有不同类型的细胞色素,表明可能参与了电极上的电子传递过程。
综上所述,循环组阴极室的产酸菌(、)丰度(11.3%)显著高于对照组(7.5%),乙酸降解菌(、)为循环组阴极生物膜上的优势菌属,表明流场促使生物阴极功能微生物群落由产甲烷菌为主向产乙酸菌演替。
3 结论
(1)流场不仅提高了MEC生物阴极的CO还原能力,还使其CO转化途径由启动阶段的产甲烷为主转变为运行阶段的产乙酸为主。
(2)流场促使循环组中生物阴极上的优势产甲烷菌由嗜氢型产甲烷菌转变为嗜乙酸型产甲烷菌,并且产酸菌(、)丰度相较于对照组提高了1.5 倍,表明流场显著影响生物阴极以及阴极液的微生物群落结构。
(3)该研究进一步验证了流场对MEC还原CO生物阴极有着重要的影响,可为MEC还原CO产乙酸的定向调控研究提供理论和技术支撑。

