脐带间充质干细胞来源的外泌体通过抑制TGF-β1/Smad 3通路修复单侧输尿管梗阻大鼠肾间质纤维化
俞 静,戴世荣,单荣梅,刘 香
(南通市第二人民医院检验科,江苏南通 226002)
肾间质纤维化(renal interstitial fibrosis,RIF)的发展与进行性肾损伤和慢性肾病(chronic kidneydisease,CKD)相关[1]。其中,肾小管间质纤维化(tubulointerstitial fibrosis)是CKD进展过程中非常重要和常见的病理变化,严重影响肾脏疾病的预后[2]。其主要诱因为糖尿病和高血压等[3-4];主要病理学特征是炎性细胞浸润、肾小管萎缩、毛细血管丢失和肌成纤维细胞增殖加速,以及细胞外基质(extracellular matrix,ECM)过度沉积[5];纤维化的肾小管间质中生长因子,尤其是转化生长因子-β(transforming growth factor β,TGF-β)和炎症因子的水平升高[6]。近年来,越来越多的证据表明肌成纤维细胞的持续激活和积累是造成RIF的主要病因[7]。长期肾小管间质纤维化降低了肾脏的再生潜力,并导致肾功能大幅下降[8]。目前仍然缺乏阻止肾纤维化进展的有效治疗方法[9]。
TGF-β是在大多数种类的CKD中驱动间质纤维化的主要因素。在多种肾纤维化动物模型中,抑制TGF-β1或其下游信号通路可显著限制肾纤维化,而过表达TGF-β1则诱导肾纤维化。TGF-β1可通过激活基于Smad的经典通路和不基于Smad的非经典通路来诱导肾纤维化,从而导致肌成纤维细胞的激活、ECM的过度产生和降解的抑制[10]。
间充质干细胞(Mesenchymal stem cells,MSCs)是多能成体干细胞,已广泛用于组织再生[11-12]。MSCs可改善肾功能,减少肾损伤,并抑制慢性肾纤维化[13-14],其中组织损伤主要通过MSCs的旁分泌机制修复[13]。外泌体(exosome)是细胞分泌的膜状纳米囊泡,通过将各种分子(包括核酸、蛋白质和脂质)从供体细胞传递到靶细胞来介导细胞通讯[15]。MSCs-衍生的外泌体已被证明对脊髓损伤、多发性硬化、梗塞心脏具有治疗作用[16]。人脐带间充质干细胞(human umbilical cord MSCs,huc-MSCs)是一种临床应用潜力巨大的MSCs[11-12]。在本次研究中,拟通过向huc-MSCs中转染腺病毒-TGF-β1-shRNA,并获得由其衍生的外泌体。将此外泌体尾静脉注射至单侧输尿管结梗阻(unilateral ureteral obstruction,UUO)模型大鼠的体内,观察外泌体对大鼠肾间质纤维化的疗效,以评估递送TGF-β1 shRNA的huc-MSCs-衍生的外泌体对肾间质纤维化的治疗效果。
1 材料与方法
1.1 实验材料SD大鼠由南通大学实验动物中心提供。Trizol裂解液(货号15596018),RIPA裂解液(货号89901),Lipofectamine 3000(货号L3000015),总外泌体分离试剂(从细胞培养基)(货号4478359)购自美国Thermo Fisher公司。抗-CD34-PE、抗-CD44-PerCP-Cy5.5、抗-CD45-PerCP-Cy5.5、抗-CD73-APC和抗-HLA-DR FITC购自美国BD公司。兔抗大鼠-TGF-β1(货号ab215715)、兔抗人-CD 9(货号ab236630)、兔抗人-CD 63(货号ab134045)及兔抗大鼠-Collagen I(货号ab270993)、兔抗大鼠-Fibronectin(货号ab268020)、兔抗大鼠-α-SMA(货号ab7817)、兔抗大鼠-GAPDH(货号ab8245)、抗大鼠-p-Smad 2(货号ab280888)、抗大鼠-Smad 2(货号ab40855)购自美国Abcam公司。Bradford蛋白质定量试剂盒(货号PA102),动物组织总RNA提取试剂盒(货号DP431)、FastKing一步法反转录-荧光定量试剂盒(SYBR Green)(货号FP313)购自中国天根生化公司。Immobilon ECL Ultra Western HRP底物(货号WBULS0100)购自美国Sigma-Aldrich公司。Masson染色液套装,HE染色液购自中国国药集团公司。
FACSCalibur流式细胞仪购自美国BD公司。纳米粒子追踪分析系统(型号NanoSight LM10系统)购自英国Malvern Panalytical公司。Nikon光学显微镜(型号Ci-E)购自日本。
1.2 人脐带间充质干细胞(huc-MSCs)的分离和培养脐带来自捐赠者(均签署知情同意书),于2 h之内进行huc-MSCs分离:去除脐带的动脉、静脉和上皮。将暴露的间充质组织,用4 ℃预冷的0.1 mol/L PBS冲洗,分切成约0.5 cm边长的立方体,以离心力为250 g离心5 min,弃上清,重复1次上述步骤后,接种入T75组织培养瓶中,培养于含20%胎牛血清(FBS)和1%青链霉素的低糖DMEM中,在37 ℃、5% CO2(体积分数)的湿润的恒温培养箱中培养。培养10~12 d后,洗去残留的脐带碎片,贴壁细胞培养至汇合度达到80%(第一代)时传代。在第3代至第5代之间扩增并冻存huc-MSCs。
接着对huc-MSCs进行鉴定:将待鉴定和分选的huc-MSCs制备成为单细胞悬液,并使用抗-CD34-PE、抗-CD44-PerCP-Cy5.5、抗-CD45-PerCP-Cy5.5、抗-CD73-APC和抗-HLA-DR FITC进行标记。接下来,使用FACSCalibur流式细胞仪对细胞进行分选,并通过FlowJo软件分析数据。随后对分选的细胞进行扩大培养,在第6代和第8代之间获得的huc-MSCs用于制备外泌体。
1.3 单侧输尿管梗阻(UUO)大鼠模型建立8~9周龄雄性SD大鼠,体质量250g。恒温恒湿SPF级鼠房温度25 ℃,相对湿度50%,12 h/12 h明暗光照循环。对大鼠进行适应性饲养1周后。UUO模型组大鼠全身麻醉,通过左侧腹部切口,用4-0丝线在输尿管-骨盆交界处结扎左侧输尿管;右侧输尿管不行结扎操作。假手术(Sham)组,仅对大鼠行全身麻醉和左侧腹部切口,不对双侧输尿管进行结扎操作。在对大鼠行左侧输尿管结扎24 h后,对外泌体治疗(Exosome)组,通过鼠尾静脉注射外泌体;对UUO模型组大鼠,通过鼠尾静脉注射等量PBS。每组5只。术后对大鼠进行常规饮食喂食;术后第14天对所有动物实施CO2窒息安乐死,取其肾脏进行下游指标检测。所有动物实验已通过我院伦理委员会批准。
1.4 腺病毒Adeno-shRNA-TGF-β1的构建将对照组shRNA-NTC(5’-GTGCACACTCTGTATGTCT CGTG-3’)和敲低组shRNA-TGF-β1(5’-GCCCAT CTAGGTTATTTCCGTGG-3’)分别插入pADV-U6-shRNA-CMV-EGFP载体中,构建Adeno-shRNA-NTC和Adeno-shRNA-TGF-β1载体。使用Lipofectamine3000分别将Adeno-shRNA-NTC和Adeno-shRNA-TGF-β1与PU1563质粒共转染HEK 293T细胞,产生腺病毒颗粒。用制备好的腺病毒(Adeno-shRNA-NTC、Adeno-shRNA-TGF-β1)转导huc-MSCs。将稳定转导的huc-MSCs-shRNA-NTC和huc-MSCs-shRNA-TGF-β1细胞系在无血清低糖DMEM培养液中培养48 h,收集上清液并分离外泌体用于进一步研究。
1.5 外泌体的分离收集来自稳定转导huc-MSCs-shRNA-NTC和huc-MSCs-shRNA-TGF-β1细胞系的细胞上清液,使用总外泌体分离试剂(从细胞培养基)对外泌体进行分离和纯化。使用BCA蛋白质测定试剂盒测定外泌体蛋白质浓度,作为外泌体的定量。用于体内动物研究,每只动物使用200 μg外泌体。
1.6 纳米粒子追踪分析通过纳米粒子追踪分析系统(型号NanoSight LM10系统)测量布朗运动的速率并分析外泌体的大小。NanoSight系统至少捕获5个时长为30 s的粒子在布朗运动下移动的视频。然后使用系统内置的NTA v 3.0软件分析视频的尺寸分布和颗粒浓度。
1.7 IVIS Lumina系统荧光成像分析向外泌体溶液中加入Dil染料混匀,37 ℃共同孵育30 min,PBS洗去多余染料;重新过滤获得外泌体溶液,备用。单侧输尿管结扎后24 h通过鼠尾静脉注射外泌体至大鼠体内,24 h后对大鼠各脏器,在IVIS Lumina系统中进行荧光成像分析。在激发光照射下,观察外泌体干预组与对照组大鼠各脏器荧光分布情况。
1.8 冷冻透射电子显微镜成像在受控环境玻璃化系统中进行外泌体溶液的冷冻透射电子显微镜成像。室温度为25~28 ℃,相对湿度保持接近饱和,以防止样品在制备过程中蒸发。将室温下的2 mL外泌体样品溶液置于由铜网格支撑的碳涂层多孔膜上,在网格上获得薄液膜(20~200 nm)。将网格在-180 ℃的液态乙烷中快速淬灭,然后转移到液氮(-196 ℃)中储存。加速电压为200 kV,工作温度保持在-170 ℃以下。使用电荷耦合器件相机以数字方式记录图像,焦距约为3 μm。
1.9 免疫组织化学染色、HE染色和Masson染色大鼠肾脏组织经10%中性福尔马林固定和石蜡包埋,随后切成4 μm切片。切片经抗原修复后,滴加3%H2O2封闭内源性过氧化物酶,再滴加5%BSA室温封闭1 h。孵育兔抗TGF-β1一抗,4 ℃孵育过夜。第2天,滴加山羊抗兔IgG(H+L)HRP偶联二抗,37 ℃孵育30 min。滴加适量生物素底物覆盖切片表面,37 ℃孵育30 min,然后滴加DAB显色液,光学显微镜下显色约5 min,待组织切片出现棕黄色阳性区域后用蒸馏水终止显色。用苏木精染核90 s。中性树胶封片,在Nikon光学显微镜下观察拍照。
HE染色:大鼠肾脏组织切片经二甲苯脱蜡后,行苏木精染色,然后经1%的盐酸乙醇分化,再进行伊红染色,中性树胶封片,在Nikon光学显微镜下观察拍照。Masson染色:大鼠肾脏组织切片经二甲苯脱蜡后,使用Masson染色液套装进行染色,操作步骤按照染色液套装说明书进行即可。
1.10 Western blot分析向大鼠肾脏组织中加入含有蛋白酶抑制剂混合液的RIPA裂解液,在液氮中研磨,制备组织匀浆并提取总蛋白。用Bradford蛋白质定量试剂盒定量总蛋白质浓度。取10 μg/样本总蛋白进行SDS-PAGE凝胶电泳。半干转印后,PVDF膜加入含10%脱脂牛奶的TBS-T缓冲液封闭于室温封闭1 h,随后在4℃下孵育一抗过夜。抗体信息如下:兔抗人-CD 9,兔抗人-CD 63;兔抗大鼠-Collagen I,兔抗大鼠-Fibronectin,兔抗大鼠-α-SMA,兔抗大鼠-GAPDH,兔抗大鼠-TGF-β1,抗大鼠-p-Smad 2,抗大鼠-Smad 2。第2天,于37 ℃孵育二抗1 h。二抗信息如下:山羊抗兔IgG(H+L)HRP二抗。随后滴加ECL发光底物进行化学发光和条带显色。
1.11 逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-qPCR)分析向大鼠肾脏组织中加入Trizol裂解液,在液氮中研磨,制备组织匀浆。使用动物组织总RNA提取试剂盒提取组织总RNA。取2 μg/样本的总RNA,使用FastKing一步法反转录-荧光定量试剂盒(SYBR Green)(FP313)进行RT-qPCR反应。RT-qPCR扩增引物:TGF-β1上游引物:5’-GCCCATCTAGGTTATTTCCGTGG-3’,TGF-β1下游引物:5’-TAAAGCAGGTTCCTGGTGGG-3’。
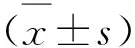
2 结 果
2.1 huc-MSCs-衍生的外泌体的鉴定对腺病毒Adeno-shRNA-NTC和Adeno-shRNA-TGF-β1分别转导至huc-MSCs中分离并获得的外泌体囊泡进行纳米粒子追踪分析鉴定,其直径为(105.8±39.7) nm(图1A)。通过使用透射电子显微镜进一步表征外泌体,显示其呈杯状球形囊泡(红色箭头所指)(图1 B)。采用Western blot对来源于上述两种huc-MSCs的外泌体进行外泌体表面标志物鉴定,其均表达CD9和CD63(图1C)。使用来源于上述两种huc-MSCs的外泌体处理HEK 293T细胞,采用RT-qPCR对细胞中TGF-β1的表达量进行检测,发现相对于含有Adeno-MSCs-shRNA-NTC的外泌体而言,含有Adeno-shRNA-TGF-β1的外泌体能够显著抑制TGF-β1 mRNA的表达(图1D,P<0.01)。
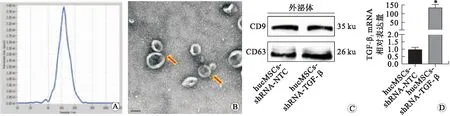
A:纳米粒子追踪分析测定外泌体直径;B:透射电子显微镜获得的外泌体成像结果;C:Western blot法测定外泌体表面标志物CD9和CD63的表达情况;D:RT-qPCR法测定外泌体处理的HEK 293T细胞中TGF-β1 mRNA的表达量。*与含有Adeno-shRNA-NTC的外泌体比较,P<0.01。图1 外泌体的分离鉴定
2.2 来源于huc-MSCs的外泌体在体内(invivo)分布的荧光成像分析来源于huc-MSCs的含有Adeno-shRNA-TGF-β1的外泌体显示经Dil染色后,经尾静脉注射至假手术组或UUO模型组大鼠体内,IVIS Lumina系统荧光成像分析发现外泌体经过血液循环后到达肾脏,大部分聚集于左侧损伤肾脏,在其他脏器仅略有分布。UUO模型组大鼠左肾的荧光强度最强,主要呈绿色至红色;而其他组织和部位的荧光强度仅呈蓝色至绿色。结果表明外泌体能够到达损伤的肾脏,具有定向迁移能力(图2)。
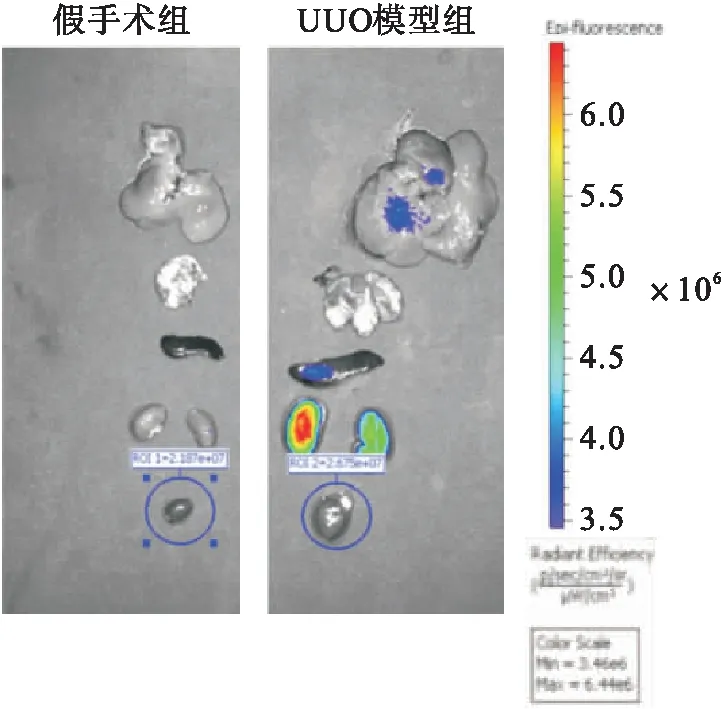
图2 来源于huc-MSCs的外泌体在体(in vivo)分布的IVIS Lumina系统荧光成像图
2.3 来源于huc-MSCs的含有Adeno-shRNA-TGF-β1的外泌体对单侧输尿管梗阻(UUO)大鼠的疗效检测HE染色和病理学分析显示,相较于Sham组大鼠,UUO组大鼠肾小球基底膜较正常大鼠明显增厚,而外泌体治疗(exosome)组大鼠肾小球基底膜增厚有所缓解(图3 A上排)。
Masson染色显示,Sham组大鼠肾间质基本无蓝色着色,表明基本无胶原纤维沉积;而UUO组大鼠肾间质内有大量胶原纤维,蓝色着色显著加深;Exosome组大鼠肾间质蓝色着色变浅,表明胶原纤维沉积明显缓解(图3A下排)。对TGF-β1的免疫组织化学染色结果显示,Sham组大鼠肾间质染色呈浅棕色,表明TGF-β1表达水平较低;而相对于Sham组,UUO组大鼠肾间质染色呈深棕色,表明TGF-β1表达水平大幅升高(图3B,P<0.01);相较于UUO组,Exosome组大鼠肾间质染色呈中等程度的棕色着色,表明TGF-β1表达水平明显降低(图3B,P<0.01)。
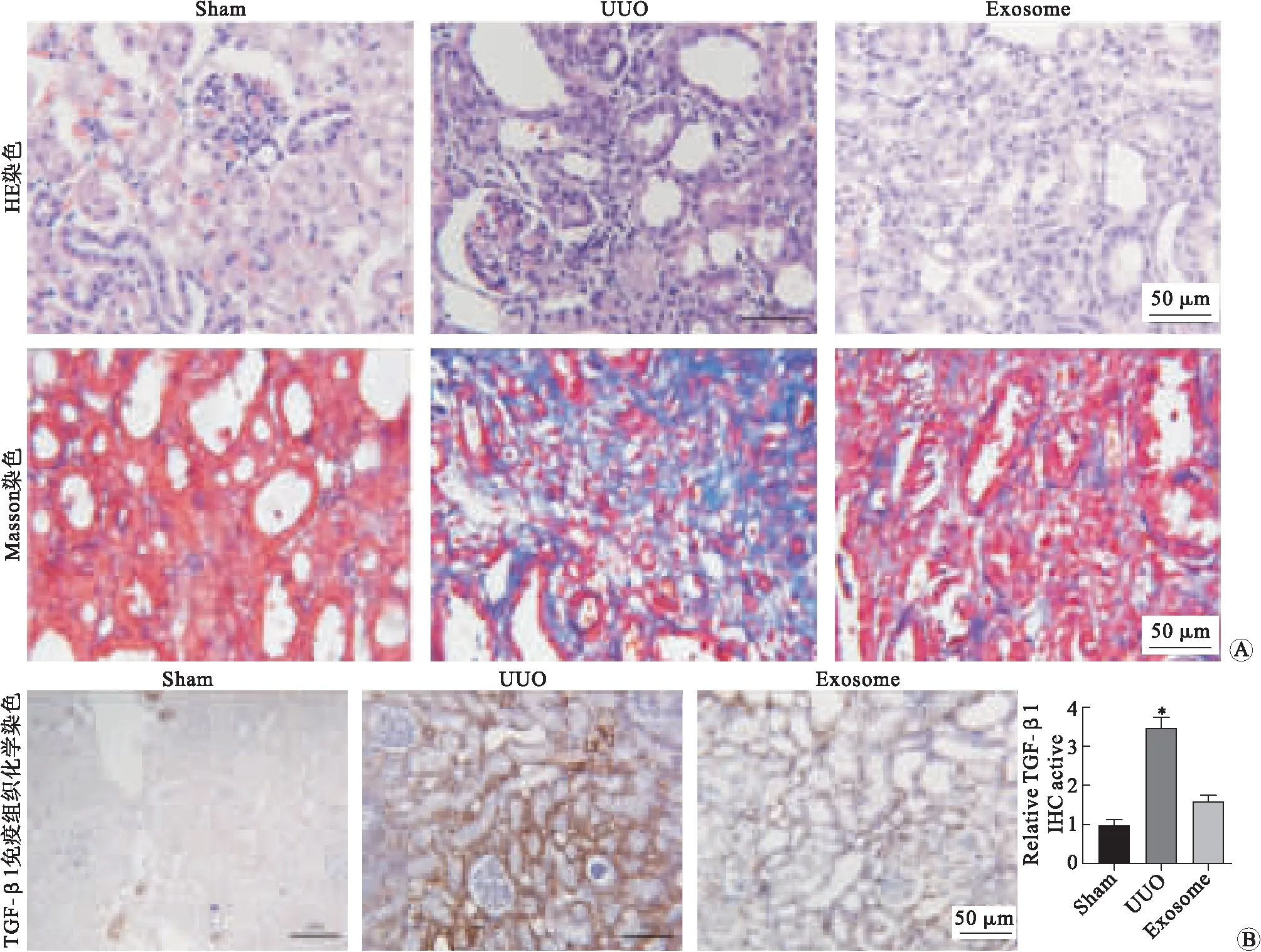
A:Sham(假手术)组、UUO(单侧愉尿管梗阻)组和Exosome(外泌体治疗)组大鼠肾脏HE染色(上排)和Masson染色(下排)结果;B:TGF-β1的免疫组织化学染色成像结果(左侧3个)和柱状图统计结果(右侧1个)。*与Sham(假手术)组及Exosome(外泌体)组相比,P<0.01。图3 来源于huc-MSCs的含有Adeno-shRNA-TGF-β1的外泌体对UUO大鼠的疗效
2.4 来源于huc-MSCs的含有Adeno-shRNA-TGF-β1的外泌体通过下调磷酸化-Smad 3发挥对UUO大鼠的治疗效果对各组大鼠的肾间质组织进行Western blot检测,结果显示,相较于Sham组大鼠,UUO组大鼠的I-型胶原蛋白(Collagen I)、纤连蛋白(Fibronectin)和α-平滑肌肌动蛋白(α-SMA)(P<0.01)表达显著升高;而相较于UUO组大鼠,外泌体治疗(Exosome)组大鼠上述3种蛋白因子的表达量明显下降(P<0.01,图4A)。相较于Sham组大鼠,UUO组大鼠的TGF-β1和p-Smad 3表达显著升高(P<0.01);后又被外泌体治疗显著抑制,相较于UUO组大鼠,Exosome组大鼠TGF-β1和p-Smad 3表达显著降低(P<0.01,图4B)。
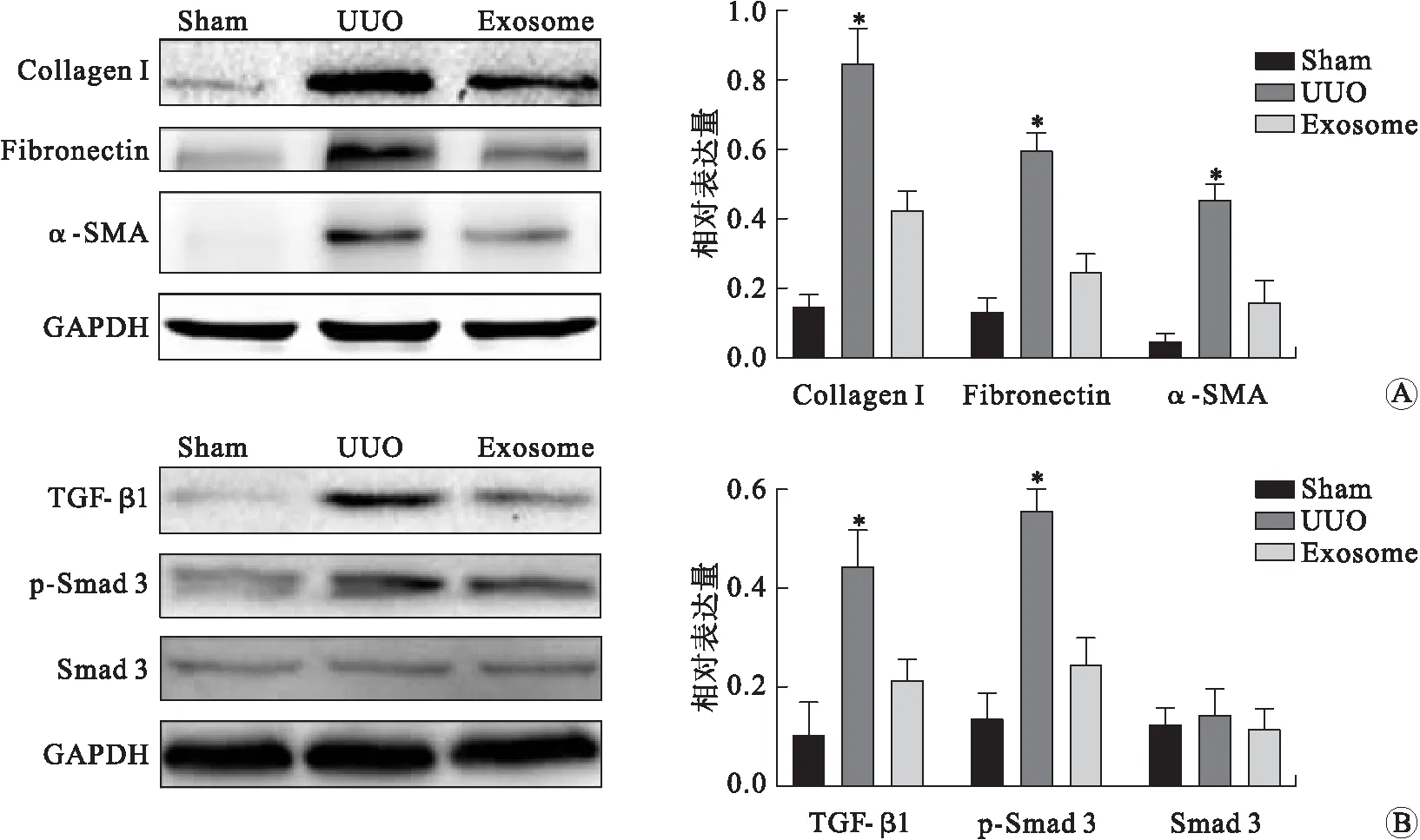
A.Western blot检测Sham(假手术)组、UUO(单侧输尿管梗阻)组和Exosome(外泌体治疗)组大鼠肾间质组织中Collagen I、Fibronectin和α-SMA的表达;B.Western blot检测3组大鼠肾间质组织中TGF-β1、p-Smad 3和Smad 3的表达。*与Sham及Exosome组相比,P<0.01。图4 来源于huc-MSCs的含有Adeno-shRNA-TGF-β1的外泌体通过下调磷酸化-Smad 3发挥对UUO大鼠的治疗作用
3 讨 论
肾纤维化是肾实质内瘢痕的堆积。肾损伤后纤维化基质的沉积最初可能有助于组织修复,在轻度损伤后,少量的沉积基质将在随后的组织修复过程中被吸收。然而,在CKD慢性损伤期间,纤维化基质沉积持续而不受控制,进而破坏肾脏结构,减少血液供应,降低肾脏功能,最终导致肾功能衰竭[17]。
TGF-β是生长因子超家族的一部分。目前已经在哺乳动物中鉴定了3种不同的TGF-β亚型(TGF-β1、TGF-β2 和 TGF-β3)[18]。所有3种亚型都与TGF-β受体2(TGFR2)结合;然后TGFR2募集并激活TGFR1以激活受体信号转导[18]。TGF-β1通过直接和间接方式促进肾纤维化。研究最广泛的机制是TGF-β1对肾脏成纤维细胞型细胞(即系膜细胞和成纤维细胞)的直接作用。TGF-β1直接作用于这些细胞,诱导细胞增殖、迁移、激活和促纤维化分子的转录,包括胶原蛋白、纤连蛋白和纤溶酶原激活物抑制剂-1(PAI-1)[18]。在肾脏疾病动物模型中阻断TGF-β1的信号,可减少成纤维细胞活化和胶原沉积[18]。TGF-β1还可以通过间接机制诱导纤维化反应。例如,TGF-β1可以诱导内皮细胞和促细胞凋亡,促进肾小球和肾间质纤维化[10]。此外,TGF-β1是间充质基因表达程序的有效诱导剂,可诱导上皮细胞、内皮细胞和肾成纤维细胞转变为表达α-平滑肌肌动蛋白(α-SMA)的肌成纤维细胞[19]。因此,TGF-β1通过多种机制诱导肾纤维化。
尽管TGF-β1在肾纤维化的发生和进展中起主导作用,但其效应Smad蛋白(Smad2、Smad3和Smad4)在纤维化的调节中发挥着不同甚至相反的功能[18]。来自患有纤维化肾病的患者和小鼠的肾组织样本显示活化(即磷酸化)的Smad 2和Smad 3水平升高[18]。与野生型小鼠相比,Smad 3缺陷小鼠在诱导肾损伤后胶原沉积减少[20]。而条件性基因缺失研究明确了Smad 2在肾纤维化过程中的保护性、抗纤维化作用[20]。
通过全面阻断TGF-β信号转导的抗纤维化疗法在纤维化肾病中得到了深入研究。阻断它的策略包括TGF-β中和抗体、反义寡脱氧核苷酸、可溶性人TβRII(sTβRII.Fc)和TGF-β受体特异性抑制剂(GW788388和IN-1130),可防止肾纤维化疾病动物模型的疾病进展[21-22]。更为重要的是,TGF-β抑制剂已应用于临床前和临床试验。例如,吡非尼酮(Pirfenidone)通过阻断TGF-β1启动子,恢复糖尿病肾病或局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)患者的估计肾小球滤过率(estimated glomerular filtration rate,eGFR)[23-24]。但不幸的是,全身性抑制TGF-β信号破坏了其抗炎和抗肿瘤发生的特性,TGF-β全身性靶向治疗已失败。例如,一项随机、双盲、Ⅱ期临床研究结果表明,TGF-β1特异性人源化中和单克隆抗体未能阻止糖尿病肾病的进展[25]。因此,靶向肾纤维化组织的TGF-β1阻断治疗越来越受到研发人员的重视。
在本次研究中,我们采用外泌体递送Adeno-TGF-β1-shRNA的方式,首先检测并明确了外泌体对UUO大鼠纤维化肾组织的靶向性,随后通过对外泌体治疗UUO大鼠的疗效观察,发现外泌体递送Adeno-TGF-β1-shRNA的确能够缓解大鼠肾脏纤维化的疾病进展,并且是以降低TGF-β1表达和Smad 3磷酸化的方式进行的。本次研究还有许多不足之处,例如如何令hucMSCs在大鼠体内稳定定植并持续表达Adeno-TGF-β1-shRNA,对大鼠的肾纤维化进行持续的干预,这在临床大规模应用方面是十分重要的,但此方向的研究还未开展。总之,本次研究将脐带间充质干细胞来源的含有腺病毒-TGF-β1-shRNA的外泌体尾静脉注射至单侧输尿管梗阻大鼠体内,外泌体能够特异性靶向纤维化的肾组织并通过抑制TGF-β1/Smad 3通路修复肾间质纤维化。