核果类果树种子休眠的机制及其解除方法研究进展
韦丹丹,刘鑫,包维楷
(1中国科学院山地生态恢复与生物资源利用重点实验室,生态恢复与多样性保育四川省重点实验室,中国科学院成都生物研究所,四川 成都 610041; 2中国科学院大学,北京 100049)
核果类果树植物多为落叶乔木或灌木,种类众多,野生种类约200种,栽培品种达10 000种以上,主要分布于温带气候区[1]。近200年来,由于分类系统的不同,各国学者对核果植物一直持有2种不同的分类观点,即广义李属与狭义李属。持有广义李属分类观点的植物学家认为桃、李、杏、梅、樱、稠李的花结构差异不大,应为同属。而支持狭义李属的植物学家根据物种间芽排列、花序、果实等方面的差异,按照植物演化发展阶段的高低将核果类果树分为6属,依次为桃属(Amygdalus)、杏属(Armeniaca)、李属(Prunus)、樱属(Cerasus)、稠李属(Padus)、桂樱属(Laurocerasus),隶属于蔷薇科李亚科(Prunoideae)[2]。 目前广义李属分类受到国内外学者的广泛认可,但其分类范围、属下类群分类处理差异、部分种的分类仍存在争议[3]。随着分子系统学的发展,学者们基于花器官形态特征将广义李属分为落叶单花类群、落叶伞形花序类群以及总状花序类群,系统发育关系显示这些类群为单系群,但类群内部的属及亚属的单系性尚未解决[4-5]。如部分学者认为在总状花序类群中,稠李亚属和桂樱亚属均不构成单系,而近期国内学者分别利用转录组数据与叶绿体基因组数据构建了蔷薇科的系统发育框架,认为除扁核木属外,其他李属成员均形成单系[6-7]。叶脉序列、分子系统学及花器官形态研究结果均支持将矮樱类从樱亚属中分出,以矮樱组的形式归于李亚属下[3,8-9]。
核果类果树兼具良好的观赏价值、经济价值与生态价值,其花色优美、果实香甜可口、种子富含油脂、营养价值高,是享誉世界的园林绿化树种、经济树种及木本油料作物;其根系发达、生态适应性强,是涵养水源、防风固沙的优良树种[10-12]。然而,核果类种子休眠程度较深,导致萌发育种难度增大,因此深入揭示核果类果树的种子休眠机制及萌发特性,是核果植物资源充分保护与利用的关键[13]。目前有关核果种子休眠机制尚未有全面系统的认识,不同种子休眠程度、休眠解除方式存在较大的差异性,即使是同一种种子,不同研究者对其休眠机制及打破方法均有不同的看法,系统揭示核果休眠机制与解除方法对种子繁育技术的优化具有重要的实践意义。因此,本研究聚焦核果类果树种子休眠规律及其解除方法,系统地归纳阐述已有认识,以期为核果类果树繁育技术的研发提供科学依据。
1 核果类果树种子的休眠机制
核果果树种子的休眠机制可归于2大类:内源因素与外源因素。内源因素是指因种胚引起的休眠,主要受萌发抑制物的调控;外源因素由种胚以外的结构引起的休眠,即果皮、种皮、子叶的机械阻碍与萌发抑制物等。
1.1 果肉(Pulp)对种子萌发的影响
多种研究表明,核果类植物果肉中含有高浓度的萌发抑制物,如Chen 等人在成熟的钟花樱桃(Cerasuscampanulata)果肉中检测出脱落酸(ABA)的存在,其含量为35.76 ng/粒,约占果实总ABA含量的76%[14]。Chen等人在秃叶黄檗(Phellodendronchinensevar.glabriusculum)新鲜果肉中检测出ABA浓度高达3 160 ng/g DW,ng/g DW(表示每克干物质组织中ABA的含量)约是新鲜种子内部ABA浓度的24倍,其内部赤霉素(GAs)种类较少且含量较低,其中GA4仅为2.45 ng/g DW,GA20为2.28 ng/g DW[15]。但上述研究均未涉及果肉保留对种子萌发影响的相关实验,因此无法解释果肉中高浓度的ABA是否抑制了种子萌发。安瑞丽和方海涛先后发现,长柄扁桃(Amygdaluspedunculata)果肉浸提液具有抑制小麦种子萌发及叶绿素合成的作用,间接表明果肉中的萌发抑制物具有抑制种子萌发的作用[16]。
目前在种子生态学研究中,人们对核果果肉与种子休眠间联系的关注度较低,果肉与种子休眠间还有许多问题尚未弄清。例如在果肉消失的过程中,其内部高浓度的ABA是否影响种子的休眠,微生物的作用、内源激素的变化是否与种子的休眠存在联系也尚未可知,因此果肉对种子休眠与萌发的作用机制值得深入探讨。
1.2 内果皮(Endocarp)对种子萌发的制约
核果类果树种子进化出坚硬致密的内果皮(种壳),对种子起到良好的保护作用,但也阻碍了种子的萌发。Chen 等发现钟花樱桃完整种子无法发芽,去壳后种子发芽率可提高25%[14]。张檀等研究也表明,随着内果皮机械破碎程度的增大,蒙古扁桃(Amygdalusmongolica)种子发芽率由15%提高至90%,说明种壳是阻碍萌发的重要因素[17]。Afroze and Reilly发现在相同处理下,黑刺李(Prunusspinosa)种子的内果皮越厚,发芽率越低(39%~52%);Chen 等进一步发现钟花樱桃种壳平均厚度1.03 mm,种子萌发效果较差(发芽率<31%)[14]。表明内果皮对种子萌发的阻碍存在差异,其中内果皮厚度是核果种子物理休眠的关键。
内果皮对种子萌发的物理阻碍主要归因于其对吸水率、透气性的限制。在长柄扁桃、野生欧洲李(Prunusdomestica)中均发现去壳种子吸水速率高于带壳种子的现象,说明核果种子内果皮具有透水性,但阻碍种子吸水速率[17-19]。陶俊、Jaganathan等分别在桃(Amygdaluspersica)、杏(Prunusarmeniaca)种子萌发研究中发现,只要给予足够的浸泡时间软化种皮,满足吸胀的先决条件,种子便能萌发,说明内果皮透水性不是影响核果种子萌发的主要原因[20-21]。王志梅发现,欧李(Cerasushumilis)种子形成初期,去壳种子呼吸强度明显大于带壳种子,表明内果皮对种子透气性造成一定的阻碍,但尚未发现内果皮透气性是阻碍种子萌发主要原因的直接证据[22]。
除了对透性造成物理阻碍外,核果种子内果皮中检测出高浓度的萌发抑制物,如方海涛利用小麦种子测定蒙古扁桃种子不同部位粗提取物的生物活性,发现种皮浸提液对小麦根、芽的生长均产生抑制作用,且溶于乙醚的抑制物活性大于水溶性抑制物,间接表明种子中可能含有多种内源抑制物[23]。在野生樱桃李(Prunuscerasifera)、新疆野杏(Armeniacavulgaris)中均发现ABA是内果皮中重要的萌发抑制物,去除内果皮可有效促进种子萌发[24-25]。Chen等测定钟花樱桃种子中各部位ABA含量,发现内果皮ABA含量高达6.66 ng/粒,是种皮的2.3倍,种胚的4.2倍,与完整种子(0%)相比,去壳种子发芽率提高25%[14]。核桃为拟核果,其种壳提取液中含有较高浓度的水溶性多酚、黄酮类物质,对植物种子萌发产生抑制作用[26]。以上研究均表明,内果皮中高浓度的萌发抑制物也是阻碍萌发的主要原因,且不同种子内果皮萌发抑制物含量大小存在差异。
综上所述,内果皮是核果类果树种子休眠的重要因素,它通过阻碍透水透气、内源萌发抑制物的作用促进种子休眠,但萌发抑制物的影响条件、作用机制有待深入探讨。
1.3 种皮(Seed coat)对种子萌发的制约
已有研究表明,除了果肉、内果皮外,种皮也对种子萌发产生制约作用,如李会芳在探究樱桃李种子萌发的影响因素时发现,樱桃李完整种子(0%)与去壳种子(2%)间的发芽率无明显差异,但去皮种子发芽率提高至78%[24]。Jansen and Kristiansen发现,未经低温处理的酸樱桃种子,去掉种皮后在20 ℃培养条件下发芽率达50%以上[27]。此外,在李(Prunusdomestica)、钟花樱桃、桃、高盆樱桃(Prunuscerasoides)、东京樱桃(Cerasus×yedoensis)等多种核果种子中也发现去除种皮可以有效促进种子萌发[13-14,28-31]。
大量研究证明,种皮机械阻力有限,内源萌发抑制物是阻碍核果种子萌发的主要原因[14,23,25,29]。早期,研究人员在LoveⅡ桃种子中发现,种皮中高浓度的ABA是阻碍种子萌发的主要因素[32]。随后郑然在山桃(Amygdalusdavidiana)新鲜种子中发现,种皮中ABA含量为690.07 ng/g FW(每克鲜物质组织中ABA的含量),去除胚根处种皮后发芽率为26%,完全去皮后提高至40%[33]。Chen等在钟花樱桃种皮中检测出ABA含量为2.850 ng/粒,并发现去皮后种胚发芽率提高,发芽周期缩短[14]。说明不同核果种子中种皮抑制物含量存在差异,去除种皮可同时解除种皮的物理阻碍与生物阻碍,利于种子萌发。但在生产实践上,大批量去除种皮难度较大,且种皮去除后,种子极易受细菌侵染霉坏变质造成损失,机械去除种皮实用性有限[18,23,34]。综上所述,种皮对种子萌发的阻碍主要受其内部高浓度的萌发抑制物调控,但萌发抑制物的作用含量、作用机制有待进一步的探究。
1.4 种胚(Embryo)对种子萌发的制约
除了部分早熟栽培品种具有形态休眠外,多数核果类果树种子具有生理休眠的特征,即种胚形态成熟、发育完全,但需要经历一段时间的低温刺激才能萌发[35-36]。郑然等曾报道,山桃种胚中ABA含量为303.32 ng/g FW,去皮后种胚萌发率仅为40%,说明胚中的ABA对萌发造成了阻碍, 种胚中的萌发抑制物,是导致种子生理休眠的重要原因[36]。
子叶与胚轴中的ABA是阻碍胚根伸长的主要原因,从子叶中分离胚可以解除种子胚休眠,如山桃种胚发芽率为40%,去除子叶后胚可完全萌发[33]。在欧洲酸樱桃(Prunuscerasus)、桃、杏种子中也发现,切除掉部分子叶可有效降低萌发抑制物含量,提高发芽率,缩短萌发时间,但去除子叶的同时也带走了一部分的营养物质,导致幼苗出现发育不良,植株矮小等现象[27,37]。Bonamy and Dennis曾报道,栽培桃品种“Halford”胚轴中ABA含量是种皮和子叶的10~100倍,并认为胚轴中高浓度的ABA与胚生理休眠存在一定的联系[38]。Pawasut等在探讨低温处理下3种观赏桃品种的ABA含量变化发现,在经历低温处理后,“Kanpaku”桃发芽效果不理想,其种胚中的ABA含量上升至1.2 ng,达内部ABA含量的51%,胚轴中的ABA可能是阻碍萌发的主要原因[13]。综上,子叶与胚轴中高浓度的萌发抑制物可能是诱导种胚生理休眠的重要原因,但其作用机制尚未清楚。
1.5 激素对种子休眠与萌发状态的调控
种子休眠、萌发过程与植物各种内源激素的相互作用息息相关。目前,已从多种植物果实、种子中分离出脱落酸、有机酸、酚类、醛类、不饱和内脂类、芳香油、气体物质、芥子油、生物碱等多种抑制物,而内源激素被认为是诱导种子休眠众多因子中最重要的因素。核果种子中抑制物的种类尚未研究透彻,其中ABA是已确定的主要内源激素之一,存在于果肉、内果皮、内种皮、胚等各结构中,各部位的ABA可能对抑制萌发起到了叠加的作用。种子休眠的诱导和解除与内部ABA/GAs有关,主要受环境条件和内源信号的共同调节。
ABA是调控种子休眠与萌发过程中最关键的植物激素。在高等植物中, 9-顺式-环氧类胡萝卜素双氧酶(NCED)是ABA合成过程的关键物质,在拟南芥中已确定了9种相关序列,但目前仅发现AtNCED5、AtNCED6、AtNCED9这3种基因序列影响种子休眠与萌发[39]。由CYP707A编码的ABA 8’-羟化酶是调控ABA代谢的关键蛋白,其中AtCYP707A1主要在种子成熟中期时的种皮和胚乳中表达,而AtCYP707A2则主要在种子成熟后期的种皮、胚、胚乳中表达[40]。桃种子休眠主要受PpNCED1和PpNCED2这2个关键基因的诱导,并通过上调CYP707As基因家族(PpCYP707A2、PpCYP707A3)的表达终止该过程,从而调控种子的休眠与萌发[41]。一般认为GAs与ABA在种子休眠与萌发的过程中起拮抗作用,有研究发现,GA3浸种、低温层积等处理均可使桃种子内部与ABA合成相关的基因下调,ABA合成减少;但尚未发现GAs处理后种子中ABA被分解代谢的分子机制的相关报道,因此GA3可能通过调节ABA合成调节种子休眠状态[41-42]。
外界环境变化引起种子休眠程度的改变也与内部激素密切相关。随着环境因子的季节性变化,核果类果树种子感知环境刺激,将外部信号转化为内部信号,诱导二次休眠或循环休眠的产生[36]。如Stephen等发现,欧洲樱桃种子进入二次休眠后,与ABA不敏感的2类相关基因Pa-PP2C1和Pa-ABI3停止表达,但这2类基因出现在初级休眠种子的胚轴中[43]。表明外部环境因子通过影响种子内部激素相关基因的表达,调控种子的休眠状态,且种子初级休眠与二次休眠具有不同的调控机制。不同核果种子进入二次休眠的诱发条件不同,如外界温度的周期性波动是诱导黑刺李、欧洲甜樱桃(Cerasusavium)种子进入二次休眠的主要原因,而光照、湿度、盐碱胁迫造成的低渗透势等可改变蒙古扁桃种子的休眠程度[18,44-45]。如图1所示,为了探究环境因子、GAs、ABA的变化与种子休眠程度间的关系,研究人员利用拟南芥(Arabidopsisthaliana)作为研究对象,发现参与此过程的基因主要与ABA、GAs代谢及信号通路有关,ABA/GAs平衡类似中心集合点,其下游调控种子休眠萌发的基因已被大量识别,但上游响应环境因子变化的相关基因信号尚不清楚,这是了解三者间作用机制的关键[46-48]。核果种子二次休眠的产生机制及诱导因素较为复杂,相关研究较少,仍需进行深入探究。

注:环境因子调控ABA-GAs平衡影响种子休眠状态的模型。图1 环境因子调控ABA-GAs平衡影响种子休眠状态的模型Figure 1 Model for environmental factors on regulating ABA-GAs balance on seed dormancy state
除ABA与GAs外,细胞分裂素(CK)、玉米素核苷(ZR)、萘乙酸(NAA)、吲哚乙酸(IAA)、乙烯类等多种激素也都可通过影响ABA/GAs的平衡,间接参与休眠与萌发的调控过程[49-50]。在大叶朴(Celtiskoraiensis)、金丝李(Garciniapaucinervis)等核果种子萌发过程中均发现GAs、CK、IAA含量逐渐增加,ABA含量下降的现象[51-52]。山桃在经过16周低温处理的过程中,种皮与种胚中ABA含量分别从690.07 ng/g FW、330.32 ng/g FW下降至183.70 ng/g FW、91.15 ng/g FW,而胚轴中IAA含量上升近200倍,也说明种子休眠与萌发的实质,是多种促萌发激素与促休眠激素间相互作用的结果[33]。
2 核果类果树种子休眠的解除
李属核果种子综合休眠的特征主要受种皮机械阻力、物理障碍、各部位萌发抑制物等多种因素的共同作用,解除种子休眠,需要从以下几个方面入手。对于休眠程度浅的种子,去除种皮或低温层积后便可萌发,而休眠程度较深的种子,则需要同时突破种皮与胚的双重阻碍才可获得较好的发芽效果(表1)。
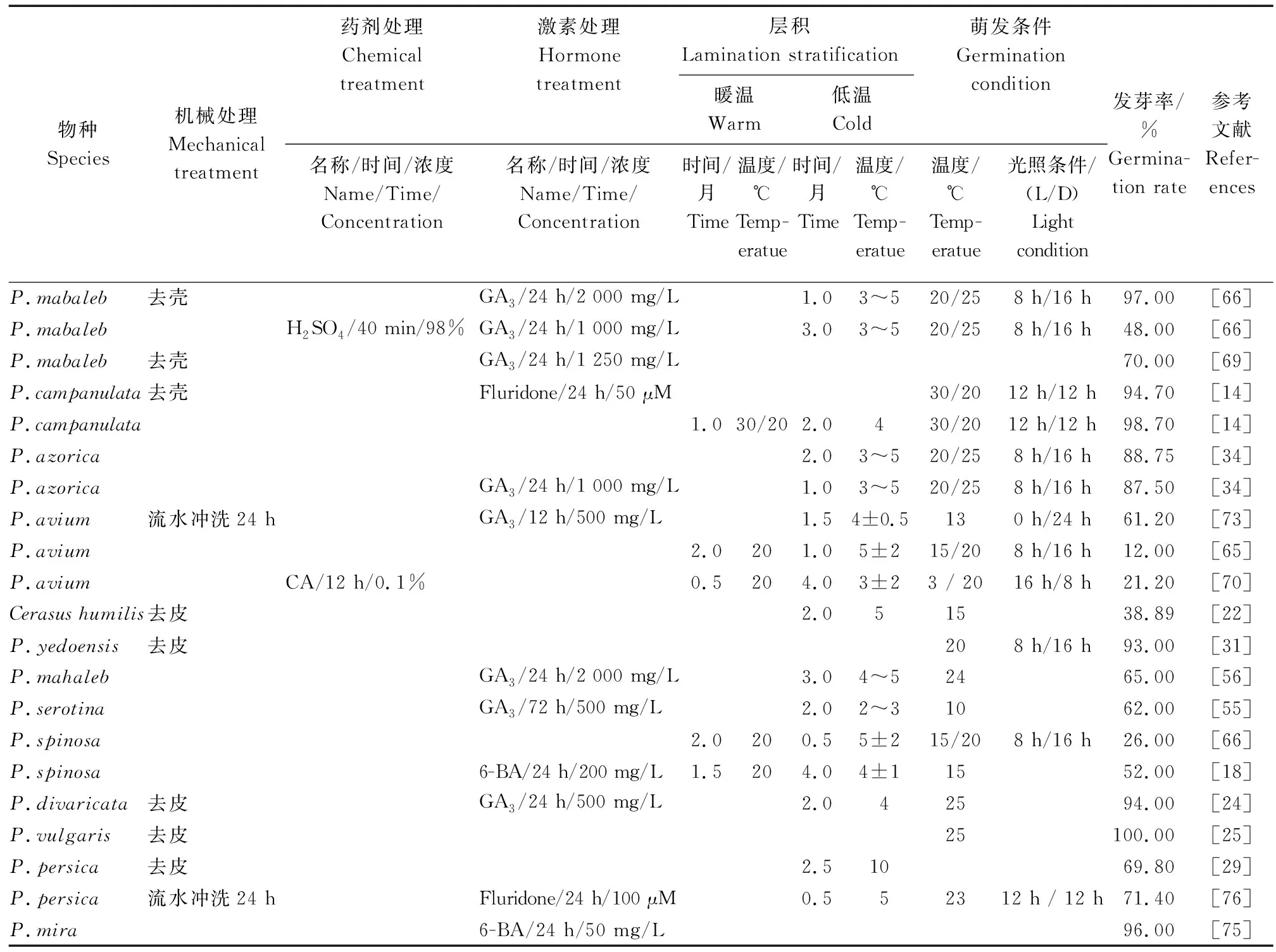
表1 不同核果种子解除休眠的最佳处理方案Table 1 Optimal treatments to release seed dormancy in different drupes
2.1 种皮休眠的解除方法及其效果
核果种子种皮由内果皮(种壳)与内种皮构成,常用机械破核、强酸或强碱浸种、热水浸种、液氮浸种等处理方式解除种子机械休眠,但不同物种间处理效果具有较大差异。
核果类植物种子内果皮与种皮具有致密的包裹结构,阻碍种胚的向外扩展,抑制种子萌发,因此机械破核是快速解除此类种子物理休眠的有效方式。完整的东京樱花种子在变温层积的预处理下并未萌发,但机械去除内果皮与种皮后,种子萌发率高达90%,而完整的高盆樱桃种子在机械去除种皮后,萌发率可达70%~100%[30-31]。除樱桃外,机械去壳在促进长柄扁桃、野生杏(Prunusscoparia,P.communis,P.haussknechtii)种子萌发中均获得较好的效果[53-54]。但机械破核成本较高,且易对种子造成损坏,不适用于核果类植物种子大规模苗木繁育。
浓硫酸浸种是生产上解除种子物理休眠的常用方式,强酸腐蚀在部分解除种皮机械阻碍的同时起到杀菌作用,利于种子的无菌萌发。浓硫酸处理效果与种子类型、处理浓度、处理时间等因素有关。Pipinis等人的研究表明,浓硫酸(95%~97%)浸种可有效解除Prunusazorica种壳的机械阻碍,但随着处理时间的增加(45~180 min),种子发芽率不断下降(27%~8%)[34]。张檀等在探究不同处理对长柄扁桃萌发的影响时也发现,浓硫酸浸种4 h时发芽率最高(30%),而浸种5 h无种子萌发[17]。说明浓硫酸处理在不同种子间具有较大差异性,且催芽效果与处理时间有关。但浓硫酸浸种对钟花樱桃、野黑樱桃(Prunusserotina)、马哈利樱桃(Cerasusmahaleb)、高盆樱桃、东京樱花等多种核果种子萌发无明显促进作用(发芽率<5%),说明种皮的机械屏障可能不是引起此类种子休眠的主要因素[14,30-31,55-56]。因此应根据种子物理特性,合理选择浸种药剂,控制浸种时间,以获得更好的催芽效果。
热水浸种主要通过热胀冷缩的原理,增大缝合线的孔隙,从而增加种皮透性,促进种子萌发[13]。热水浸种在多种豆科种子休眠解除的研究中已被证实有效,对杏、长柄扁桃等核果种子休眠解除也有一定的促进作用,如长柄扁桃采用连续重复3次80 ℃热水浸泡再速冻处理,冷窖储存待播的方式,种子出苗率最高(49%)[21,58]。但热水浸种对马哈利樱桃、高盆樱桃、东京樱花等多中核果种子发芽率无明显促进作用[30-31,56]。如马哈利樱桃种子90 ℃热水处理30 min后冷水浸泡,种子发芽率仅为5%[56]。不同催芽效果的出现可能与种皮厚度、致密性大小等物理性质有关。
液氮浸种利用剧烈温差使种壳表面形成裂痕,从而减少机械阻力,促进种子萌发[58-59]。液氮浸种对种子萌发的促进作用与种子含水量有关,如液氮浸种对高含水率(24%)的东京樱花种子无明显的萌发促进作用,而使低含水率(10%)的种子萌发率提高至63%[31]。在欧洲甜樱桃中也发现,在9%~16.9%的含水率区间内,液氮超低温保存能有效保持种子活力,而含水率高于17%无种子萌发[58]。Wawrzyniak在对6种欧洲野生木本植物种子中也发现类似的现象,并认为种子耐干燥及低温能力与其生理休眠程度有关[60]。
2.2 低温层积法解除休眠及其效果
低温层积是解除种子生理休眠最传统的处理方式,层积过程降低ABA/GAs值,从而诱导种子萌发。低温层积后山桃种子中游离ABA含量从每粒种子20.4 ng下降至2.2 ng,发芽率提高至36.7%[33]。相较于切除种皮、子叶等处理方式,低温层积保存了种子的完整性,给予种胚足够的生长发育时间,有利于后期幼苗的生长。
种子萌发效果与层积时间、层积温度有关。一般认为,0~10 ℃层积1至4个月是核果种子打破休眠的有效层积方式,但不同品种最适层积温度、时间存在明显差异[61]。欧洲稠李(Prunuspadus)种子休眠状态解除的最适层积时间为3至4个月[62]。“Sharbati”桃种子在7~10 ℃条件下层积60 d后,种子发芽率达63%~70%[21]。而桃、杏种子分别在4~5 ℃层积90 d后去除种皮,发芽率可达到96%和100%[51]。核果种子具有最适层积时间,层积时间过短或过长均不利于种子的萌发。如P.africana在4 ℃条件下层积1个月后,发芽率为91.7%,超过4个月后无种子萌发[63]。
层积基质也会对种子萌发造成一定的影响,层积基质有利于加速内果皮的降解及萌发抑制物的浸出,从而促进种子萌发。杜纪红比较不同层积基质对桃种子萌发率的影响,发现珍珠岩效果最好(萌发率97%),蛭石次之(90%),河沙(79%)与泥炭(76%)相近,并认为珍珠岩在重量、吸湿透气性能均有较大的优势,是较为理想的基质材料[64]。马哈利樱桃种子在泥炭藓与珍珠岩混合的基质条件下具有较好的发芽效果(65%)[56]。但Afroze and Reilly发现,在泥炭土、珍珠岩、种子体积比为1∶1∶1的层积基质条件下, 黑刺李种子发芽率仅为12%,而无层积基质的种子发芽率为30%,基质的存在反而促进黑刺李种子的变质,降低发芽速率[18]。说明层积基质的材料、组分配比同样影响种子的萌发。
2.3 综合法解除休眠及其效果
层积有利于打破种子各结构中萌发促进物质与抑制物质之间平衡,完成种胚生理后熟,促进胚根伸长,削弱种壳的机械阻力[65-66]。但研究表明,单纯层积处理对多种核果种子的催芽效果有限,如欧洲甜樱桃、东京樱花、黑刺李种子在4~5 ℃低温条件下层积2至6个月,发芽率仍低于5%[30-31,67]。因此对于休眠程度较深的种子,多种处理方法的结合可加快休眠解除进程,获得更好的催芽效果。如Pipinis等将去除内果皮的马哈利樱桃种子置于1 000/2 000 mg/L的GA3溶液中浸泡24 h后,再进行30 d低温层积,种子发芽率提高至95%~97%[68]。桃、杏种子分别进行60 d、90 d的5 ℃低温层积后再去除种皮,置于20 ℃条件下培养,发芽率可达96%与100%,且后续幼苗生长状况最好,表明同时去除种皮与种胚的萌发障碍,种子具有更好的发芽效果[37]。在欧洲甜樱桃、欧洲李、黑刺李、马哈利樱桃、黑樱桃(Cerasusmaximowiczii,Prunusazorica)等多种核果种子中发现,变温层积处理比单独的低温或暖温处理对种子萌发及后续幼苗生长的促进作用更为明显,表明变温层积对核果种子休眠解除效果更好[28,43,66-71]。综上所述,核果植物种子休眠是复杂的过程,需要根据休眠类型、休眠深度对层积方式进行综合研究,以适应种间差异。
2.4 内源萌发抑制物的解除方法及其效果
核果类种子休眠的深度休眠与种子内部的萌发抑制物含量有关,可通过流水冲洗、施加外源激素等方式,打破种子内源ABA与GAs间的平衡,解除休眠。
流水冲洗主要通过软化种皮,稀释萌发抑制物浓度,起到解除休眠的作用。吉九平曾报道,淋洗2周的毛桃、山桃种子中游离ABA含量分别下降至158 ng/g与108 ng/g,与层积10周后种子内游离ABA含量水平接近[73]。Pawasut等人也发现,与低温处理相比,流水冲洗处理的桃种子ABA损失率更高[13]。表明萌发抑制物具有水溶性,淋洗能有效降低ABA含量。Javanmard等发现欧洲甜樱桃流水冲洗24 h后,种子发芽率从0提升至26.5%,发芽时间明显缩短[74]。以上现象表明,具有可渗透性种皮的种子,若给予合适的冲洗时间,可促进种子萌发。但对于种壳较厚、休眠程度较深的种子,如东京樱花,流水冲洗对种子萌发的促进作用不显著[31]。
外源施用赤霉酸可解除生理休眠、热休眠和光休眠等,并能在一定程度上替代低温层积对种子萌发的促进作用,但其作用效果与物种休眠类型、内部GAs含量有关。与单独施加GA3或低温层积相比,赤霉素结合低温层积处理,可以有效的提高核果类种子的萌发率。如东京樱花种子去皮后,置于1 000 mg/L的GA3浸种并充分震荡,种子发芽率可高达97%[31]。野黑樱桃种子GA3浸种结合21~24周的低温处理,可达到最高发芽率(62%)[14]。马哈利樱桃解除休眠的最佳处理方式为60~90 d的低温层积结合1 000 mg/L的GA3溶液浸种[56]。除GA3以外,氟洛酮(Fluridone)、萘乙酸(NAA)、6-BA、乙烯利等对解除萌发抑制物导致的休眠均可产生一定的作用。NAA、6-BA与ABA产生拮抗作用,外源施加可有效提高黑刺李、光核桃(Amygdalusmira)种子的发芽率,缩短发芽时间[18,75]。Fluridone是一种类胡萝卜素生物合成抑制剂,通过阻碍ABA相关基因的表达起到降低ABA含量的作用,如Kanjana等人就曾报道,Fluridone可通过影响NCED1、ABA8′-hydroxylase3、LeMADS、LEAD-34这4种基因的表达,改变ABA合成量及生理代谢,促进桃种子萌发[77]。
3 展望
种子休眠是植物应对外界环境周期性变化的适应性进化,有利于种群遗传物质的保存与延续。核果植物种子结构复杂,通常兼具综合性休眠的特征,主要与各部位的萌发抑制物、内果皮与种皮的机械阻力、胚生理后熟有关。不同核果种子性状特征、休眠类型、休眠程度不同,种子解除休眠的方法各异。目前常用的破眠方法主要包括机械破核、 酸碱或强氧化剂腐蚀种壳、生长调节剂处理等。这些处理在理想的实验室条件下均获得较好的催芽效果,但破眠成本较高,无法完全适用于复杂的野外试验条件。低温层积是目前核果种子野外催芽较为成熟有效处理方法,但其处理效果受种子类别、种子特性、层积环境条件、层积时间、层积基质等多方面因素的共同影响,无法确保种子获得稳定高效的发芽效果。综合处理提高种子发芽率是近年来研究人员关注的重点,但此类方法针对性较强,无法应用于所有种子。因此,针对不同种子物理化学特性,开发便捷高效的催芽技术,是目前核果类植物种子繁育的关键。
随着分子生物学研究的发展,科研人员发现核果植物种子内部ABA与GAs间的平衡是种子休眠与萌发的关键,此过程的分子调节机制较为复杂,涉及种子基本性状特征、环境因子、生物因子等多种因素,目前仍有许多问题需深入探究。首先,以往研究中果肉对种子休眠萌发的作用被忽视,在果肉消失的过程中,环境微生物作用可能通过影响激素含量变化从而调控种子休眠进程,因此果肉在种子休眠与萌发过程中的作用机制值得研究。其次,土壤种子库中的种子具有循环休眠的特性,其环境诱导因素及内部分子变化机制研究仍存在大量空白。再次,目前关于激素平衡对核果种子休眠与萌发的影响仍主要集中于ABA与GAs上,需扩展内源激素研究种类,探究种子休眠萌发过程中各内源激素间的相互作用机理。此外,自然变温是种子破眠的关键因素,而种子室内破眠试验无法完全模拟野外温度变化状况,导致研究结果无法真实反应种子萌发自然环境状况,因此应开展种子萌发原位观测试验。最后,目前人们对于分布范围广、经济价值高的品种关注较多,而野生资源品种研究较少,因此亟需扩展研究种类,充分认识核果类果树休眠与萌发特征,以便更好地进行资源保护、开发与利用。

