干旱胁迫下不同地理种源高山栲幼苗生理生化响应
毛晓佩,孙永玉,戚建华,王顺利,张春华
(1 西南林业大学 林学院,云南 昆明,650224;2 中国林业科学院高原林业研究所,云南 昆明,650233;3 国家林业局云南元谋荒漠生态系统定位研究站, 云南 昆明,650233)
高山栲(Castanopsisdelavayi)为壳斗科(Fagaceae)栲属(Castanopsis)常绿乔木树种,又名高山锥、白猪栗、滇锥栗等,是我国西南地区常绿阔叶林的主要优势种或常见种。主要分布在云南、四川和贵州海拔1 500~2 800 m的山地,在越南、缅甸、泰国亦有分布[1]。因其木材坚硬,是分布区域内主要的新碳林树种及天麻优良种植原材料。随着经济的发展,生产力的快速增长,人类频繁活动对自然环境的干扰不断增加,加之全球气候变暖、极端天气频繁发生以及水资源严重污染等生态问题日益凸显,加剧了干旱对环境的威胁。目前研究干旱胁迫对植物生理生化的影响成为植物生理生态学研究的热点问题之一[2-3]。有研究表明,植物在干旱胁迫下,不仅会在外观形态上表现出一系列的变化,而且也会在生理、生态特性方面产生响应,导致植物光合作用受抑、代谢异常、呼吸紊乱等,直接影响植物的生长发育和生存[4-5]。此外,植物体内会产生大量活性氧自由基,为了清除多余的自由基,植物会增加渗透调节物质和抗氧化酶活性来降低干旱条件造成的伤害[6]。高山栲被国家林业和草原局列入国家储备林建设树种,现有的研究主要集中在种子库、种群更新、种子保存、功能性状、群落多样性、种子性状等方面[7-12]。目前,干旱对高山栲生理生化指标的影响及抗旱性优良地理种源的筛选尚属空白,综合分析高山栲幼苗在不同干旱胁迫下生理生化和生长指标的动态变化,以期为高山栲抗旱种源筛选及人工林栽培提供理论依据。
1 材料与方法
1.1 试验材料
地理种源选择高山栲核心分布的宾川(BC)、剑川(JC)、云龙(YL)、鹤庆(HQ)、楚雄双柏(SB)等5个种源,按种质资源搜集方法,选取胸径大于80 cm,树干通直,无病虫害的植株作为采种母树,于2019年11月收集种子,除杂后在楚雄白依河国有林场进行1 年种苗培育。并于2020年11月选取大小基本一致,无病虫害的苗栽入花盆中修养4个月待恢复后取回移至昆明,试验用土取自白依河国有林场原生高山栲林下0~10 cm层土壤,饱和持水量33.5%。

表1 高山栲种源采集地基本信息Table 1 Information of Castanopsis delavayi provenance
1.2 试验方法
1.2.1 试验设计 试验地位于云南省昆明市中国林业科学院高原林业研究所苗圃地(E 102°45′,N 25°04′)。海拔1 891 m,年平均气温14.7 ℃,年均日照2 200 h左右,无霜期240 d以上,年降水量1 011.8 mm。本试验采用重量法,设置4个水平的持续性干旱处理,土壤相对含水量分别为土壤饱和持水量的的65%~75%(对照W1)、55%~65%(轻度干旱胁迫W2)、45%~55%(中度干旱胁迫W3)、35%~45%(重度干旱胁迫W4)。每3 d进行每盆衡重1次,使各处理的土壤含水量维持在设定范围内,处理时间为2021年4月至5月。采用随机区组试验设计,每个处理10株,重复3次。
1.2 2 测定指标与方法 干旱处理前后分别用卷尺(精度0.1 cm)和游标卡尺(精度0.01 mm)测量冠幅、株高和地径用于计算其苗木净生长量。研究采用硫代巴比妥酸法、愈创木酚法、高锰酸钾滴定法、酸性茚三酮比色法、蒽酮比色法分别测定高山栲叶片中丙二醛(MDA)含量,过氧化物酶(POD)活性,过氧化氢酶(CAT)活性,游离脯氨酸(Pro)含量,可溶性糖(SS)含量[13]。
1.3 数据处理与分析
数据采用Excel 2010和SPSS 23.0(IBM SPSS,USA,NY)进行统计分析及绘图,采用单因素方差分析不同处理间的差异。
以不同种源高山栲幼苗生长及生理生化指标测定数据为基础,按照模糊数学中隶属函数法综合评价不同地理种源高山栲幼苗对土壤干旱的适应能力[14]。
2 结果与分析
2.1 不同地理种源高山栲幼苗生长对干旱胁迫的响应
干旱胁迫对不同种源高山栲净生长量的影响,见表2。

表2 干旱胁迫对不同种源高山栲净生长量的影响Table 2 Effects of drought stress on net growth of Castanopsis delavayi in different provenances
由表2可知,随着干旱胁迫程度的增加,各地理种源株高、地径和冠幅等净生长量指标总体为下降趋势。在重度干旱胁迫下,云龙(YL)种源的株高生长量显著高于宾川(BC)种源,宾川(BC)种源的地径生长量显著高于鹤庆(HQ)种源,宾川(BC)种源的冠幅生长量显著高于剑川(JC)种源。相对于对照来看,宾川(BC)种源的株高生长量减幅最大(72.05%),云龙(YL)种源的株高和冠幅生长量减幅最小(47.56%、32.41%),虽然双柏(SB)种源地径下降较少(42.31%),但双柏(SB)种源的冠幅减幅最大(72.85%)。在重度干旱胁迫下,云龙(YL)种源的株高生长量处于最高水平(9.56 cm),比最低水平的宾川(BC)种源高出4.13 cm,且宾川(BC)种源的地径和冠幅生长量处于最大值(1.86 mm、8.98 cm)。方差分析表明,株高生长量除宾川(BC)种源的轻度干旱胁迫(W2)处理与对照差异不显著外,其余种源的株高生长量在各处理与对照(W1)差异显著(P<0.05);双柏(SB)和剑川(JC)种源3个干旱处理的冠幅生长量与对照存在显著差异(P<0.05),云龙(YL)和宾川(BC)种源的冠幅生长量在轻度干旱胁迫(W2)与对照(W1)间差异不显著,鹤庆(HQ)种源的冠幅生长量在对照(W1)与重度干旱胁迫(W4)处理下差异显著(P<0.05);除鹤庆(HQ)种源外,其余4个种源的地径生长量在中度和重度干旱胁迫处理与对照(W1)处理间差异显著。(P<0.05)。剑川(JC)种源的株高和冠幅生长量在中度和重度干旱胁迫下差异不显著。
2.2 不同地理种源高山栲幼苗MDA含量对干旱胁迫的响应
干旱胁迫对不同种源高山栲MDA含量的影响,见表3。
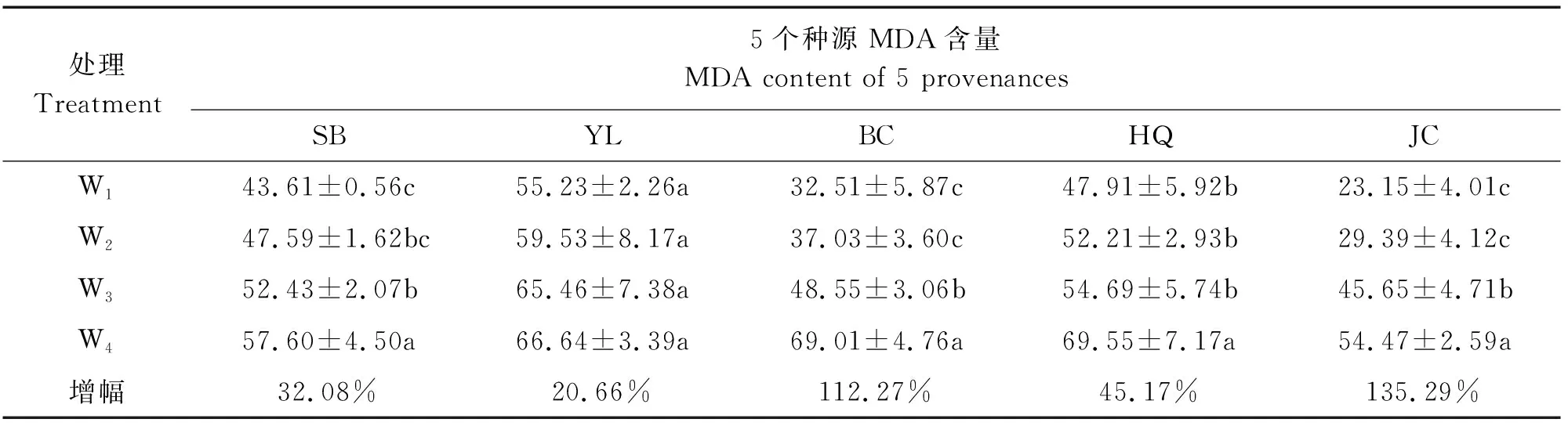
表3 干旱胁迫对不同种源高山栲MDA含量的影响Table 3 Effects of drought stress on MDA content of Castanopsis delavayi in different provenances
由表3可知,MDA含量随着干旱胁迫程度的增加而呈上升趋势,不同地理种源的MDA含量在不同干旱胁迫处理下的增幅存在差异,其中双柏(SB)和云龙(YL)种源的增幅比较平稳有规律,宾川(BC)、鹤庆(HQ)、剑川(JC)则增幅较大。在轻度干旱胁迫(W2)处理下,MDA的含量积累较缓慢,但随着干旱胁迫程度的增加,MDA含量也在不断积累,均在重度干旱胁迫(W4)处理下达到了最大值(54.47~69.55 nmol/g)。与对照(W1)相比较,在重度干旱胁迫下双柏(SB)、云龙(YL)、宾川(BC)、鹤庆(HQ)、剑川(JC)种源的MDA含量分别增加了32.08%、20.66%、112.27%、45.17%、135.29%。方差分析表明,除云龙(YL)和鹤庆(HQ)种源外,其余3个种源的MDA含量在中度和重度干旱胁迫下与对照(W1)差异显著(P<0.05),云龙(YL)种源的MDA含量在4个干旱处理间差异不显著。鹤庆(HQ)种源的MDA含量在重度干旱胁迫(W4)与对照(W1)差异显著(P<0.05)。
2.3 不同地理种源高山栲幼苗渗透物质对干旱胁迫的响应
干旱胁迫对不同种源高山栲渗透物质的影响,见表4。
由表4可知,不同地理种源高山栲苗木叶片中的脯氨酸含量随土壤相对含水率减少而表现出不同程度的增加趋势,5个种源均在重度干旱胁迫(W4)下达到最大值。相对于对照(W1)来看,脯氨酸含量增加最多的是云龙(YL)种源(257.69%),宾川(BC)种源最少(46.64%)。在重度干旱胁迫下,云龙(YL)地理种源的脯氨酸含量显著高于双柏(SB)和鹤庆(HQ)种源。方差分析表明:宾川(BC)、鹤庆(HQ)和剑川(JC)种源的可溶性糖含量在中度和重度干旱胁迫下与对照(W1)差异显著(P<0.05),云龙(YL)种源各干旱处理下的可溶性糖含量与对照差(W1)异显著(P<0.05),双柏(SB)种源的可溶性糖含量在各干旱处理与对照(W1)差异不显著。
高山栲幼苗叶片的可溶性糖含量随着干旱胁迫程度的加剧呈现上升的趋势,且在重度干旱胁迫下达到最大值。在重度干旱胁迫(W4)下可溶性糖含量与对照(W1)相比,增幅最大的是剑川(JC)种源(46.72%),最小的是双柏(SB)种源(12.35%)。在重度干旱胁迫(W4)下,鹤庆(HQ)种源的可溶性糖含量最高(55.62 mg/g),宾川(BC)种源最低(47.83 mg/g)。方差分析表明,除云龙(YL)种源外,其余4个种源的脯氨酸含量在中度和重度干旱胁迫下与对照(W1)差异显著(P<0.05),云龙(YL)种源的脯氨酸含量在各干旱处理与对照(W1)差异显著(P<0.05)。
2.4 不同地理种源高山栲幼苗酶活性对干旱胁迫的响应
干旱胁迫对不同种源高山栲渗透物质的影响,见表5。

表5 干旱胁迫对不同种源高山栲幼苗酶活性的影响Table 5 Effects of drought stress on enzyme activities of Castanopsis delavayi seedlings
由表5可知,POD活性随着干旱程度的增加而上升,中度干旱胁迫(W3)达最大值后随着干旱程度加剧而降低。相对于对照(W1),在中度干旱胁迫(W3)处理下POD活性分别增加了84.68%~465.80%。在重度干旱胁迫(W4)下,POD活性呈现一定幅度的下降,但显著高于对照(W1),其中宾川(BC)种源活性最高为150.66 △OD470/(min·g),高出对照(W1)222.89%,剑川(JC)种源的最低为99.00 △OD470/(min·g)。CAT活性的变化与POD活性的变化基本一致,但CAT活性在轻度干旱胁迫(W2)下达到最大值,较对照(W1)有24.18%~87.82%的增量。随干旱胁迫程度进一步加剧,CAT活性急剧下降,在重度干旱胁迫(W4)下达到最小值,但是宾川(BC)种源的CAT活性高于其余4个种源,相比对照减少了60.07%。方差分析表明,除剑川(JC)种源外,其余4个种源的POD活性在各干旱处理下与对照(W1)差异显著(P<0.05),剑川(JC)种源的POD活性在中度干旱胁迫(W3)与对照(W1)差异显著(P<0.05);5个种源的CAT活性在各干旱处理下与对照(W1)差异显著(P<0.05)。
2.5 不同地理种源抗旱性综合评价
2.5.1 土壤含水量与高山栲幼苗生长及生理生化指标的相关性 土壤含水量与高山栲幼苗生长及生理生化指标的相关性,见表6。

表6 土壤含水量与高山栲幼苗生长及生理生化的相关分析结果Table 6 Correlation between soil moisture content and seedling growth, physiology and biochemistry of Castanopsis delavayi
由表6可知,土壤含水量与高山栲株幼苗高生长量、POD活性呈极显著正相关,与CAT活性呈显著正相关;土壤含水量与高山栲幼苗可溶性糖、脯氨酸含量呈极显著负相关;土壤含水量与冠幅生长量、地径生长量、MDA含量相关不显著。脯氨酸含量与株高生长量极显著负相关,与可溶性糖含量呈显著正相关;CAT活性与可溶性糖含量呈显著正相关。
2.5.2 不同种源高山栲在重度干旱胁迫下抗旱性综合表现 不同种源高山栲在重度干旱胁迫下抗旱性综合表现,见表7。

表7 不同种源高山栲各指标隶属函数值及抗旱性综合评价Table 7 Membership function values of each index and comprehensive evaluation of drought resistance of Castanopsis delavayi in different provenances
由表7可知,不同地理种源在重度干旱胁迫条件下的生长、生理生化表现,通过隶属函数计算得到高山栲各地理种源在重度干旱胁迫下的综合表现值,以此得到各地理种源的抗旱性排序为:宾川(BC)>双柏(SB)>剑川(JC)>鹤庆(HQ)>云龙(YL)。
3 结论与讨论
3.1 讨论
3.1.1 不同干旱胁迫梯度下植物生长变化 土壤有效水分的亏缺,会对植物的生长状况产生显著影响,也会在形态、生理生化等方面作出一系列变化来适应不良的环境[15-16]。研究结果表明,不同地理种源高山栲苗木生物量净生长量随着干旱胁迫程度的加剧而减少,说明在干旱胁迫下高山栲幼苗可以通过减慢生长以适应不同干旱环境,这和植物在遭受干旱胁迫时可能会通过调节生长量来适应胁迫环境情况较为一致[17]。
3.1.2 不同干旱胁迫梯度下植物渗透物质的变化 在受到干旱胁迫时,植物通过渗透调节降低水势来减少水分的损耗以进行正常的生命活动[18]。脯氨酸是具较强水合力的水溶性氨基酸,在植物受到干旱胁迫时,会通过增加脯氨酸来帮助细胞持水,防止植物脱水,使植株在干旱环境中能吸收足够自由水维持正常生长发育[19]。本研究结果表明,随着干旱胁迫的加剧,脯氨酸含量呈上升的趋势,这与对江南油杉(Keteleeriacyclolepis)、多油辣木(Moringaoleifera)的研究结果一致[20-21]。在重度干旱胁迫(W4)处理下,5个地理种源植株的脯氨酸含量都急剧增加,这说明在重度干旱胁迫下,脯氨酸对降低渗透势、维持膨压的贡献较大,说明高山栲幼苗都通过积累脯氨酸来提高细胞的渗透调节能力而适应土壤干旱。
可溶性糖的积累也是反映抗旱性强弱的有效指标之一,植物在遇到干旱胁迫环境时可以通过提高细胞内可溶性糖的积累产生足够低渗透势以增强植物的保水和吸水能力[22-23]。随着干旱胁迫程度的增加,高山栲幼苗叶片可溶性糖含量随之增加,这与对赤皮青冈(Cyclobalanopsisgilva)在不同水分胁迫下的研究结果一致[23]。表明随着干旱胁迫程度的增加,高山栲幼苗通过增加可溶性糖含量来提高细胞内的浓度,进而减少细胞内外的浓度差,有助于保持植物体内的水分,这说明在干旱胁迫下高山栲幼苗可通过增加可溶性糖含量来增加对干旱环境的适应能力。
3.1.3 不同干旱胁迫梯度下植物MDA含量的变化 MDA是膜脂过氧化的产物之一,其含量的高低能够反应细胞膜脂过氧化作用强弱和质膜破坏程度[24]。本研究结果表明,随着干旱胁迫程度的增加,MDA含量增加,这与张文辉、熊仕发等人的研究结果一致,表明其膜系统受伤害的程度随着干旱胁迫的加剧而加重[25-27]。在轻度干旱胁迫(W2)下,各地理种源的MDA含量增长缓慢,可能是因为高山栲幼苗在受到胁迫时能够自我调节与保护,对其生物膜系统的伤害不大[28]。在中度(W3)和重度(W4)干旱胁迫下,剑川、宾川、双柏地理种源的MDA含量急剧增加,说明随着干旱胁迫程度的增加,叶片中积累了较多的活性氧,导致MDA含量的增加,对叶片的膜系统造成了不可逆的损伤。
3.1.4 不同干旱胁迫梯度下植物保护酶活性变化 CAT、POD是植物体内重要的抗氧化酶系统,在植物受到干旱胁迫时可以保持体内的代谢平衡[25]。本研究结果表明,随着干旱胁迫程度的增加,5个地理种源的POD活性、CAT活性表现出先升后降的趋势,这与大多数前人研究结果一致[25-26]。在W2、W3处理下,5个种源的CAT和POD酶活性达到了最大值,这表明在轻度和中度干旱胁迫下,POD、CAT协同作用清除活性氧的能力较强,能较好的维持细胞膜的稳定性,这可能是高山栲幼苗为了减轻细胞伤害而进行生理调节来适应干旱环境。随着胁迫程度的增加,5个地理种源的2种保护酶的活性出现了不同程度的下降,说明在重度干旱胁迫下,活性氧产生的速度超出了高山栲幼苗的耐受范围,其抗氧化能力在衰退,对其幼苗的生长造成伤害,这表明55%~65%和45%~55%的土壤含水量是高山栲苗木CAT和POD活性的最大耐受值。
3.2 结论
本研究发现,随着干旱胁迫程度的加剧,5个种源高山栲幼苗的株高、地径、冠幅净生长量降低,叶片中MDA、脯氨酸含量、可溶性糖的含量升高,CAT、POD 2种酶活性呈现先升后降的趋势,分别在W2、W3处理下达最大值。在重度干旱胁迫下,云龙(YL)种源的株高生长量处于最高水平(9.56 cm),比宾川(BC)种源高出4.13 cm,宾川(BC)种源的地径和冠幅生长量处于最大值(1.86 mm、8.98 cm),云龙(YL)种源的株高和冠幅生长量较对照减幅最少(47.56%、32.41%),双柏(SB)种源地径较对照下降较少(42.31%);剑川种源的MDA含量和可溶性糖含量较对照增加最多(135.29%、46.72%),脯氨酸含量增加最多的是云龙(YL)种源(257.69%);宾川(BC)种源的POD、CAT活性均处于最高水平(150.66 [△OD470/(min·g)]、493.58 [μmol/(min·g)],POD相比对照增加了222.89%,CAT相比对照减少了60.07%。综合其生长、生理生化和酶活性来看,不同地理种源的高山栲抗旱能力有着一定的差异,抗旱能力由大到小依次为:宾川(BC)、双柏(SB)、剑川(JC)、鹤庆(HQ)、云龙(YL)。

