柱前衍生HPLC法测定硫酸阿米卡星及其制剂中基因毒性杂质肼的研究
姚永青 杜斌
(1 郑州大学,郑州 450001;2 河南省食品药品检验所,郑州 450018)
硫酸阿米卡星为半合成氨基糖苷类抗生素[1-2],1957年HamaoUmezawa发现,1972年日本Bristol公司研究成功,我国1981年开始生产。硫酸阿米卡星属静止期杀菌剂,适用于铜绿假单胞菌等敏感革兰阴性杆菌与葡萄球菌属(甲氧西林敏感株)所致严重感染,尤其适用于治疗革兰阴性杆菌对卡那霉素、庆大霉素或妥布霉素耐药菌株所致的严重感染,其制剂为注射剂,为国家基本药物目录收载品种,在临床中应用广泛。
基因毒性杂质是指对DNA具有直接或间接的破坏性,产生基因突变或体内诱变,而具有致癌可能或者倾向的杂质,其毒性很强,常常在很低的含量或浓度水平下,即可对人体造成遗传物质的损伤,进而导致基因突变促使肿瘤的发生[3-4]。阿米卡星为卡那霉素等经硅烷化、酯化、酰化、水解、肼解反应后纯化制得,在酰化产物水解液的肼解反应中使用了水合肼,肼具有基因毒性结构,是一种已知的基因毒性杂质,具有潜在的致癌性,肼主要通过代谢活化生成碳正离子和碳氧自由基等活性较强的中间体,与DNA发生烷基化反应或导致DNA其他病变[5-6]。ICH M7指出肼在体内和体外均具有致突变性和遗传毒性,肼被IARC(国际癌症研究机构)列为2B类,对人类可能致癌,EPA(环境保护局)认为肼是B2类致癌物或人类可能的致癌物质。
本研究选取国内硫酸阿米卡星原料及制剂和参比制剂,参考相关文献[7-9]建立柱前衍生HPLC法对硫酸阿米卡星及其制剂中的肼进行检测,同时可为其他药物中肼的控制提供参考。
1 仪器与试药
1.1 仪器与试剂
1260高效液相色谱仪(Agilent);XPE205电子天平(Mettler Toledo仪器上海有限公司)。
甲酸、苯甲醛、甲醇及乙腈均为色谱纯,水为Mill-Q去离子水。
1.2 样品
硫酸肼(批号W06E026,质量分数99.0%)购自Alfa Aesar公司。硫酸阿米卡星6批次,来自国内3家企业(A、B、C);国内硫酸阿米卡星注射液9批次,规格2 mL:200 mg,来自国内3家企业(D、E、F);国内注射用硫酸阿米卡星8批次,规格200 mg,来自国内3家生产企业(E、G、H);硫酸阿米卡星注射液和注射用硫酸阿米卡星参比制剂各1批次,均购自日本Nichiiko Pharmaceutical Co.Ltd。
2 试验方法
2.1 色谱条件
色谱柱:Agilent Zobax Eclipse XDB-C18色谱柱(2.1 mm×150 mm,5 μm );流动相A为0.1%甲酸溶液,流动相B为乙腈,按表1进行线性梯度洗脱;流速1.0 mL/min;DAD紫外检测器,检测波长为300 nm,柱温为25℃,进样量20 μL。

表1 线性梯度洗脱程序Tab.1 Linear gradient elution program
2.2 溶液的配制
2.2.1 苯甲醛溶液
取苯甲醛5 mL,用甲醇稀释至100 mL,即得。
2.2.2 空白溶液
精密量取水1 mL,置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过,即得。
2.2.3 空白辅料溶液
精密称取处方量辅料,置20 mL量瓶中,用水溶解并稀释至刻度,摇匀,滤过。精密量取续滤液1 mL,置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过,即得。
2.2.4 肼系列标准溶液
精密称取硫酸肼0.1030 g,置100 mL容量瓶中,用水溶解并稀释至刻度,摇匀,作为肼贮备液。精密量取该贮备液,分别加水逐级稀释并制成浓度为0.5022、1.2554、2.5109、5.0217和12.5543 μg/mL的系列标准样品溶液。分别精密量取各浓度的标准样品溶液1 mL,分别置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过,即得。
2.2.5 供试品溶液
取硫酸阿米卡星、注射用硫酸阿米卡星约0.28 g,精密称定,置20 mL容量瓶中,用水溶解并稀释至刻度,摇匀,滤过,分别作为硫酸阿米卡星与注射用硫酸阿米卡星样品溶液;取硫酸阿米卡星注射液过滤即为硫酸阿米卡星注射液的样品溶液。精密量取各样品溶液的续滤液1 mL,置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过,即得。
3 试验结果
3.1 专属性
分别精密量取“2.2.2”和“2.2.3”项下的溶液,注入液相色谱仪,记录色谱图,结果空白溶剂和空白辅料均不干扰肼的测定,见图1A与图1B。
3.2 线性与范围
精密量取“2.2.4”项下的肼系列标准溶液,注入液相色谱仪,记录色谱图,以峰面积Y为纵坐标,肼浓度X(μg/mL)为横坐标进行线性回归,得线性回归方程Y=100.67X+10.778(r=0.9994),表明肼在0.5022~12.5543 μg/mL浓度范围内与峰面积的线性关系良好,典型色谱图见图1C。
3.3 准确度
取硫酸阿米卡星(A企业,批号RA0078A)、注射用硫酸阿米卡星(E企业,批号1905244)、硫酸阿米卡星注射液(F企业,批号181202011)按“2.2.5”方法制备样品溶液,分别精密量取样品溶液1 mL,各9份,分别精密加入“2.2.4”项下1.2554 μg/mL的溶液1 mL、2.5109 μg/mL的溶液1 mL、2.5109 μg/mL的溶液1.5 mL,各3份,分别置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水,振摇1 h,滤过。取续滤液注入液相色谱仪,记录色谱图。用“3.2”项下线性回归方程计算样品中肼的含量并计算回收率。结果硫酸阿米卡星、注射用硫酸阿米卡星与硫酸阿米卡星注射液中肼的平均回收率分别为94.8%、94.1%和94.3%,RSD(n=9)分别为5.1%、5.8%和4.0%,表明该方法回收率良好,见表2。
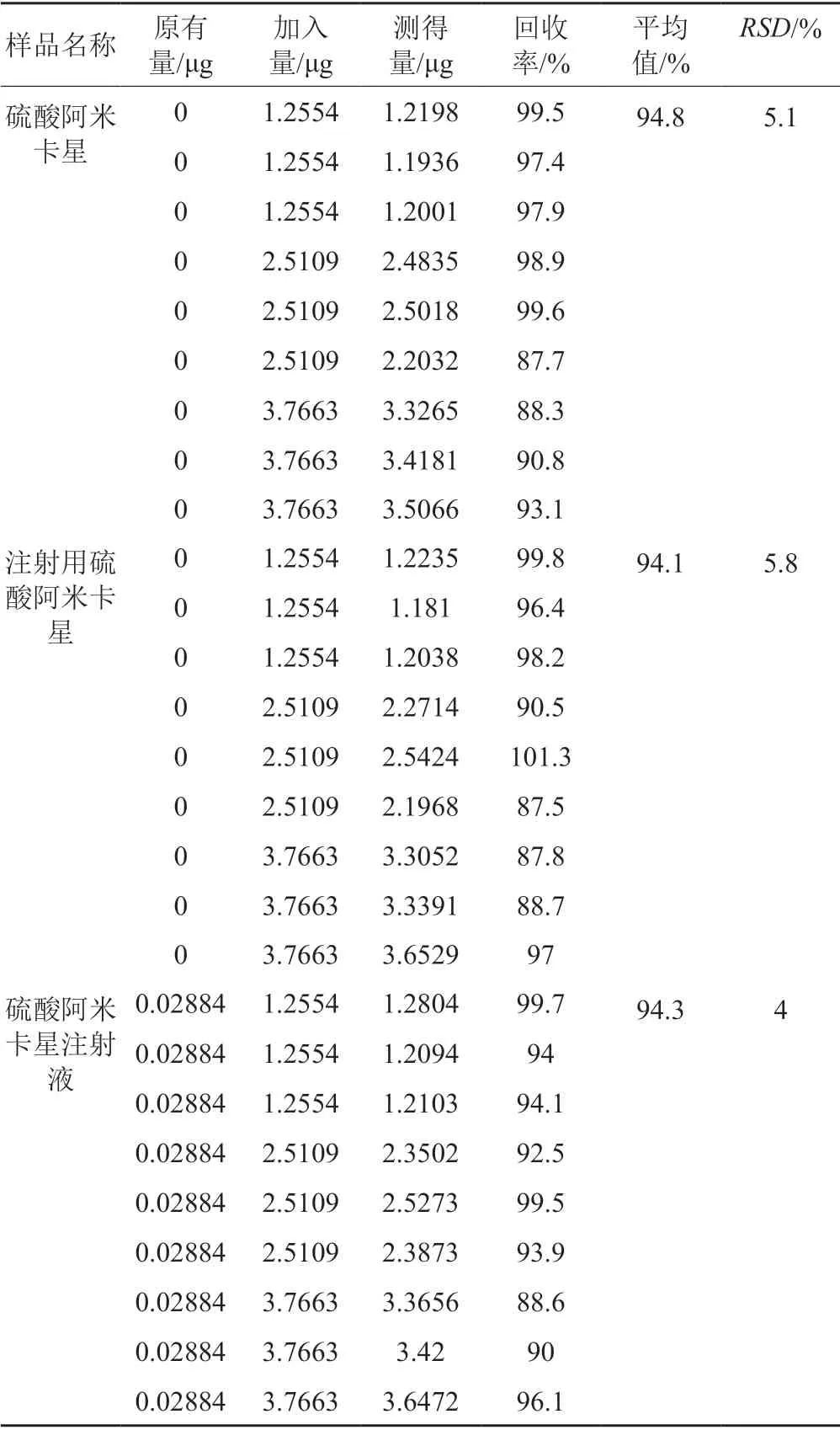
表2 回收率试验结果Tab.2 Results of the recovery tests
3.4 重复性
取硫酸阿米卡星(B企业,批号YA1903024)、注射用硫酸阿米卡星(H企业,批号1903031)、硫酸阿米卡星注射液(F企业,批号181202011)按“2.2.5”方法制备供试品溶液,各6份,取续滤液进样分析。用“3.2”项下线性回归方程计算,结果硫酸阿米卡星、注射用硫酸阿米卡星与硫酸阿米卡星注射液中肼含量(mg/kg)的RSD分别为3.9%、3.4%和2.6%。结果表明该方法的重复性良好。
3.5 精密度
精密量取“2.2.4”项下2.5109 μg/mL肼标准溶液,重复进样6次,结果肼的峰面积RSD为1.2%,表明仪器精密度良好。
3.6 检测限与定量限
分别精密量取“2.2.4”项下0.5022 μg/mL肼标准样品溶液1 mL,分别置50 mL和100 mL容量瓶中,用水溶解并稀释至刻度,摇匀,滤过,分别作为检测限溶液和定量限溶液。分别精密量取检测限溶液和定量限溶液1 mL,置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过。取续滤液进样分析,以信噪比(S/N)为3:1计,检测限为0.1 ng,最低检测浓度为0.05 μg/g(供试品溶液浓度为0.1 g/mL);以信噪比(S/N)为10:1计,定量限为0.2 ng,最低定量浓度为0.1 μg/g(供试品溶液浓度为0.1 g/mL)。
3.7 溶液稳定性
精密量取“2.2.4”项下2.5109 μg/mL肼标准溶液,分别于0、2、4、8、10、12、18和24 h内进样,结果肼峰面积的RSD为0.6%,表明肼对照品溶液在24 h内稳定。
3.8 耐用性
3.8.1 衍生化反应温度
精密量取5份2.5109 μg/mL的肼标准样品溶液,各1 mL,分别置10 mL离心管中,精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,反应温度分别为25℃、28℃、30℃、32℃和35℃,振摇1 h,滤过,取续滤液进样分析,结果肼的峰面积RSD为0.9%。
3.8.2 衍生化试剂浓度
精密量取3份2.5109 μg/mL的肼标准样品溶液,各1 mL,分别置10 mL离心管中,分别精密加4.8%、5.0%和5.2%苯甲醛甲醇溶液1 mL,振摇1 min,再精密加水5 mL,振摇1 h,滤过,取续滤液进样分析,结果肼的峰面积RSD为1.2%。
3.8.3 衍生化反应时间
精密量取3份2.5109 μg/mL的肼标准样品溶液,各1 mL,分别置10 mL离心管中,分别精密加苯甲醛溶液1 mL,振摇1 min,再精密加水5 mL,分别振摇55、60和65min,滤过,取续滤液进样分析,结果肼的峰面积RSD为0.8%。
3.8.4 小结
试验表明,衍生化反应温度、反应浓度和反应时间的微小变化均不影响测定结果,衍生化反应方法耐用性良好。
3.9 样品测定
取硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液,分别按“2.2.5”方法制备供试品溶液,取续滤液进样分析。用“3.2”项下线性回归方程计算样品中肼的含量。结果国内企业硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液中的肼分别为未检出~1.8 μg/g、未检出~0.2 μg/g、未检出~3.1 μg/g;日本Nichiiko公司的参比制剂中均未检出肼,结果见表3。
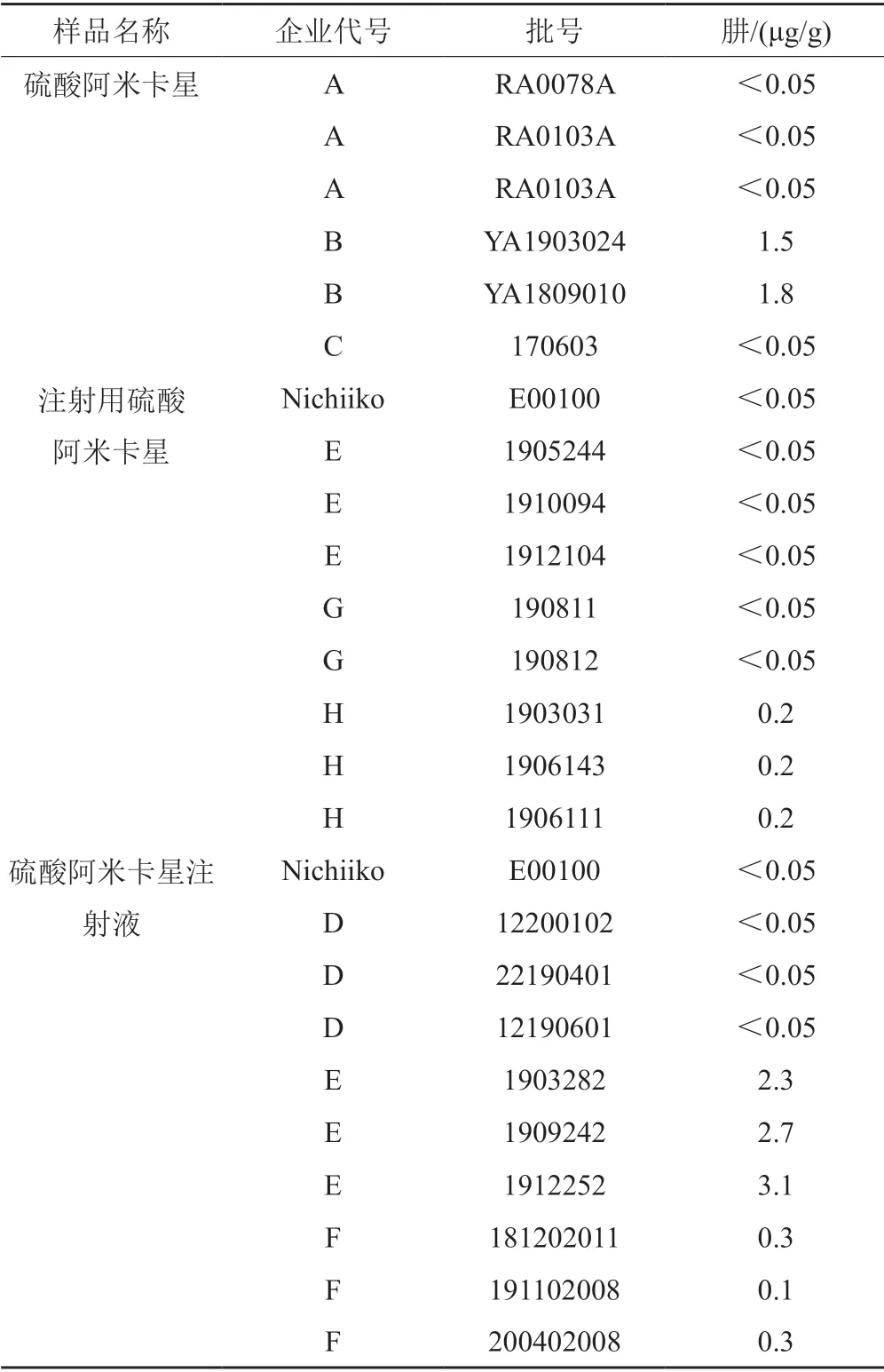
表3 样品测定结果Tab.3 Results of the sample determination
4 讨论
4.1 柱前衍生HPLC方法的建立
肼极性大,相对分子质量低,无发色团,无法直接采用液相色谱法进行检测,同时药物及其杂质导致样品基质复杂,因此直接定量肼较为困难。而苯甲醛具有高的反应性,可以与活性较低的肼发生衍生化反应,其衍生产物具有较强的紫外吸收,能满足灵敏度的要求,因此苯甲醛衍生化法较适合测定肼[10]。
4.2 衍生化时间的确定
试验发现,由于不同的企业辅料不同,结果部分企业供试品溶液衍生化15 min时,溶液浑浊。对衍生化时间进行考察,发现供试品溶液衍生化1 h,溶液澄清。对该方法进行验证,结果专属性、回收率等均良好,因此确定衍生化时间为1 h。
4.3 原料及制剂中的肼
ICH M7指出肼的每日可接受摄入量为39 μg,硫酸阿米卡星最大日服用剂量为1.5 g,因此肼的限度可定为26 μg/g。本次试验检测的参比制剂均未检出肼,国内企业硫酸阿米卡星、注射用硫酸阿米卡星、硫酸阿米卡星注射液中的肼分别为未检出~1.8 μg/g、未检出~0.2 μg/g、未检出~3.1 μg/g。表明国内外硫酸阿米卡星及其注射剂中的肼均符合ICH M7的要求;同时该方法可为其他制剂中的肼的控制提供参考。