红枣多糖口服液澄清工艺及抗氧化活性研究
贾晓昱,郑艳丽,张 鹏*,李江阔,赵志永,杨克箐
(1.天津市农业科学院农产品保鲜与加工技术研究所,天津 300384;2.天津科技大学,天津 300457;3.新疆远翔农业科技有限公司,新疆和田 848000)
我国红枣年产量达700 万t,种植面积和产量均居世界第一。红枣中含有多糖、抗坏血酸、三萜酸、酚酸、氨基酸、皂苷和黄酮类化合物等多种生物活性成分[1-2],具有抗氧化、抗炎、抗肥胖、抗心血管疾病、保肝、抗糖尿病、抗微生物、抗癌和保护肠胃等作用[3-4]。红枣多糖是红枣的主要营养成分,具有多种生理功效,红枣多糖的提取已成为近年来的研究热点,主要技术是热水浸提[5],另外,微波辅助提取[6]、超声辅助提取和亚临界水提取等也被用于提取红枣多糖[7]。
目前红枣多糖主要的加工产品是粗多糖粉剂,其他加工产品则鲜有报道。口服液是在中药煎煮液的基础上开发出的制剂型产品,具有功效成分保留率高、服用剂量低、效果好和便于携带等优点,近年来在中老年保健品市场具有广阔的发展前景[8]。但是,植物型口服液普遍存在后期絮凝、沉淀和浑浊等问题。制剂中引起沉淀的主要成分包括色素、果胶、蛋白质及鞣质等,沉淀物积累会导致口服液有效成分损失,因此,澄清工艺在口服液制备过程中十分必要[9-10]。壳聚糖具有生物降解性好、无毒、无污染和成本低等特性,在水处理领域已被广泛应用,也被用于人参、天贝和铁皮石斛口服液的制备[11-13]。但是,未见应用于红枣多糖口服液制备的相关报道。
本文以红枣为原料,采用热水提取红枣多糖,探究醇沉和壳聚糖澄清两种工艺对红枣多糖抗氧化活性及生物有效性的影响,明确最佳澄清工艺,为进一步开发红枣口服液新产品,提高红枣产品附加值提供理论指导。
1 材料与方法
1.1 材料与试剂
供试红枣为新疆骏枣干枣,购于天津滨海新区金元宝农贸批发市场。DPPH、ABTS、O2-·、·OH 自由基检测试剂盒均采购自北京索莱宝科技有限公司,无水乙醇采购自天津市江天化工技术有限公司,其他试剂均为分析纯。
1.2 仪器与设备
真空泵,SHZ-D,天津天拓仪器有限公司;水浴锅,HH-M8,天津市庆达试验仪器制造有限公司;粉碎机,ZN-08,天津市泰斯特仪器有限公司;紫外分光光度计,T6,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 红枣口服液制备工艺
红枣原料筛选→清洗→烘箱烘干(55~60 ℃)→粉碎过筛(40 目)→热水浸提(60 ℃、70 min)→真空浓缩(60 ℃真空旋转蒸发器浓缩)→澄清→离心(3 500 r/min、10 min)→透析(截留分子量,600 Da)→红枣多糖溶液→冷冻干燥→红枣粗多糖→调配(1%~3%柠檬酸、5%~10%糖酸比调配)→包装→灭菌(90 ℃、30 min)→检验→成品。
经过前期试验,得出红枣最佳热水浸提工艺参数为提取温度60 ℃、浸提时间70 min、提取次数3 次、料液比1∶17(g/mL),此条件下红枣多糖提取率为15.89%。
1.3.2 澄清工艺单因素试验
醇沉工艺单因素实验参数为乙醇浓度(30%、40%、50%、60%、70%、80%)、醇沉温度(10、15、20、25、30、35℃)、醇沉时间(4、8、12、16、20、24 h),壳聚糖澄清工艺单因素实验参数为壳聚糖浓度(0.01%、0.02%、0.03%、0.04%、0.05%、0.06%)、温度(10、20、30、40、50、60 ℃)、时间(1、2、3、4、5、6 h)。
1.3.3 响应面优化实验
醇沉工艺采用L17(34)响应面实验进行优化,因素水平如表1 所示。综合得分=多糖保留率×60+透光率×40。

表1 醇沉工艺响应面因素水平表Table 1 Factor and level table of response surface method in alcohol precipitation process
壳聚糖工艺设计L17(34)响应面实验,因素水平如表2所示。综合得分=多糖保留率×60+透光率×40。

表2 壳聚糖工艺响应面因素水平表Table 2 Factor and level table of response surface method in chitosan process
1.4 测定指标与方法
1.4.1 多糖保留率
采用苯酚-硫酸比色法测定多糖含量[14]。依照公式(1)计算多糖保留率。
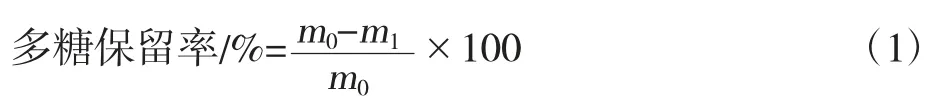
式中,m0为澄清前多糖含量,mg/mL;m1为澄清后多糖含量,mg/mL。
1.4.2 透光率
参照张海悦等[15]的方法,采用紫外-分光光度法测定,以蒸馏水为参比,测定其在660 nm 波长下的透光率。
1.4.3 ABTS 自由基清除能力
称取0.038 4 g ABTS 和0.013 4 g 过硫酸钾,用蒸馏水定容至20 mL,室温避光过夜得ABTS 母液。室温下以1∶40(g/g)加入蒸馏水,混匀后于734 nm 波长下,将吸光度值调节至0.7 备用。测定过程准备多糖溶液0.2 mL、ABTS 稀释液3.0 mL,避光反应10 min,以蒸馏水为对照,测定其在734 nm 处的吸光度值[16]。按照式(2)计算ABTS自由基清除率。
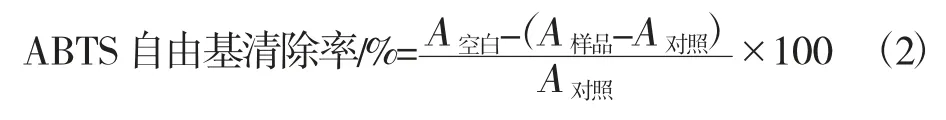
式中,A样品为多糖溶液的吸光度值;A空白为对照组吸光度值;A对照为蒸馏水代替ABTS 的吸光度值。
1.4.4 DPPH 自由基清除率
取多糖粗样品和精制样品液1 mL,随后再分别放入3 mL 甲醇溶液(由0.004%DPPH 配制的),摇匀,避光搁置20 min,选用甲醇溶液为空白比对液,在517 nm 处检测吸光度值,选择蒸馏水为阴性比对液,选择维生素C溶液为阳性比对液[17]。按公式(3)计算相应清除率。
称取多糖粗样品和精制样品液1 mL于试管中,分别按次序滴入0.078 mol/L NBT 溶液1 mL、0.468 mol/L NADH 试剂1 mL、0.06 mol/L PMS 溶液0.4 mL,混匀室温放置5 min,测定560nm 处的吸光度值。对照组用不相同质量分数的样品液1 mL,PMS 溶液则被0.4 mL 蒸馏水代替作为空白,选VC 溶液为阳性比对液[18]。按公式(3)计算相应清除率。
1.4.6 羟自由基(·OH)清除率
取多糖粗样品和精制样品液1 mL,加入1.5 mL 反应液(含0.1 mmol/L EDTA、0.1 mmol/L FeCl3和2.8 mmol/L DR 的磷酸盐缓冲液(pH 7.4)和20 mmol/L H2O20.35 mL),在37 ℃水浴下反应40 min 后停止,在532 nm 处检测吸光度值,以蒸馏水为阴性对比,VC 为阳性对比[19]。按公式(3)计算相应清除率。
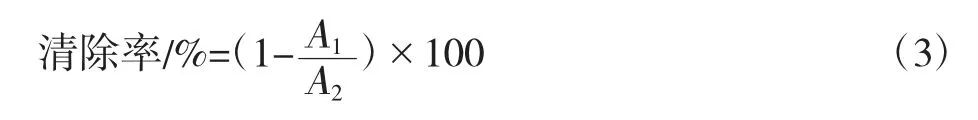
式中,A1为样品吸光度值;A2为蒸馏水吸光度值。
1.5 数据处理
响应面设计软件采用Design Expert 10,采用Origin 2019 作图,用SPSS 21.0 进行显著性分析。
2 结果与分析
2.1 醇沉工艺单因素试验
醇沉是多糖提取和澄清的常规方法,醇沉工艺参数研究结果如图1 所示。由图可知,固定温度25℃,醇沉时间8 h,发现提取液的透光率随乙醇浓度的增加而增大,但是多糖保留率则随乙醇浓度的增大而减少。当乙醇浓度为50%时,红枣口服液的多糖保留率为59.86%。固定乙醇浓度60%,醇沉时间8 h,多糖保留率随浓度增加呈现先降低后升高趋势,低温范围导致大分子杂质难以聚沉,当温度过高时,杂质间分子作用力增大,沉淀生成速率快,导致口服液不澄清[20]。醇沉温度为20 ℃时,多糖保留率为65.89%,透光率为75.86%,当醇沉温度为25 ℃时,多糖保留率为69.89%,透光率为74.85%,基于口服液多糖保留率,选择25 ℃作为适宜的醇沉温度参数。固定乙醇浓度60%,醇沉温度25 ℃,醇沉时间8 h 时,均具有较高的多糖保留率和透光率值,说明大分子杂质物质已基本被沉淀。当醇沉时间超过12 h 时,口服液的多糖保留率和透光率变化幅度均不大,
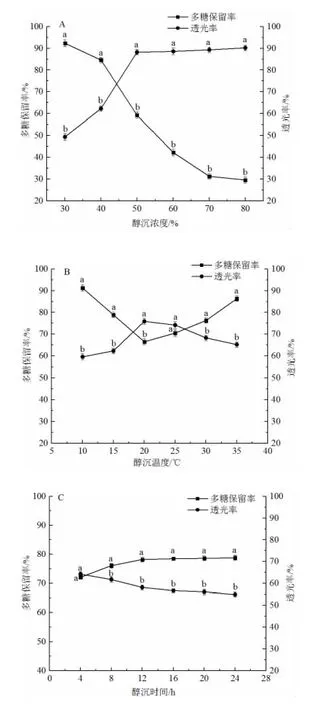
图1 醇沉工艺参数研究Fig.1 Study on alcohol settling concentration parameters
2.2 醇沉工艺响应面优化
由表3、4(见上页)可知,应用响应面软件对数据进行拟合分析(采用编码数据),可获得多元二次回归方程模型(A 为乙醇浓度,B 为醇沉温度,C 为醇沉时间,Y为综合得分)。Y=74.41-0.583 6A+0.701 1B+0.157 3C-0.061 3AB-0.938 4AC+0.474 8BC-1.49A2-1.87B2-0.855 2C2。
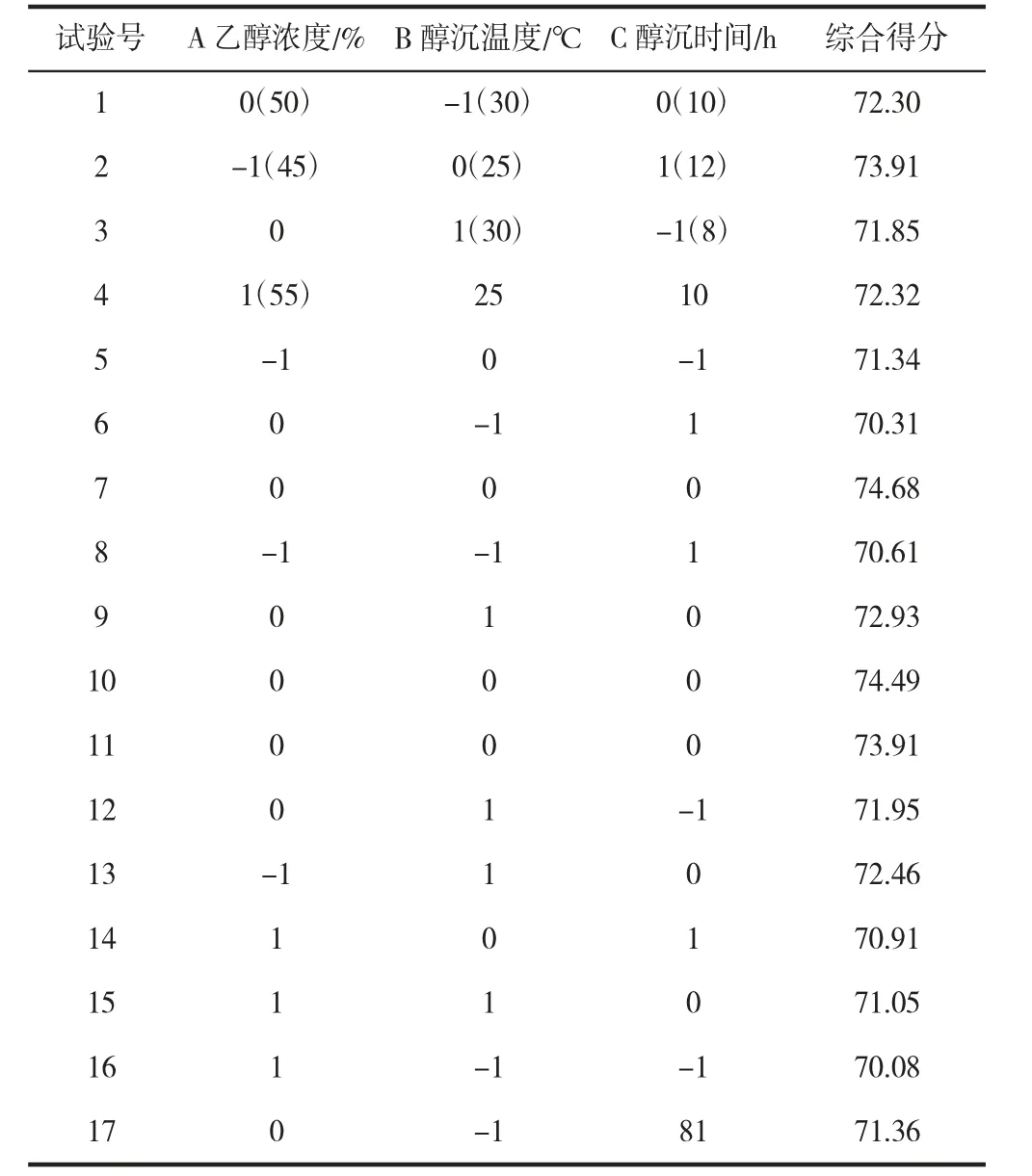
表3 醇沉工艺响应面优化实验结果Table 3 Orthogonal experimental design table of alcohol precipitation process optimization
由表4 可以看出,响应面回归模型极显著;回归模型相关系数R2为0.970 8,反映该线性回归模型能在97.08%程度上解释变量Y的变异性。由显著性水平检验可知,A、B、AC、A2、B2、C2项对响应值影响极显著,BC 项对响应值影响显著,C、AB 项对响应值影响不显著,表明试验因素对综合得分的影响不是简单的线性关系。试验因素交互作用对综合得分影响的3D 曲面图和等高线图如图2 所示。
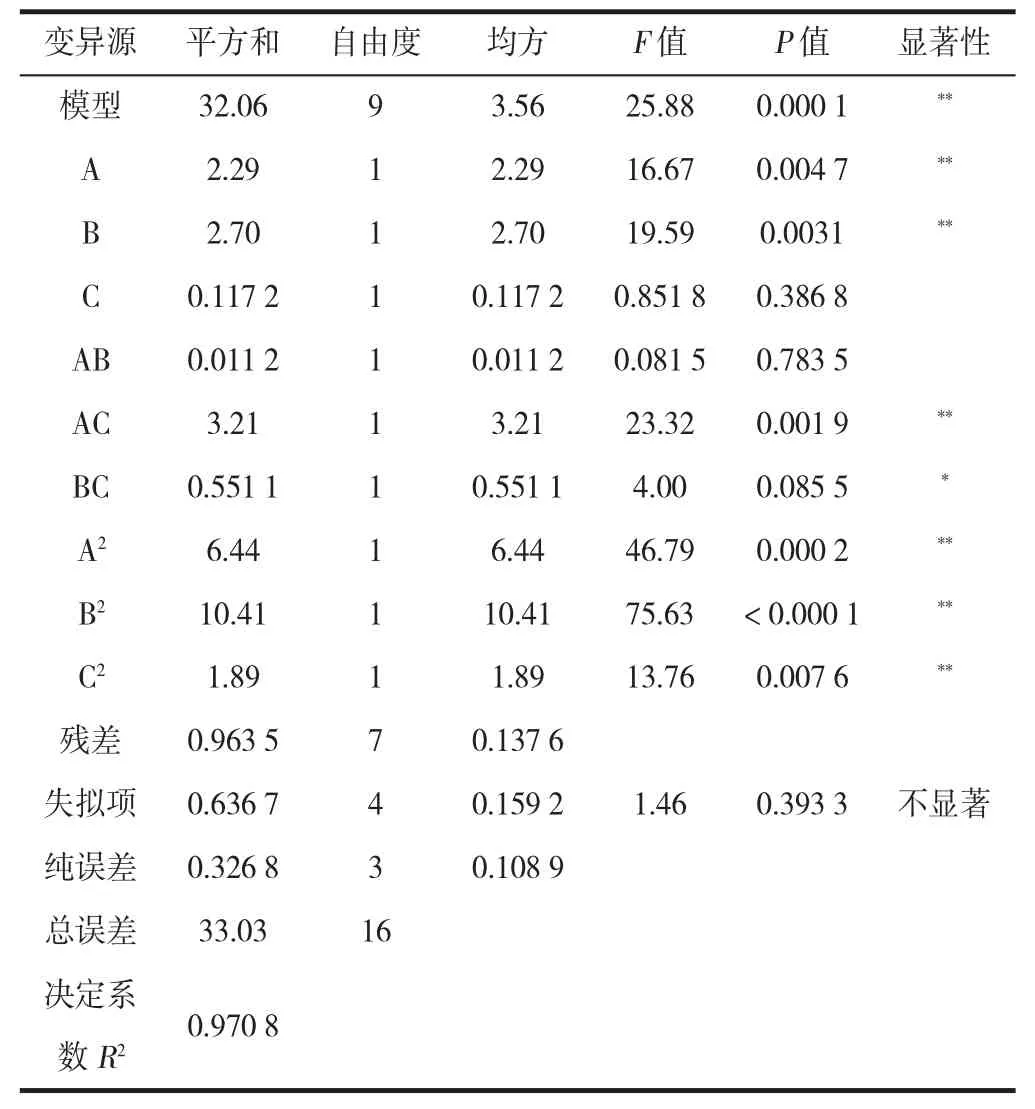
表4 响应曲面优化方差分析表Table 4 Optimal variance analysis table of response surface
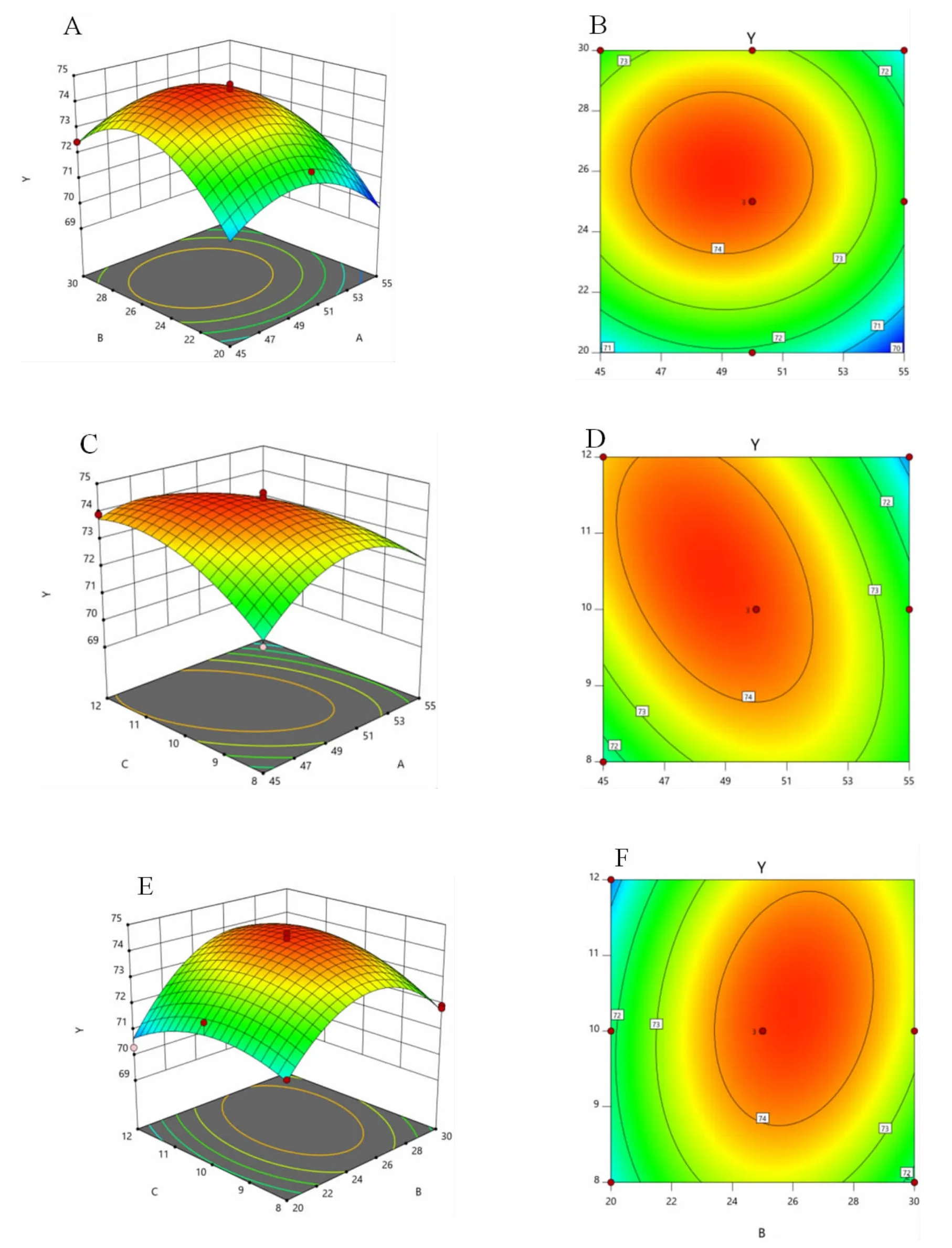
图2 试验因素交互作用影响的3D 响应曲面图和等高线图Fig.2 3D response surface diagram and contour diagram of the interaction of factors
结合图2 和表4 可知,乙醇浓度和醇沉温度交互作用对综合得分的影响不显著,乙醇浓度和醇沉时间对综合得分影响极显著,醇沉温度和醇沉时间对综合得分影响显著。通过响应面软件对数据做进一步的拟合分析,得出最佳醇沉条件为乙醇浓度47.802 2%,醇沉温度25.297 4 ℃,醇沉时间10.424 9 h,综合得分达最大值(74.504 2)。经验证试验,设定乙醇浓度48%,醇沉温度25℃,醇沉时间10 h 时,得分为74.68,此时,红枣口服液的多糖保留率为74.95%,透光率为72.45%。
2.3 壳聚糖澄清工艺单因素实验
壳聚糖分子中含有游离氨基,在溶液中易生成盐,表现出阳离子特性,具有较好的絮凝和澄清作用,是常用的澄清剂[20-21]。
由图3A 可知,口服液的透光率随壳聚糖添加浓度的增大而增大,当壳聚糖添加量超过0.03%时,其增幅明显降低。随着壳聚糖添加量的增加,多糖保留率逐渐降低,当浓度超过0.03%时,多糖保留率下降速度明显加快,因此,壳聚糖添加量选择0.03%。如图3B,澄清时间超过4 h 后,口服液透光率值基本趋于稳定,而多糖保留率随澄清时间的增加而降低,表明4 h 澄清时间条件下,口服液中的大部分杂质已被沉淀,且澄清时间4 h 时,多糖保留率为89.6%,因此,澄清时间选择4 h。如图3C,多糖保留率随着澄清温度的增大而降低,透光率随着澄清温度的增大而升高,当温度大于40 ℃时,多糖保留率明显下降,温度为等于40 ℃时,口服液多糖保留率为90.2%,透光率为89.6%,可能是因为当温度低于40 ℃时,壳聚糖主要发挥澄清作用,当温度高于40 ℃时,壳聚糖主要发生热凝结反应[22],因此,选择澄清温度为40 ℃。
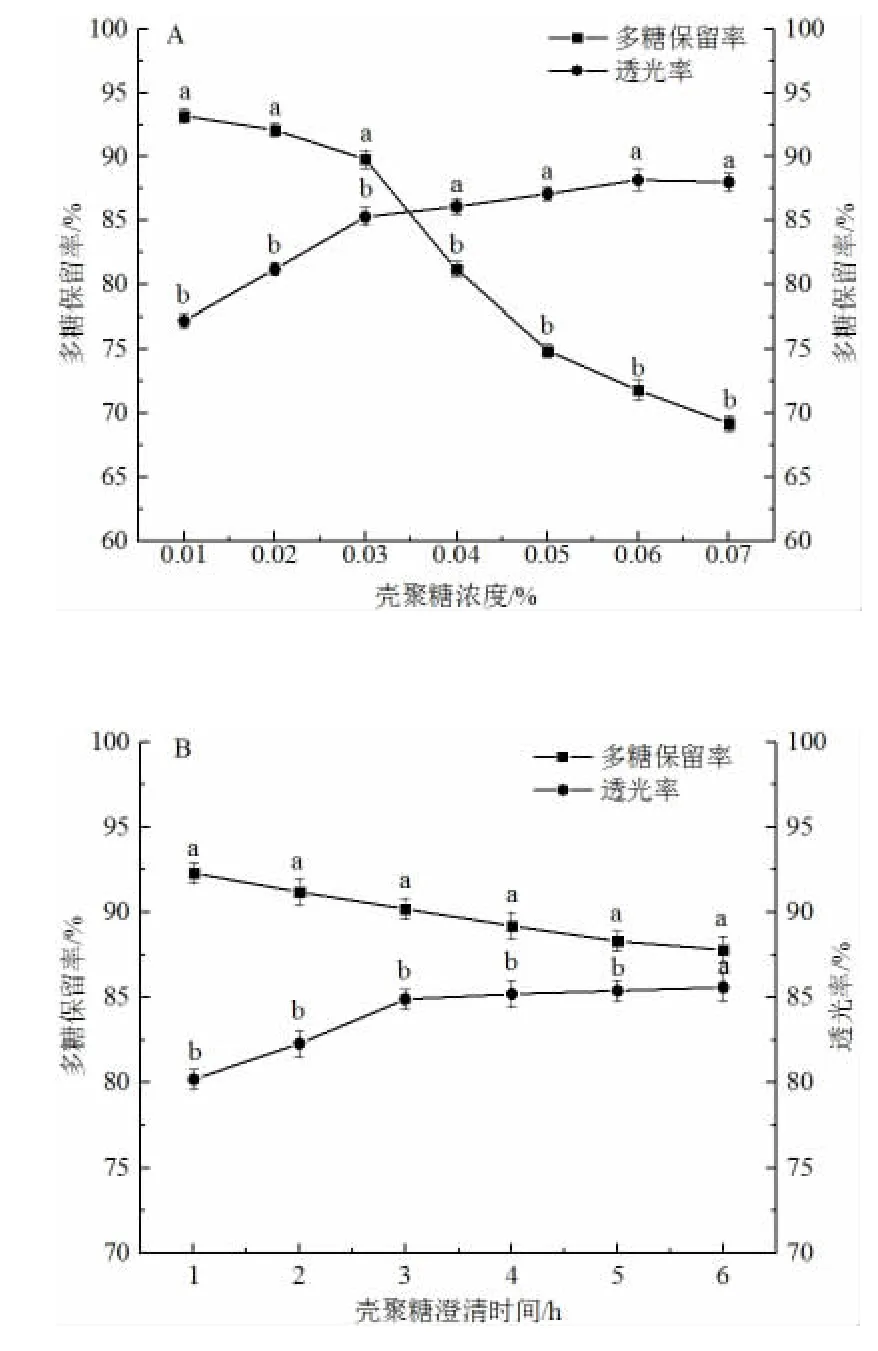
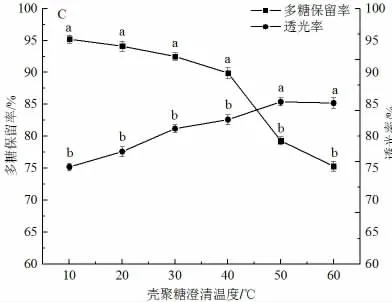
图3 壳聚糖工艺单因素实验结果Fig.3 Results of single factor experiment using chitosan process
2.4 壳聚糖澄清工艺响应面优化
应用响应面软件对数据进行拟合分析(采用编码数据),可以获得多元二次回归方程模型(式中A 为壳聚糖添加量,B 为澄清温度,C 为澄清时间,Y为综合得分),Y=85.27+1.54A+2.21 B+0.191 3 C+1.55 AB-1.14AC+0.452 0BC-4.41A2-3.82B2-6.66C2。
由表5、6(见第15 页)可知,响应面回归模型极显著;模型相关系数R2为0.993 1,反映该线性回归模型能在99.31%程度上解释反应变量Y的变异性。由显著性水平检验可知,A、B、A2、B2、C2项对响应值影响极显著,AB、AC 项对响应值影响显著,C、BC 项对响应值影响不显著,表明试验因素对综合得分的影响不是简单的线性关系。试验因素交互作用对综合得分影响的3D 曲面图和等高线图如图4。
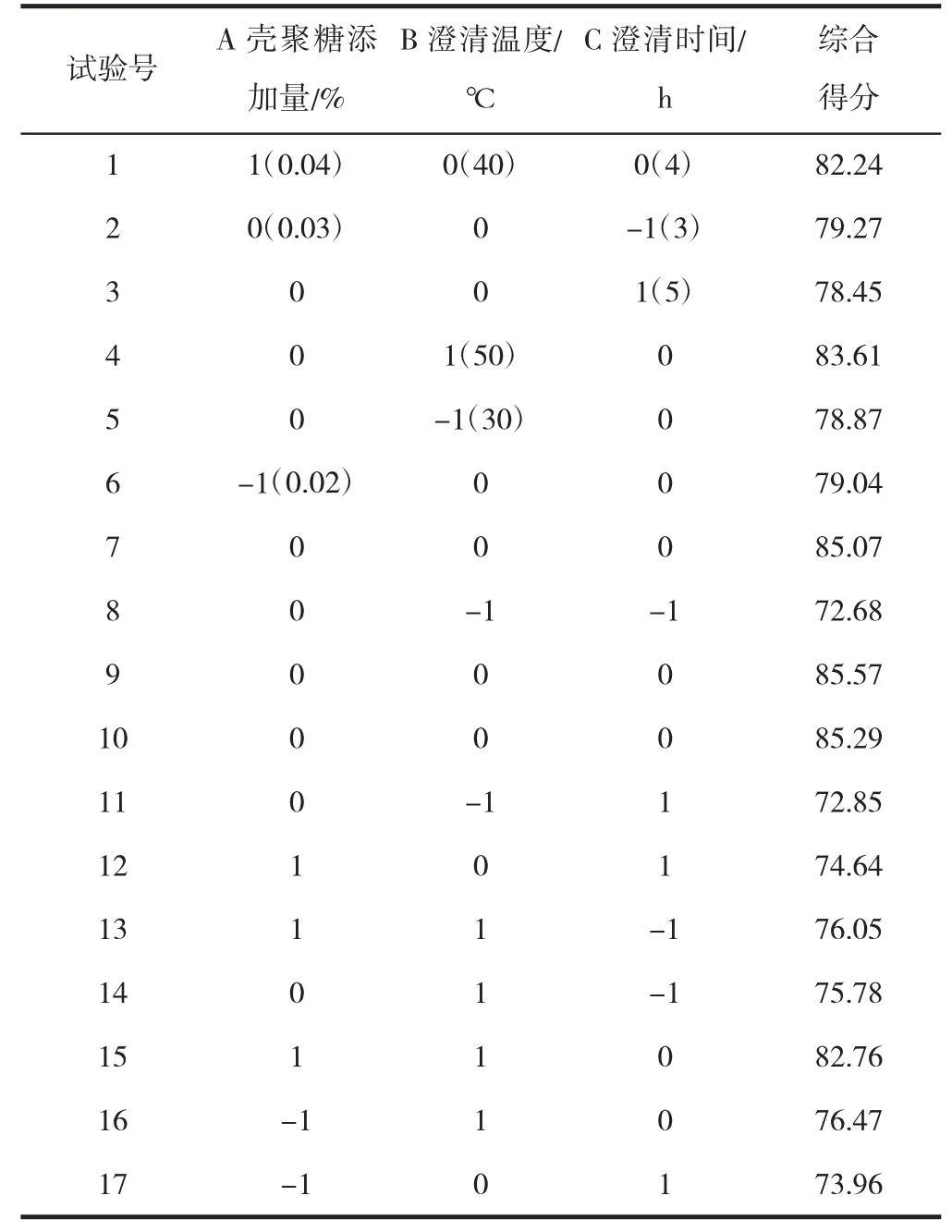
表5 壳聚糖澄清工艺优化实验结果Table 5 Design table of orthogonal experiment results of chitosan process optimization
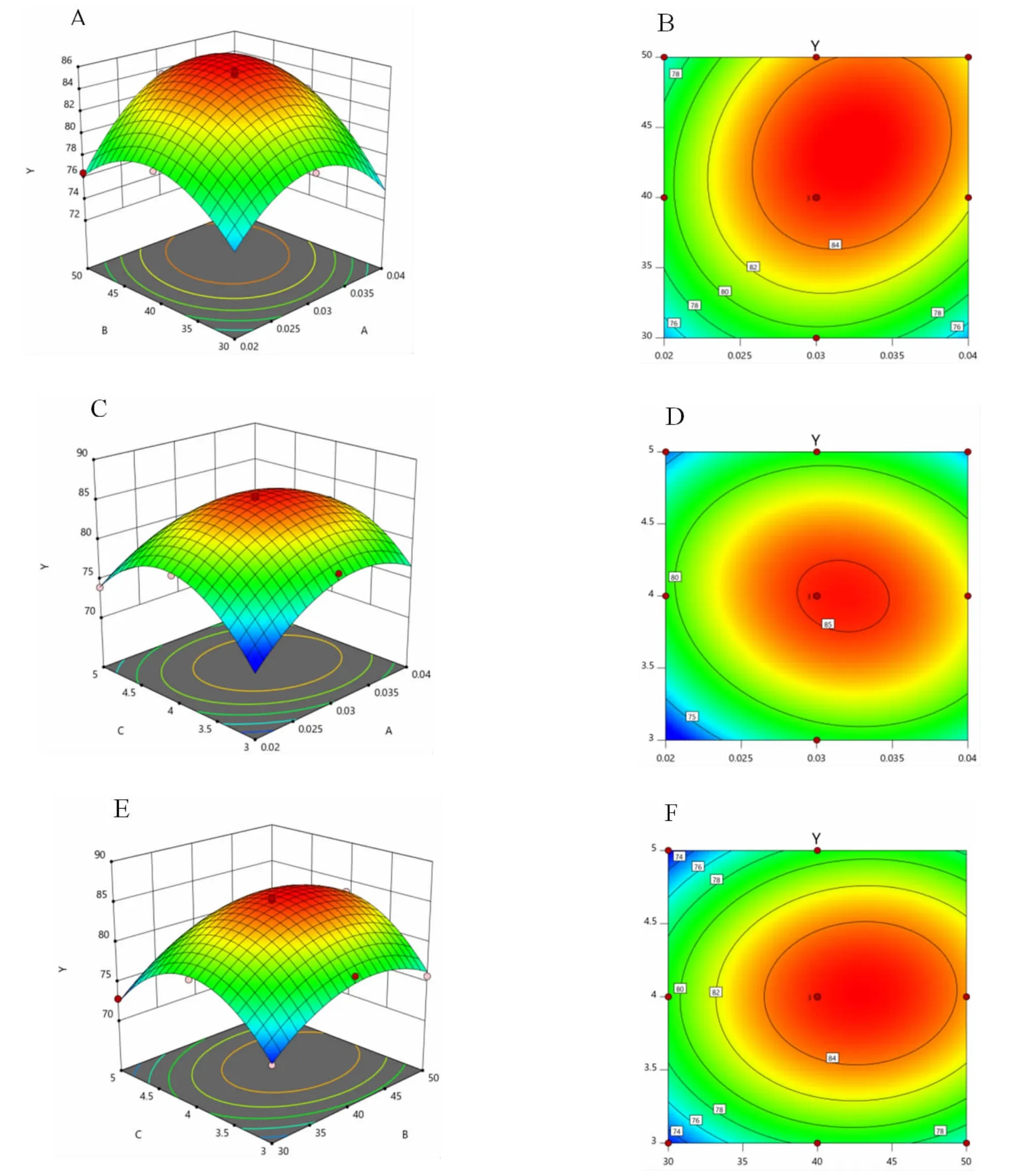
图4 试验因素交互作用影响的3D 响应曲面图和等高线图Fig.4 3D response surface diagram and contour diagram of the interaction of experimental factors
通过响应面软件拟合分析,得出最佳条件为壳聚糖浓度0.03%,温度40 ℃,时间4 h,综合得分达到最大值(85.27)。经验证实验,红枣口服液得分85.29,说明模型与实际提取率吻合效果较好,且该条件下,口服液多糖保留率为83.89%,透光率为81.25%。与醇沉工艺相比,壳聚糖澄清的多糖保留率和透光率均较高,表明其对多糖溶液中的杂质去除能力和澄清能力优于醇沉工艺。
2.5 不同澄清工艺对多糖抗氧化活性的影响
2.5.1 不同澄清工艺对多糖清除·OH 能力的影响
·OH 是生物体内最具活性的自由基,几乎所有类型的大分子,包括蛋白质、脂质、碳水化合物和核酸,都可能被羟自由基破坏,从而导致生物体老化[23]。本实验对比分析了醇沉和壳聚糖两种澄清工艺清除·OH 能力的差异,如图5 所示。由图知,醇沉和壳聚糖澄清工艺的·OH 清除能力差异不显著,以·OH 清除率达到50%计算,所需的多糖浓度分别为2.25 mg/mL 和2.0 mg/mL。壳聚糖澄清工艺制备的粗多糖对·OH 的清除能力高于醇沉工艺,可能的原因是壳聚糖澄清后,多糖的活性提高,而红枣多糖可以通过结合氧化过程中必需的自由基离子来终止自由基链反应,从而具有较高的清除·OH 能力[23]。
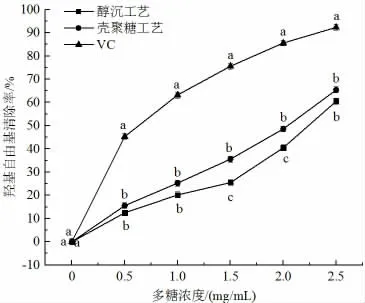
图5 澄清工艺对多糖清除·OH 能力的影响Fig.5 Effects of clarification process on hydroxyl radical scavenging ability of polysaccharides
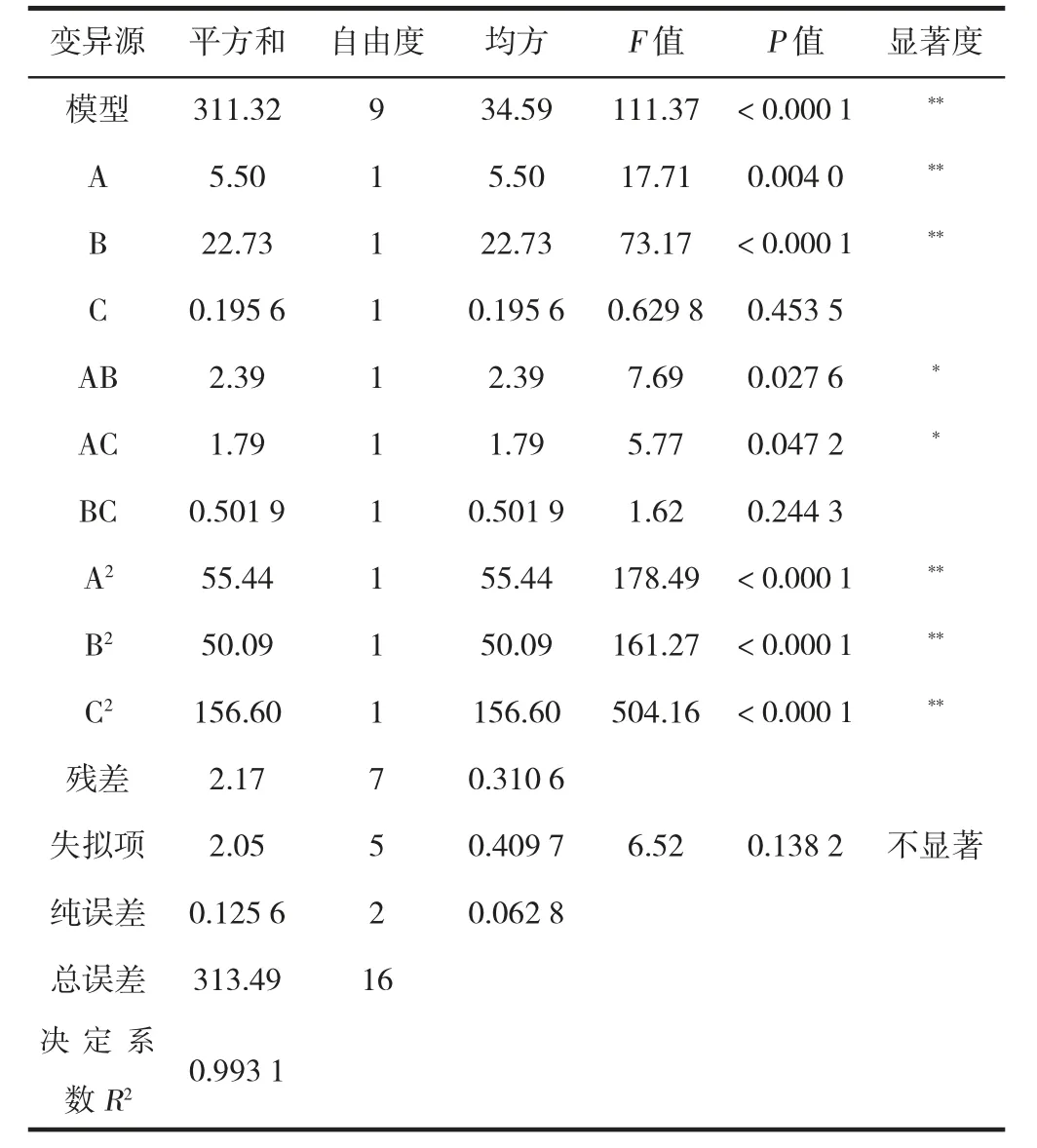
表6 壳聚糖工艺响应面优化方差分析表Table 6 Response surfaceo for chitosan process
2.5.2 不同澄清工艺清除ABTS 自由基能力对比
由图6 可知,醇沉和壳聚糖澄清工艺在清除ABTS 自由基能力方面,表现出相同的趋势,当多糖浓度相同时,壳聚糖澄清工艺对ABTS 自由基的清除能力高于醇沉工艺,当多糖浓度为2 mg/mL 时,醇沉工艺对ABTS 清除能力为25%,而壳聚糖澄清工艺对ABTS 的清除能力达41.2%,其可能的原因是乙醇沉淀过程在去除大分子杂质的同时会将具备清除ABTS 自由基功能的部分小分子多糖也除去,导致醇沉工艺ABTS 自由基的清除能力低于壳聚糖处理工艺的。
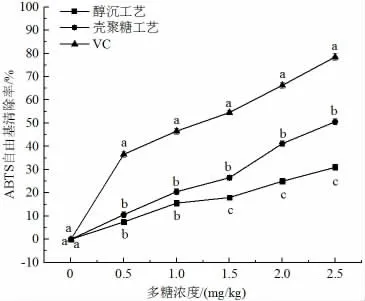
图6 不同澄清工艺清除ABTS 自由基能力的对比Fig.6 Comparison of ABTS free radical scavenging ability of different clarification processes
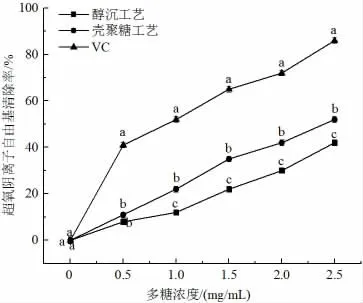
图7 澄清工艺对多糖清除能力的对比Fig.7 Comparison of the scavenging ability of the clarification process on
2.5.4 不同澄清工艺对清除DPPH 自由基能力的影响
DPPH 是一个稳定的基团,广泛用于评价抗氧化剂对自由基的清除活性,能够较好地反映溶液的抗氧化性[26]。在DPPH 测定中,抗氧化剂清除DPPH 自由基的作用归因于它们的供氢能力,图8 为不同澄清工艺对DPPH 自由基的清除活性,由图知,随着多糖浓度的增加,DPPH 自由基清除率逐渐增加,当多糖浓度超过1.5 mg/mL 时,壳聚糖澄清工艺对DPPH 自由基的清除能力更加显著,且壳聚糖工艺明显优于醇沉工艺。壳聚糖是阳离子碱性多糖,其主要通过电中和与粘结架桥发挥双重絮凝作用,与醇沉工艺相比,其不仅能够去除蛋白质和糖类,还可以有效去除鞣质[27]。鞣质聚合是导致口服液沉淀的主要原因,口服液的浑浊和沉淀,阻挡了溶液与DPPH 基团的接触,降低了供氢能力,这可能是醇沉工艺去除DPPH 自由基能力较差的原因。
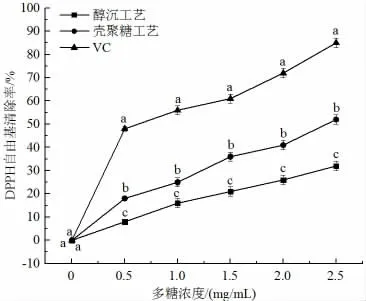
图8 不同澄清工艺对多糖清除DPPH 自由基能力的影响Fig.8 Effects of different clarification processes on DPPH free radical scavenging ability of polysaccharides
3 结论
以红枣为试材,研究了红枣口服液制备过程中的关键澄清工艺,优化了醇沉和壳聚糖两种澄清工艺的浓度、温度和时间参数,并分析了不同澄清工艺对口服液抗氧化活性的影响。在优化澄清工艺方面,壳聚糖澄清工艺可以维持较高的多糖保留率和透光率,对杂质的澄清较完全,而且壳聚糖澄清工艺过程中壳聚糖用量少、时间短、澄清效率高于醇沉工艺。在抗氧化活性方面,壳聚糖在清除ABTS 自由基、羟自由基、阴离子自由基()、DPPH 自由基方面,均显著的优于醇沉工艺。因此,壳聚糖澄清工艺更适合于红枣多糖口服液的加工,应用前景广阔,后续可从壳聚糖复合絮凝剂用于制备红枣口服液,提高澄清效果等方面开展研究。

