AM真菌对滇重楼根际土壤酚酸类物质含量的影响
李卓蔚,杨青山,江春阳,黄小兰,石汝杰,周 浓
(重庆三峡学院 生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404120)
滇重楼(Paris polyphyllavar.yunnanensis)是百合科重楼属中著名的药用植物,为中药重楼药材项下的基源植物之一,其根茎具有清热解毒、消肿止痛、息风定惊的功效,常用于治疗痈肿疮毒、毒蛇咬伤、跌打损伤、小儿惊风等疾病[1]。由于过去重楼药材以野生采挖为主,过度采集和生境破坏导致滇重楼日趋濒危,发展人工栽培已成为满足市场需求和保护野生资源的最有效途径[2]。目前,重楼栽培种源比较混乱、药材质量参差不齐、各种病虫害发病率持续上升,严重制约了其相关产业的健康发展[3]。因此,将微生物栽培技术应用于实际生产,以期提高药材的产量和品质是当前工作的重中之重。课题组研究发现,丛枝菌根(Arbuscular mycorrhizal,AM)真菌在室温盆栽或大田栽培条件下能有效提高滇重楼产量和品质,显著影响滇重楼的次生代谢产物[3-4]。AM 真菌种类对植物的酚类、生物碱等次生代谢产物的影响不同[5],而酚酸类是众多植物根系土壤中常见的自毒物质,由其导致的自毒作用制约着现代农业的增产增收[6]。张敏瑜等[7]在温室盆栽6个月后接种AM 真菌,显著提高了柑橘酚酸类物质的积累,但是酚酸组分在根和根分泌物中存在差异;马通等[8]在温室盆栽条件下接种AM 真菌,能够有效的减少土壤中酚酸类物质的积累,不论连作年限的长短,均具有较强的抑制作用。但AM 真菌与滇重楼共生栽培后,其根际土壤中酚酸类物质的变化如何不得而知。滇重楼是一种名贵的药材,其土壤中的酚酸含量将直接影响滇重楼的产量,故对接种AM 真菌后,滇重楼根际土壤酚酸类物质含量影响的研究,有利于探知影响滇重楼产量的本质。课题组前期已将施加AM 真菌混合菌剂,对滇重楼根际土壤理化性质的影响进行了初步研究。本试验在重庆、贵州、云南3省市模拟大田条件下滇重楼与AM 真菌的共生栽培,研究AM 真菌对不同栽培地点根际土壤中酚类等次生代谢物的影响,以期为合理评价AM 真菌对缓解滇重楼人工栽培中自毒作用提供可靠的依据,为大规模推广大田栽培滇重楼提供理论和实践基础。
1 材料与方法
1.1 材料
1.1.1 材料来源
为评价接种AM 真菌对滇重楼生长发育的影响,通过美国国际丛枝菌根真菌种质资源保藏中心(INVAM)购得相应的AM 真菌纯净菌剂,接种菌剂均为带有孢子、菌丝及侵染后根段的栽培基质,利用TROUVELOT A 等[9]方法构建不同组合菌种的试验方案,筛选出2 个AM 真菌混合处理(AM1 和AM2)和1 个对照处理(CK):(1)AM1 生物肥料中含有丰富的(Scutellospora calospora、Cetraspora pellucida、Racocetra coralloidea、Racocetra fulgida);(2)AM2生物肥料中含有丰富的(Scutellospora calospora、Cetraspora pellucida、Gigaspora margarita、Gigaspora gigantea、Septoglomus deserticola、Claroideoglomus claroideum);(3)对照植株以不接种(CK)处理。栽培土壤均为未栽培过滇重楼的本地山基土,分别采集于重庆市万州区、贵州省安顺市、云南省保山市3个栽培地点的2 个AM 真菌处理组和CK 组的滇重楼根际土壤[10],采用抖土法收集各处理组根际土壤,室内风干后过100 目(0.150 mm)筛,密封干燥保存,待用。
1.1.2 仪器
ME204 型电子天平(梅特勒-托利多仪器有限公司);VORTEX-3 型漩涡混合器(德国IKA 公司);气浴恒温振荡器(金坛市精达仪器制造有限公司);SB-5200DTN 型超声波清洗机(宁波新芝生物科技股份有限公司);BUCHI R-300 旋转蒸发仪(北京海富达科技有限公司);GT10-1 型高速台式离心机(北京时代北利离心机有限公司);LC-20AT 高效液相色谱仪(日本shimadzu株式会社)。
1.1.3 试药
丹参素对照品(批号:DST170420-015,纯度:HPLC≥98.0%)、对羟基苯甲酸对照品(批号:DST170506-114,纯度:HPLC≥99.0%)、香草酸对照品(批号:DST180516-088,纯度:HPLC≥98.0%)、对香豆酸对照品(批号:DST171206-057,纯度:HPLC≥99.0%),均由成都德斯特生物技术有限公司提供,用于含量测定。乙腈和甲醇为德国默克公司生产的色谱纯,盐酸为优级纯,乙酸乙酯等试剂为分析纯,水为怡宝纯净水。
1.2 方法
1.2.1 对照品溶液的制备
分别精密称取减压干燥至恒重的丹参素、对羟基苯甲酸、香草酸、对香豆酸对照品适量,其中丹参素用50%甲醇溶液溶解,其余对照品用纯甲醇溶解,并制成质量浓度分别为916.0、517.0、507.0、502.0 ug/mL的对照品贮备液。
1.2.2 供试品溶液的制备
取土样(过100目筛)10.0 g,精密称定,置50 mL离心管中,精密加入2 mol/L NaOH 溶液25 mL,漩涡混匀,置于25℃摇床中,以200 r/min 震荡12 h,取出,放至室温,静置2 h,于4 000 r/min 离心15 min,分离后上清液用12 mol/L HCl 调pH 至2.5,沉淀出胡敏酸,超声震荡10 min 后静置2 h,过滤。取上清液,采用乙酸乙酯萃取5次,收集上层萃取液,合并,置于45℃旋转蒸发仪上旋转蒸发至干,将残渣溶解并用甲醇定容于2 mL 棕色量瓶中,过0.22 μm 微孔滤膜,即得。
1.2.3 色谱条件
色谱柱为Diamonsil C18(2)(250 mm×4.6 mm,5 μm);流动相为A 相为乙腈,B 相为1%冰醋酸溶液,等度洗脱A:B=25:75;检测波长为280 nm;流速为0.8 mL/min;进样量为15 μL;柱温为30℃。样品及对照品色谱图见图1。

图1 混合对照品(A)及样品(B)的HPLC图谱Fig.1 HPLC spectra of mixed reference substance(A)and sample(B)
1.2.4 标准曲线的制作
精密量取1.2.1 节下4 种酚酸对照品贮备液适量,逐级稀释,摇匀,制得不同质量浓度的混合对照品工作液,按照1.2.3 节色谱条件下进样分析,计算峰面积。以4 种酚酸对照品的峰面积(Y)与其相应的质量浓度(X,μg/mL)绘制标准曲线。
1.2.5 精密度实验
取1.2.4 节下同一混合对照品溶液,按1.2.3 节色谱条件连续进样6 次,计算4 种酚酸类成分峰面积的相对标准偏差(Relative standard deviation,RSD)。
1.2.6 重复性试验
精密称取土壤(贵州安顺,AM2)10.0 g,依据1.2.2节供试品溶液制备方法制得滇重楼根际土壤酚类化合物待测液,平行制备6份,依据1.2.3节色谱条件进样测定,计算4种酚酸类成分峰面积的RSD。
1.2.7 稳定性试验
精密称取土壤(贵州安顺,AM2)10.0 g,依据1.2.2 节供试品溶液制备方法制得滇重楼根际土壤酚类化合物待测液,依据1.2.3节色谱条件对同一样品分别在0、4、8、12、16、24 h 进样测定,计算4 种酚酸类成分峰面积的RSD。
1.2.8 加样回收率试验
根据本实验方法,分别精密称取6 份已知含量的滇重楼根际土壤5.0 g(贵州安顺,AM2),精密加入4 种酚酸对照品适量,依据1.2.2 节供试品溶液制备方法制得滇重楼根际土壤酚类化合物待测液,依据1.2.3 节色谱条件下进样测定,分别计算4 种酚酸类成分的加标回收率和RSD。
1.3 数据处理
采用Microsoft Excel 2003 软件对测定数据进行处理,4 种酚酸的含量以±s表示,并基于SPSS 22.0软件对9 份滇重楼根际土壤的4 种酚酸含量进行主成分分析和相关性分析。
2 结果与分析
2.1 提取方法优选
本研究结合文献[11-13]对土壤样品的提取方式、提取溶剂、萃取方式分别进行了优选,以丹参素、对羟基苯甲酸、香草酸、对香豆酸的含量为指标,首先进行提取方式(振荡、超声)的考察,结果显示振荡提取法的提取率高于超声提取法;而后进行不同类型提取溶剂(不同体积比甲醇、不同质量浓度氢氧化钠)比较,结果显示2 mol/L NaOH 溶液提取率最佳且色谱基线较为平稳;最后对萃取溶剂(乙酸乙酯、石油醚)及次数进行比较,结果显示采用乙酸乙酯萃取5次能保证样品萃取完全。
2.2 色谱条件优选
本研究对色谱条件的检测波长、流动相、色谱柱分别进行了优选。首先通过紫外吸收光谱全波长扫描,发现丹参素、对羟基苯甲酸、香草酸、对香豆酸4 个酚酸在280 nm 处有最大吸收,最终确定“1.2.3”节下的色谱条件;而后考察了乙腈-1%冰醋酸水溶液、乙腈-2%冰醋酸水溶液、乙腈-1%甲酸水溶液及甲醇-1%冰醋酸水溶液4 种流动相系统,结果显示在乙腈-1%冰醋酸水溶液系统下,4 种酚酸均得到较好的分离且基线平稳、峰形对称;最后对 色 谱 柱Diamonsil C18(2)(250 mm × 4.6 mm,5 μm)、Durashell C18(250 mm × 4.6 mm,5 μm)、Venusil ASB C18(250 mm × 4.6 mm,5 μm)等进行考察,最终确定Diamonsil C18(2)色谱柱,各色谱峰可达到理想的分离效果。
2.3 方法学验证
2.3.1 标准曲线
丹参素、对羟基苯甲酸、香草酸、对香豆酸等4种酚酸的标准曲线分别为:Y=9 961.5X+85 076,R2=0.999 2;Y=34 024X+15 846,R2=0.999 7;Y=37 360X-13 231,R2=0.999 7;Y=93 109X+48 749,R2=0.999 8。4 种酚酸的质量浓度分别在15.3~458.0、3.4~103.4、3.4~101.8、6.7~200.8 μg/mL 线性范围内线性关系良好。
2.3.2 精密试验
丹参素、对羟基苯甲酸、香草酸、对香豆酸等4种酚酸色谱峰峰面积的RSD 值分别为0.39%、0.28%、0.72%和0.22%,表明本实验的测定方法精密度良好。
2.3.3 重复试验
丹参素、对羟基苯甲酸、香草酸、对香豆酸等4种酚酸色谱峰峰面积的RSD 值分别为0.65%、2.83%、0.12%和2.80%,表明本实验所用测定方法的重复性良好。
2.3.4 稳定试验
丹参素、对羟基苯甲酸、香草酸、对香豆酸等4种酚酸色谱峰峰面积的RSD 值分别为2.49%、2.01%、0.62%和2.40%,表明4 种酚酸在24 h 内稳定性良好。
2.3.5 加标回收试验
如表1所示,4种酚酸组分的加标平均回收率在98.12%~100.03%之间,RSD 为1.65%~2.97%,均小于3.0%,表明本实验所用测定方法回收率高,结果准确可靠,可用于滇重楼根际土壤中酚酸的含量测定。
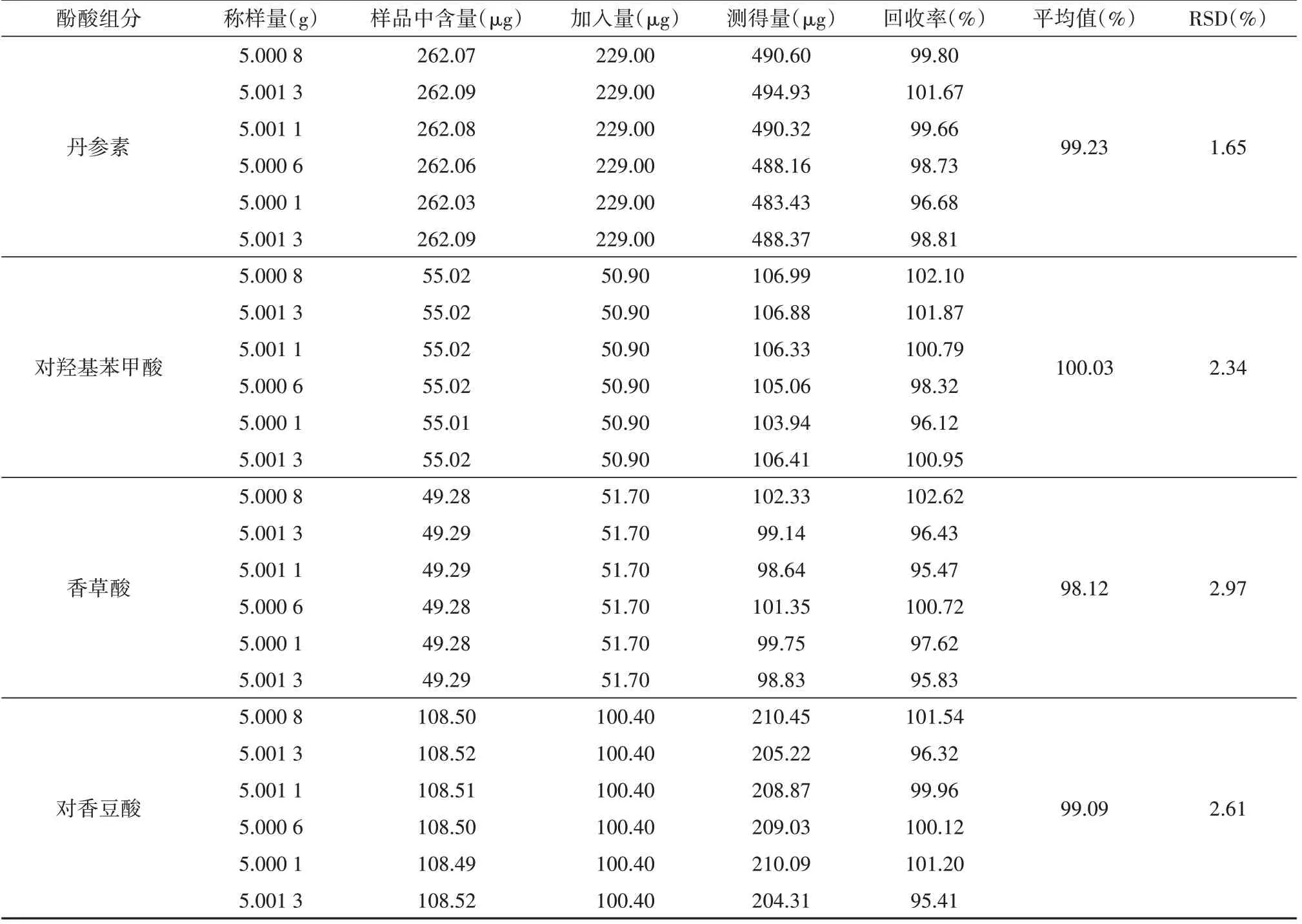
表1 加标回收试验结果Tab.1 Results of standard addition recovery test (n=6)
2.4 大田接种不同AM 真菌混合处理对滇重楼根际土壤中酚酸类成分分析
精密称取3 个不同产地、不同处理组滇重楼根际土壤10.0 g,依据1.2.2 节供试品溶液制备方法制得根际土壤酚类化合物待测液,平行制备6份,依据1.2.3 节色谱条件进样测定,计算4 种酚酸类成分的含量,结果见表2。结果显示,不同栽培地点下不同处理组中的滇重楼根际土壤酚酸含量具有显著性差异(P<0.05),其中丹参素含量最高,为41.50~64.08 μg/g,平均值为50.74 μg/g;其次是对香豆酸,含量为2.46~21.70 μg/g,平均值为10.71 μg/g;对羟基苯甲酸含量为6.73~12.23 μg/g,平均值为9.17 μg/g;香草酸含量为4.55~10.81 μg/g,平均值为7.25 μg/g。
表2 不同栽培条件下滇重楼根际土壤中酚酸含量Tab.2 Content of phenolic acid in rhizosphere soil of P. polyphylla var. yunnanensis under different cultivation condition(±s,n=3,μg/g)

表2 不同栽培条件下滇重楼根际土壤中酚酸含量Tab.2 Content of phenolic acid in rhizosphere soil of P. polyphylla var. yunnanensis under different cultivation condition(±s,n=3,μg/g)
处理组AM1 AM2 CK试验基地重庆万州贵州安顺云南保山重庆万州贵州安顺云南保山重庆万州贵州安顺云南保山丹参素53.03±2.38c 57.42±2.23b 41.70±0.10e 54.71±2.82bc 52.40±0.74cd 41.50±0.80e 64.08±2.28a 49.33±2.30d 42.50±0.81e对羟基苯甲酸7.43±0.28ef 12.23±0.85a 6.73±0.35f 8.00±0.23de 11.00±0.05b 8.91±0.12c 8.56±0.59cd 10.54±0.46b 9.12±0.09c香草酸6.49±0.22d 10.81±0.66a 4.55±0.25f 6.58±0.22d 9.86±0.29b 4.91±0.14ef 7.43±0.36c 9.46±0.20b 5.18±0.06e对香豆酸2.46±0.04g 19.14±0.18b 9.38±0.17f 2.46±0.03g 21.70±0.45a 10.09±0.34e 2.51±0.19g 17.86±0.19c 10.80±0.12d总计69.41±1.62ef 99.60±2.57a 62.36±0.52g 71.75±2.54e 94.96±0.84b 65.41±0.63fg 82.58±3.37d 87.19±2.54c 67.60±0.76f
2.5 主成分分析
通过SPSS 22.0统计软件进行主成分分析,如表3 所示,从4 个酚酸组分中提取出2 个主成分(特征值>1),第1 个主成分的特征值为2.66,贡献率为66.58%,其中特征向量值最大的是对羟基苯甲酸,其次是香草酸。第2 个主成分的特征值是1.22,贡献率为30.44%,其中特征向量值最大的是丹参素。2 个主成分累积贡献率为97.02%,表明这2 个主成分能反映AM 真菌对滇重楼根际土壤不同处理组的基本特征。

表3 不同产地滇重楼根际土壤中酚酸的主成分分析Tab.3 Principal component analysis of phenolic acids in rhizosphere soils of P. polyphylla var. yunnanensis from different producing areas
2.6 相关性分析
对不同栽培地点不同处理组滇重楼根际土壤中酚酸含量进行相关性分析,结果见表4。结果显示,根际土壤中4种酚酸存在一定的相关性,主要表现为对羟基苯甲酸与香草酸和对香豆酸呈极显著正相关(r=0.853、0.826,P<0.01),丹参素和香草酸呈显著正相关(r=0.601,P<0.05),香草酸和对香豆酸呈显著正相关(r=0.650,P<0.05),表明滇重楼根际土壤中4种酚酸的次生代谢相互之间具有一定的促进作用。

表4 不同产地滇重楼根际土壤中酚酸的相关系数Tab.4 Correlation coefficient of phenolic acid in rhizosphere soil of P. polyphylla var. yunnanensis from different producing areas
3 讨论
药用植物在目前的栽培生产模式下,自毒物质可能是造成其连作障碍的主要原因之一,自毒物质是药用植物的次生代谢产物,主要为水溶性的酚酸类物质等,可造成产量和品质的下降[14]。酚类物质是药用植物最广泛的次生代谢产物之一,AM 真菌能诱导药用植物产生酚类物质并调节其生物合成,且受生境条件的影响较大[5,8]。本研究结果显示,不同栽培地点的不同AM 真菌处理组与CK 组相比,在模拟大田栽培条件过程中,重庆万州和云南保山滇重楼根际土壤中丹参素、对羟基苯甲酸、香草酸、对香豆酸含量及其总含量呈现下降趋势,根际土壤中酚酸物质的积累表现出较强的抑制作用,而贵州安顺则呈现增加趋势,表现出较强的促进作用,这与张华等[5]研究结果类似。
据报道,土壤微生物数量与酚酸成分含量存在密切的相互影响关系[15]。课题组前期报道了在接种AM真菌后,滇重楼根际土壤中3类微生物的数量均显著高于CK 组,贵州安顺栽培滇重楼根际土壤相同处理组的真菌数量高于其余2 个栽培地点,而细菌、放线菌则相反,因此降低了贵州安顺栽培地点的微生物丰度[10],因此,贵州安顺栽培地点的滇重楼可能受到根际土壤微生物种群的改变,从而导致本栽培地点呈现出根际土壤酚酸物质增加的趋势,其相互之间的作用机制有待下一步深入探究。
值得一提的是,滇重楼需要7 年以上生长才能收获成药材,其生长发育及其土壤环境变化是个漫长的动态过程。由于本研究是对3 个栽培地点1 年的观察结果,栽培的环境条件每年均有所差异,仅在滇重楼适生区局部试验,只能代表调查结果,因此,还需要在盆栽和模拟大田条件下进行更长时间、更多栽培区域的考察,以及在盆栽条件下对外源酚酸功能进行验证,在“滇重楼-土壤-环境”系统才能得出更为确切的结论。
4 结论
本研究在前人基础上,同时对提取方法、色谱条件进行了试验,筛选出能够快速检测滇重楼根际土壤中4种酚酸(丹参素、对羟基苯甲酸、香草酸、对香豆酸)含量的方法,且方法简便准确、重复性高、分离效果好,能够准确、快速地测定土壤中4种酚酸含量。同时比较了3 个栽培地点的不同AM 真菌处理组滇重楼根际土壤中酚酸成分的差异性,有待进一步将AM 真菌与土壤酚酸之间的相关性做深入研究,更好地为开展缓解滇重楼化感自毒作用和消减连作障碍提供理论依据。

