辛伐他汀通过介导衰老巨噬细胞免疫促进成骨和成血管的研究
屈广平,赵宇宇,姚晓红,杭瑞强
(太原理工大学 材料科学与工程学院 医用金属材料山西省重点实验室,太原 030024)
以钛合金为代表的硬组织植入材料已广泛用于临床,以修复或重建受损的硬组织功能,并且在青少年和中年人中有很高的成功率,但老年人的成骨活性较弱,导致骨整合能力差,植入失败的风险仍然相对较高[1]。影响成骨活性的因素有很多,其中由免疫细胞介导的骨免疫微环境起着关键作用。巨噬细胞是具有高度可塑性的主要免疫效应细胞,参与骨修复和再生的各个阶段[2]。它们可以极化为促炎的M1和促组织愈合的M2表型,这两种表型对于骨再生和植入材料的骨整合都非常重要。M1型巨噬细胞分泌炎性细胞因子,如IL-6、IL-1β和TNF-α等,以对抗细菌感染并诱导破骨细胞生成,而M2型巨噬细胞分泌多种成骨和成血管细胞因子,如BMP-2和VEGF等,以加速骨再生[3]。对于青少年和中年人的正常巨噬细胞,它们可以在骨整合过程中及时从M1表型转换为M2表型。然而,对于老年人体内的衰老巨噬细胞来说,这种转换通常会发生延迟,从而导致长时间的炎症并使骨整合受到影响[4]。
衰老巨噬细胞的内质网应激(ERS)和线粒体功能障碍(MD)被认为是导致M1向M2转变延迟的两个主要原因。正常巨噬细胞因感染和氧化应激等外部刺激诱导的ERS,可通过未折叠蛋白反应(UPR)来缓解。然而,对于衰老巨噬细胞而言,UPR能力下降导致ERS无法及时缓解,促进NF-κB的激活和巨噬细胞典型M1标志物(TNF-α、IL-1β和i-NOS)的转录[5]。衰老还可以增加线粒体DNA(mtDNA)突变和活性氧(ROS)的产生,从而降低呼吸链活性和三磷酸腺苷的合成,最终导致MD[6].一方面,功能紊乱的线粒体通过增加胞浆Ca2+浓度和ROS产生来激活NLRP3炎性体。另一方面,功能紊乱的线粒体导致M2巨噬细胞的主要ATP来源——氧化磷酸化(oxphos)水平降低[5]。总的来说,ERS和MD倾向于将衰老的巨噬细胞维持在M1表型并阻止它们向M2表型转变。
所有细胞都可以控制其组分(例如蛋白质和细胞器)的质量以维持内稳态。一个重要的质量控制机制是自噬。自噬为一种分解代谢过程,可以降解细胞中功能失调或多余的成分以供自身重复使用[7]。自噬可以通过清除错误折叠的蛋白质或去除ER膜上的UPR传感器来缓解ERS[8].此外,线粒体自噬可以选择性地消除功能失调的线粒体[9]。然而,随着年龄的增长,细胞的自噬水平也会逐渐降低,无法缓解ERS和清除功能失调的线粒体以恢复细胞内稳态。
LUO et al[10]研究表明,Ti表面的微纳米结构可以通过激活ERK-Beclin-1自噬轴来促进巨噬细胞的M2极化。后续研究表明,负载银纳米粒子的TiO2纳米管可以通过激活自噬促进巨噬细胞的M2极化[11]。尽管已经取得上述进展,但钛表面形貌诱导的自噬相对较弱,并且银纳米颗粒的掺入可能会引起安全问题。相比之下,一些临床使用的药物可能更有效、更安全。辛伐他汀是一种降脂药物,在适当剂量下可有效降低心血管风险,且副作用低[12]。最近的研究表明,辛伐他汀可抑制肌细胞[13]、成骨细胞[14]、骨髓间充质干细胞[15]和软骨细胞[16]等的mTOR,使ULK1/2和Atg13去磷酸化,并进一步引发自噬体形成促进自噬[17]。至于巨噬细胞,之前的研究表明辛伐他汀可以增强氧化低密度脂蛋白诱导的巨噬细胞自噬[18],这表明辛伐他汀有望通过诱导衰老巨噬细胞的自噬恢复内稳态,促进其从M1型向M2型转变。
本文首先研究辛伐他汀浓度与衰老巨噬细胞活性、增殖、细胞骨架组装、氧化应激和极化之间的关系;然后,评估辛伐他汀刺激下衰老巨噬细胞营造的免疫微环境对骨髓间充质干细胞和内皮细胞功能的影响;最后,初步探索钛表面装载辛伐他汀介导衰老巨噬细胞功能的可行性。
1 实验
1.1 辛伐他汀对衰老巨噬细胞功能的影响
1.1.1药品
辛伐他汀(SIM)购自Adamas。SIM溶液以二甲基亚砜(DMSO,国药)为溶剂配制并在-20 ℃储存。实验过程中条件培养基含SIM浓度为0.001、0.01、0.1、1、10、100 μmol/L.
1.1.2细胞培养
小鼠单核巨噬细胞RAW264.7在补充有胎牛血清(FBS,Gibco)、青霉素(Solarbio)和链霉素(Solarbio)的DMEM(Gibco)中培养,细胞在实验过程中保存放置于37 ℃、5%(体积分数)CO2细胞培养箱中,通过吹打消化细胞。细胞按3×105cells/cm2密度接种6 h后,用含1.4 mmol/L的H2O2(Adamas)的培养基刺激2 h使细胞衰老,培养12 h后做后续实验。除衰老模型建立,其他实验中细胞密度不做特别说明都为5×104cells/cm2.
1.1.3细胞增殖
利用MTT法评估细胞增殖。将细胞在培养基中培养1和2天后,使用MTT(BBI)反应液染色,4 h后用DMSO溶解并在酶标仪492 nm波长下测定其吸光度值。
1.1.4细胞形态
将细胞接种衰老后利用倒置显微镜(IRM,尼康)拍摄细胞光学形貌。
1.1.5细胞活死
将细胞在培养基中培养1和2天后用活死荧光染色液(Invitrogen)37 ℃避光染色40 min,然后用激光共聚焦显微镜(CLSM,C2 plus,尼康)拍照。
1.1.6细胞骨架
将细胞在培养基中培养1天后用50 ng/mL的LPS(碧云天)活化刺激2 h,然后更换培养基继续培养12 h.之后用4%多聚甲醛固定细胞30 min,再用骨架染色液(Sigma)避光染色40 min,并用DAPI(Sigma)对细胞核进行复染,最后利用CLSM拍照。
1.1.7细胞ROS
利用活性氧检测试剂盒(碧云天)检测细胞内ROS水平。将巨噬细胞在培养基中培养1天后加入ROS染色试剂孵育20 min.洗涤后,用Hoechst 33342(碧云天)对细胞核进行复染。利用CLSM拍摄细胞活性氧荧光定性图片。最后通过NIH ImageJ 1.45软件定量分析每组的平均荧光强度。
1.1.8细胞免疫荧光
利用Anti-iNOS抗体(Abcam)和Anti-Mannose Receptor抗体(Abcam)染色检测巨噬细胞的极化。巨噬细胞在培养基中培养1天后,用4%多聚甲醛固定30 min,之后进行通透、封闭和一抗、二抗(i-NOS用555(红),CD206用488(绿))的孵育,最后用DAPI对细胞核进行复染,利用CLSM拍摄细胞免疫荧光定性图片。最后通过NIH ImageJ 1.45软件定量分析每组的平均荧光强度。
1.2 衰老巨噬细胞免疫微环境对衰老内皮细胞的影响
在内皮细胞实验过程中,细胞增殖、细胞形态和ROS与上文中实验方法一致。
1.2.1细胞培养
人脐静脉内皮细胞EA. Hy926与巨噬细胞培养条件相同。内皮细胞所用培养基为不同组巨噬细胞上清液和正常DMEM培养基1∶1配制。
将内皮细胞以4×104cells/cm2的密度接种培养24 h后更换含600 μmol/L的H2O2培养基刺激2 h使细胞衰老,培养12 h后做后续细胞实验。除衰老模型建立,其他实验中细胞密度不做特别说明都为1×104cells/cm2.
1.2.2内皮细胞NO
通过DAF-FM DA试剂盒(碧云天)检测内皮细胞的NO合成。将内皮细胞在条件培养基中培养2天后加入染色剂避光孵育30 min,通过CLSM观察并获取荧光照片。最后通过NIH ImageJ 1.45软件对荧光强度定量分析。
1.2.3内皮细胞成血管
使用ECMatrixTM(Millipore,美国)进行体外血管生成测定。将内皮细胞(6×104cells/cm2)和条件培养基混合均匀后加入基质胶中在37 ℃细胞培养箱中孵育4、8、12和18 h.到达指定时间后,使用IRM每组随机拍照6张以上图像。最后用Photoshop CC 2015软件对照片中出现的结、环和管的数量进行定量分析。
1.2.4内皮细胞迁移
使用划痕法检测内皮细胞的迁移能力。将内皮细胞以4×104cells/cm2的密度接种在24孔细胞培养板中培养24 h后,更换条件培养基继续培养2天。然后用移液器枪头在24孔板底部划出“十”字构建伤口愈合模型。加入无血清培养基继续培养0、6、12和24 h后,通过IRM拍摄细胞迁移情况,并使用Photoshop CC 2015软件定量分析。
1.3 衰老巨噬细胞免疫微环境对衰老干细胞的影响
在干细胞实验过程中,细胞增殖、形态和ROS与上文中实验方法一致。
1.3.1细胞培养
大鼠骨髓间充质干细胞来源于3周龄大鼠股骨和胫骨骨髓。本文中使用的干细胞为第2-4代。将干细胞在补充有胎牛血清、青霉素和链霉素的α-MEM(Gibco)中培养,细胞在实验过程中保存放置于37 ℃、5%CO2细胞培养箱中。消化和培养方式与内皮细胞相同。实验过程中所用成骨诱导培养基为在完全培养基的基础上加入10 mmol/L β-甘油磷酸钠(Solarbio)、50 μg/mL抗坏血酸(Sigma)和10 nmol/L地塞米松(Sigma).
将干细胞以1×104cells/cm2密度接种培养24 h后更换含100 μmol/L的H2O2培养基刺激2 h,诱导干细胞进入衰老状态。除非另有说明,否则在以下实验中接种的细胞密度均为1×104cells/cm2.
1.3.2干细胞胶原分泌
干细胞分泌I型胶原蛋白的定性和定量分析通过天狼星红(Sigma)染色来评估。将干细胞在正常培养基中培养3天后,用成骨诱导培养基继续培养7和14天。所有样品两天更换一次培养基同时加入巨噬细胞上清,两者比例为1∶1(体积比)。在每个时间点,用4%多聚甲醛固定30 min后加入天狼星红染色剂避光染色18 h,然后用醋酸(国药)漂洗干净,再利用体视显微镜观察拍照获取干细胞胶原分泌的定性结果。将孔板回收,并用由0.2 mmol/L NaOH(天津光复)和甲醇(天津风船化学试剂)1∶1(体积比)混合配制的洗脱液对胶原蛋白进行洗脱。避光处理30 min,使用酶标仪在570 nm波长下测定其吸光度。
1.3.3干细胞基质矿化
干细胞的细胞外基质矿化水平通过茜素红(Sigma)染色法来评估。将干细胞在正常培养基中培养3天后,用成骨诱导培养基继续培养14和21天。所有样品两天更换一次培养基,同时加入巨噬细胞上清,两者比例为1∶1(体积比)。在每个时间点,用75%乙醇(天津光复)固定细胞1 h,然后加入茜素红溶液避光染色30 min,用去离子水漂洗干净后利用体视显微镜观察拍照获取干细胞矿化水平的定性结果。用10 mmol/L磷酸钠洗脱液(含10%西吡氯铵(阿拉丁))对矿化产物进行洗脱。室温避光处理2 h后,使用酶标仪在570 nm波长下测定其吸光度。
1.4 钛表面装载辛伐他汀对衰老巨噬细胞的影响
1.4.1样品制备
将钛片用丙酮、乙醇和去离子水超声10 min,然后用35%盐酸(国药)60 ℃下酸蚀35 min,再用去离子水超声清洗10 min并烘干。用10 mmol/L Tris-buffer(生工)配制1 mg/mL的多巴胺(生工)溶液,并用NaOH调pH至8.5.将酸蚀后的样品避光浸泡12 h,去离子水冲洗并干燥。
将2%壳聚糖(生工)和4%明胶(生工)加入1.5%醋酸溶液,55 ℃搅拌至完全溶解,加入交联剂京尼平(阿拉丁)继续搅拌1 h,然后混入不同量的辛伐他汀药物震荡搅拌均匀,最终浓度为0.1、1、10、100、1000 μmol/L,取100 μL混合药物的水凝胶均匀涂覆在接好多巴胺的钛片上,在37 ℃恒温箱中静置4 h,待其成为水凝胶膜结构后用紫外线照射杀菌备用。
1.4.2细胞实验
在本实验过程中,细胞培养、细胞增殖和细胞活死与上文中巨噬细胞实验方法一致。
1.5 组别说明
本文中所有组别名称及处理历史见表1.

表1 样品组别说明Table 1 Group descriptions of samples
1.6 统计分析
所有生物实验数据均取自3个平行试样,采用平均值±标准差(SD)的形式表达。利用IBM SPSS 14.0软件对实验结果进行统计学差异分析。所有图中*表示p<0.05为有统计学差异,**表示p<0.01为有显著统计学差异,***表示p<0.001为有极其显著的统计学差异。
2 结果
2.1 衰老巨噬细胞对辛伐他汀的生物学响应
图1(a)为用于建立衰老巨噬细胞模型的增殖柱状图。正常细胞比衰老细胞对应的吸光度值高12%左右。图1(b)、(c)分别为正常和衰老巨噬细胞ROS荧光图像。从图中可以看出,衰老细胞比正常细胞的ROS荧光强度明显增强。图1(d)、(e)分别为正常和衰老巨噬细胞的光学形貌图。可以看出,衰老组细胞较正常组偏大。以上结果表明,衰老巨噬细胞模型已成功建立。

(a) 正常和衰老巨噬细胞增殖柱状图;(b) 正常巨噬细胞ROS染色图像;(c) 衰老巨噬细胞ROS染色图像;(d) 正常巨噬细胞光学形貌图;(e) 衰老巨噬细胞光学形貌图图1 衰老巨噬细胞模型的建立Fig.1 Establishment of senescent model of macrophages
图2为不同辛伐他汀浓度对巨噬细胞活力影响的荧光染色图。其中,活细胞为绿色,死细胞为红色。从图中可以看出,正常细胞的活力和增殖均显著高于衰老细胞。衰老细胞中,随着药物浓度的增大,细胞活力和增殖逐渐改善,且在0.1 μmol/L时达到最大。更高的药物浓度显著抑制细胞的活力,并且诱导细胞凋亡。

图2 巨噬细胞的活死染色图像Fig.2 Live/dead staining images of macrophage
图3为不同辛伐他汀浓度对巨噬细胞增殖的影响。正常细胞的增殖速率显著高于衰老细胞。低浓度药物可以有效促进衰老细胞增殖,当药物浓度为0.1 μmol/L时,衰老细胞活性显著增加,但当药物浓度继续增加时,反而抑制细胞增殖。特别是10 μmol/L和100 μmol/L组,第2天的吸光度值显著低于第1天,说明高浓度药物刺激会诱导细胞凋亡。

图3 巨噬细胞MTT定量结果Fig.3 MTT quantitative results of macrophages
图4为巨噬细胞在不同浓度的辛伐他汀刺激下的细胞骨架荧光染色图片。一般情况下,M0表型巨噬细胞呈现为经典的圆形,M1表型巨噬细胞为有伪足的圆形,而M2表型巨噬细胞为梭形。从图中可以看出,正常细胞和衰老细胞表现为圆形或星形。对于衰老细胞,低浓度药物使细胞逐渐表现为梭形,0.1 μmol/L组能观察到细胞丝状伪足,表明巨噬细胞铺展状态良好且倾向于M2型极化。当药物浓度过高时,细胞又表现为圆形。
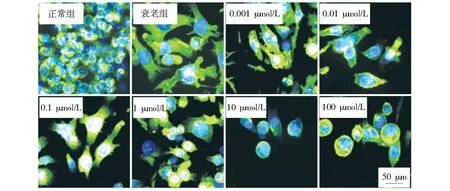
图4 巨噬细胞的骨架荧光图像Fig.4 Fluorescence images of macrophage cytoskeleton
图5为不同辛伐他汀浓度对巨噬细胞内ROS(绿色)水平影响的定性(a)和定量(b)图。从图中可以看出,低浓度药物能够减少巨噬细胞氧化应激水平,0.01 μmol/L组和0.1 μmol/L组对比衰老细胞荧光强度明显降低,而当药物浓度继续升高时,氧化应激水平提高。

图5 巨噬细胞ROS荧光图像(a)及定量结果(b)Fig.5 Fluorescence images (a) and quantitative results (b) of macrophage ROS
图6为巨噬细胞i-NOS(M1标志物)免疫荧光染色图像(a)及定量(b)结果。结果表明,衰老细胞高表达i-NOS(红色),因此为典型的M1型巨噬细胞。加入辛伐他汀后,i-NOS的表达不同程度地降低。随着药物浓度的增加,衰老巨噬细胞i-NOS表达强度先减少后增加,当药物浓度为0.1 μmol/L时,荧光强度最低,表明其极化为M1型的倾向最低。

图6 巨噬细胞i-NOS荧光图像(a)及定量结果(b)Fig.6 Fluorescence images (a) and quantitative results (b) of macrophage i-NOS
图7为巨噬细胞在不同辛伐他汀浓度刺激下CD206(M2标志物)的免疫荧光染色图像(a)及定量(b)结果。所有组的巨噬细胞均表达CD206,但加入药物之后,CD206的表达水平更高,表明其M2型极化趋势更为明显。随着药物浓度的增加,CD206的表达强度与i-NOS相反,当药物浓度达到0.1 μmol/L时,荧光强度最高。说明辛伐他汀能够改变衰老巨噬细胞极性,使其从促炎的M1型向促组织愈合的M2型转变。

图7 巨噬细胞CD206荧光图像(a)及定量结果(b)Fig.7 Fluorescence images (a) and quantitative results (b) of macrophage CD206
2.2 衰老内皮细胞对巨噬细胞免疫微环境的生物学响应
图8(a)为正常和衰老内皮细胞的增殖柱状图。正常细胞比衰老细胞的吸光度值高10%左右。图8(b)、(c)分别为正常和衰老内皮细胞的ROS荧光图像。从图中可以看出,衰老细胞的ROS水平显著高于正常细胞。图8(d)、(e)分别为正常和衰老内皮细胞的光学形貌图。可以看出,衰老组细胞较正常组偏大。以上结果表明,内皮细胞的衰老模型已成功建立。

(a) 正常和衰老内皮细胞增殖柱状图;(b) 正常内皮细胞ROS染色图像;(c) 衰老内皮细胞ROS染色图像;(d) 正常内皮细胞光学形貌图;(e) 衰老内皮细胞光学形貌图图8 内皮细胞衰老模型的建立Fig.8 Establishment of senescent model of endothelial cells
图9为衰老内皮细胞在衰老巨噬细胞上清液作用下的NO合成的定性(a)和定量(b)结果。可以看出,衰老内皮细胞的NO荧光强度较低,而巨噬细胞上清液可上调衰老细胞的NO合成。定量结果表明,与其他组相比,CS-0.1组可显著促进内皮细胞NO的合成。
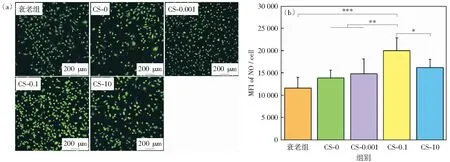
图9 内皮细胞NO荧光图像(a)及定量结果(b)Fig.9 Fluorescence images (a) and quantitative results (b) of NO secreted by endothelial cells
图10为内皮细胞体外成血管定性(a)和定量(b-e)结果。从图中可以看出,与衰老组和CS-0组相比,被药物刺激过的巨噬细胞上清液与内皮细胞共培养时,内皮细胞在4 h时就初步形成血管结点和小管,8~12 h时表现出更多节点的形成和更复杂的血管网络结构,并且在12 h时网状结构变大,边壁变厚。18 h时,网状结构恶化,发生塌陷,内皮细胞凋亡,只有CS-0.1组仍有少量血管网络结构和血管结点与小管。

图10 内皮细胞体外成血管光学图像(a)及定量结果(b-e)Fig.10 Optical images (a) and quantitative results (b-e) of in vitro angiogenesis of endothelial cells
图11为内皮细胞与巨噬细胞上清液共培养后的ROS定性荧光图像(a)和定量(b)结果。可以看出,未经处理的衰老细胞ROS荧光强度较高,加入未经药物刺激的衰老巨噬细胞上清液也没有显著性改善,但是辛伐他汀刺激的巨噬细胞上清液可以降低内皮细胞ROS的表达,缓解氧化应激,其中CS-0.1组效果最好。

图11 内皮细胞ROS荧光图像(a)及定量结果(b)Fig.11 Fluorescence images (a) and quantitative results (b) of ROS produced by endothelial cells
图12为内皮细胞在巨噬细胞上清液作用下迁移能力的定性(a)和定量(b)结果。衰老组和CS-0组之间没有显著性差异,加入药物刺激过的巨噬细胞上清液可以提高内皮细胞的迁移能力。在各个时间点,CS-0.1组相比较于其他组都表现出明显的促进作用。但当药物浓度过高时(CS-10组),又表现出对迁移的抑制作用。
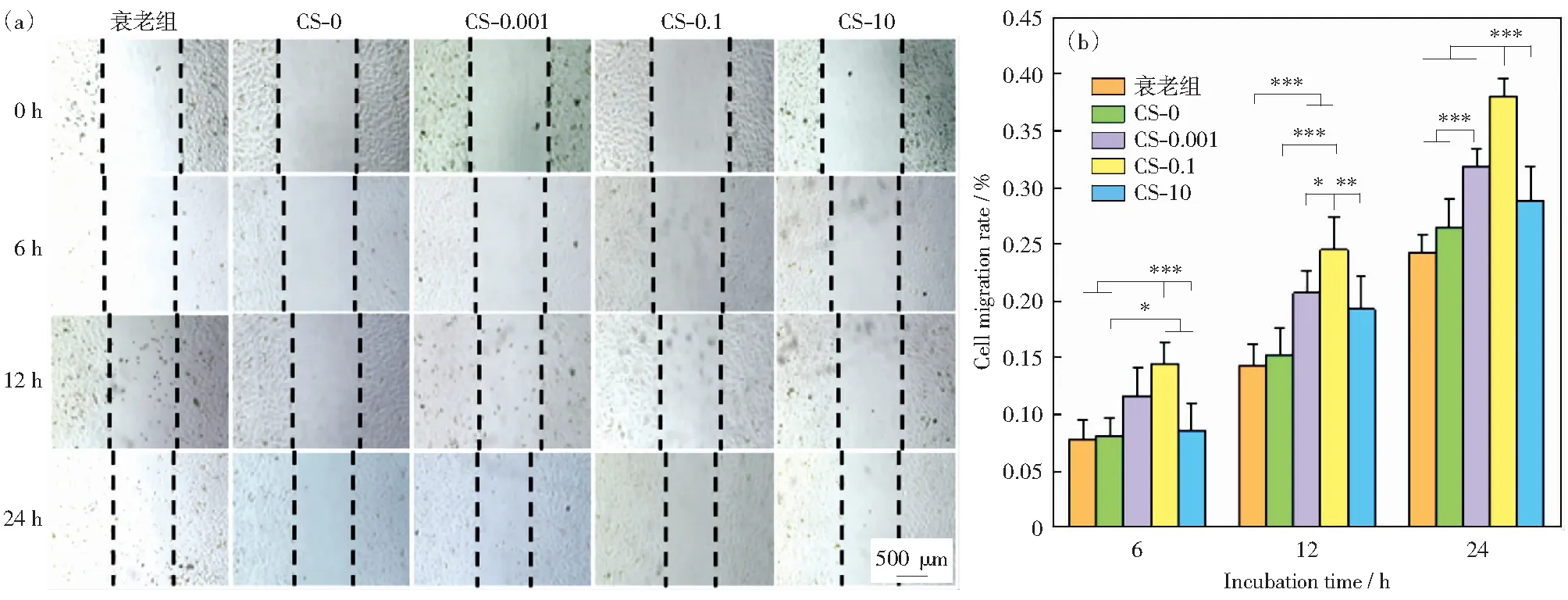
图12 内皮细胞迁移光学图像(a)及定量结果(b)Fig.12 Optical images (a) and quantitative results (b) of migration of endothelial cells
2.3 衰老干细胞对巨噬细胞免疫微环境的生物学响应
图13(a)为正常和衰老干细胞的增殖柱状图。正常细胞的吸光度值比衰老细胞高10%左右。图13(b)、(c)为正常和衰老干细胞的ROS荧光图像。从图中可以看出,衰老干细胞的ROS荧光强度相较于正常干细胞明显增强,说明氧化应激水平提高。图13(d)、(e)为正常和衰老干细胞的光学形貌图。衰老之后的细胞明显变大且表面粗糙有颗粒感,其中有一些细胞呈现未铺展状态。以上结果表明,干细胞的衰老模型已成功建立。
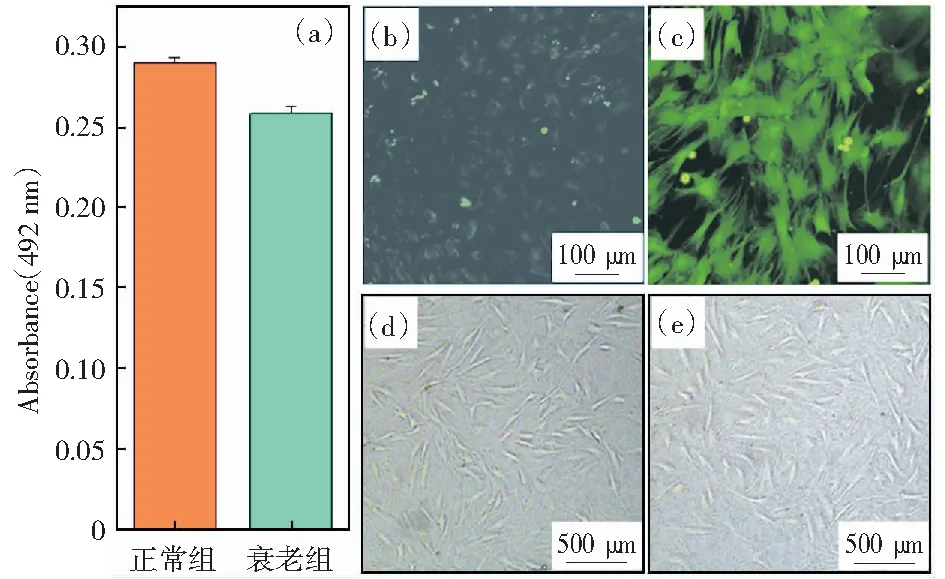
(a) 正常和衰老干细胞增殖柱状图;(b) 正常干细胞ROS染色图像;(c) 衰老干细胞ROS染色图像;(d) 正常干细胞光学形貌图;(e) 衰老干细胞光学形貌图图13 干细胞衰老模型的建立Fig.13 Establishment of senescent model of bone marrow mesenchymal stem cells
图14为干细胞在巨噬细胞上清液作用下Ⅰ型胶原分泌的定性(a)和定量(b)结果。在第7天时,与衰老细胞相比,加入巨噬细胞上清液都能够不同程度地促进胶原分泌。其中,CS-0.001和CS-0.1组效果最佳,CS-0和CS-10组无显著性差异。到第14天,加药组之间没有显著性差异,CS-0.1组相比较于CS-0组有效促进胶原分泌。
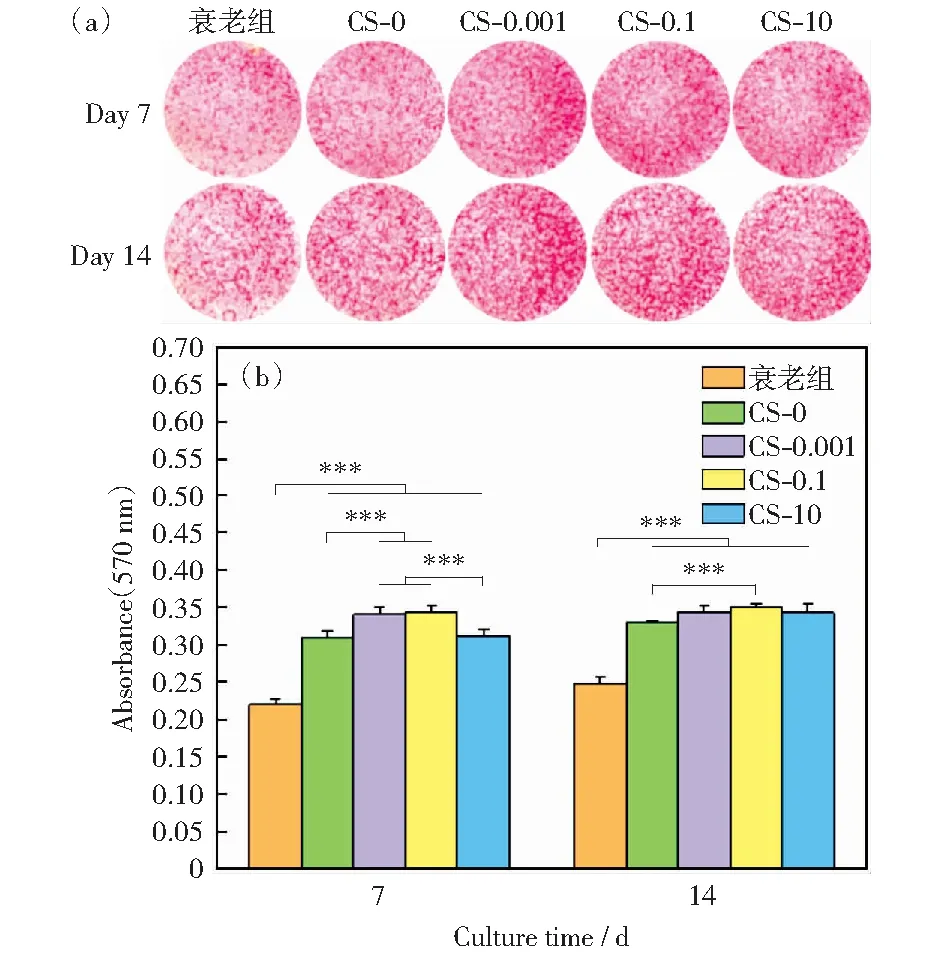
图14 干细胞Ⅰ型胶原分泌定性图像(a)和定量结果(b)Fig.14 Qualitative images (a) and quantitative results (b) of type Ⅰ collagen secreted by bone marrow mesenchymal stem cells
图15为干细胞在巨噬细胞上清液作用下细胞外基质矿化的定性图像(a)和定量结果(b).从图中可以看出,在第14天时,加入巨噬细胞上清液可以有效提高衰老干细胞的基质矿化,其中CS-0和CS-0.001组间无显著性差异,CS-10组相比较于其他上清液组表现出轻微的抑制,CS-0.1组表现最好。在第21天时,衰老组和CS-10组之间无显著性差异,药物浓度过高抑制干细胞的矿化,CS-0.001和CS-0.1表现最好,钙沉积量最多。

图15 干细胞基质矿化定性图像(a)和定量结果(b)Fig.15 Qualitative images (a) and quantitative results (b) of ECM mineralization of bone marrow mesenchymal stem cells
图16为衰老干细胞的ROS定性荧光图像(a)和定量结果(b)。可以看出,对比加入巨噬细胞上清液的组别,未加上清液的衰老干细胞ROS荧光强度较高,不同辛伐他汀浓度刺激后的巨噬细胞上清液组别对比CS-0组ROS水平显著降低,其中CS-0.1组效果最好,荧光强度最低。

图16 干细胞ROS荧光图像(a)及定量结果(b)Fig.16 Fluorescence images (a) and quantitative results (b) of ROS produced by bone marrow mesenchymal stem cells
2.4 钛表面装载辛伐他汀对巨噬细胞的影响
图17为巨噬细胞在试样表面培养后的活死染色图像。从图中可以看出,各组均没有死细胞(红色)。在未经处理的钛片表面,和衰老细胞相比,正常细胞活细胞(绿色)数量多,单个细胞的绿色荧光强度高,说明细胞活力好。用凝胶装载药物后,细胞数量有所减少,但随着药物浓度的提高,细胞数量逐渐增加,Gel-1组达到峰值。

图17 巨噬细胞在试样表面的活死染色图像Fig.17 Live/dead staining images of macrophages cultured on sample surfaces
图18为巨噬细胞在试样表面培养后的MTT定量结果。从图中可以看出,在未经处理的钛片表面,正常细胞和衰老细胞相比,细胞增殖数量相差明显,第1天数量相差10%左右,第2天相差一倍以上。钛片表面负载药物后,细胞数量有所减少,但随着药物浓度的提高,细胞数量先增加后减少,到Gel-1达到峰值。培养2天后,未装载药物和装载药物的各组间没有显著性差异,说明装载药物促进巨噬细胞的增殖。
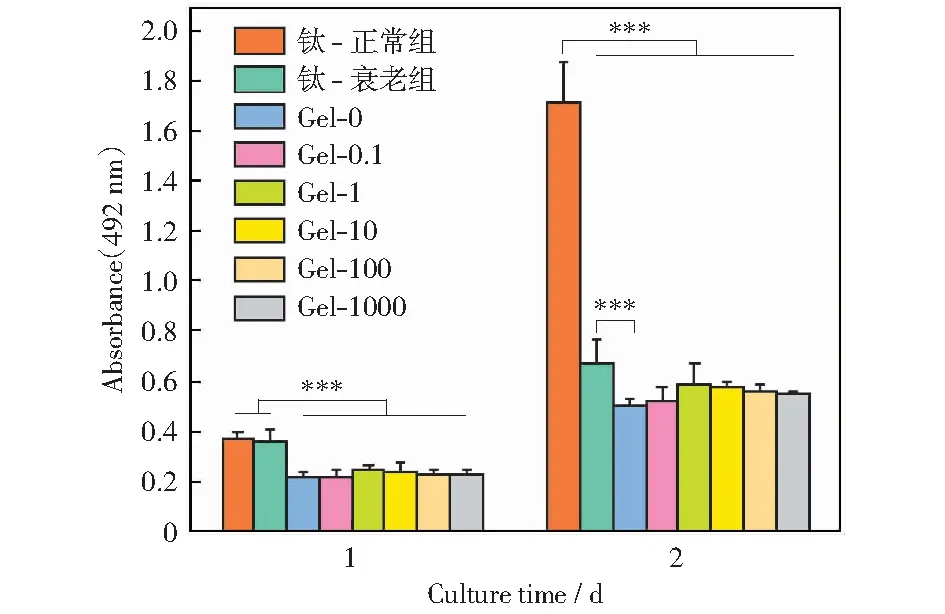
图18 巨噬细胞在试样表面的MTT定量结果Fig.18 MTT quantitative results of macrophages cultured on sample surfaces
3 讨论
植入体表面巨噬细胞从M1型到M2型的及时转变对于骨整合至关重要[19]。但是,对于老年人体内的衰老巨噬细胞,内稳态失衡会导致这种转变的延迟,从而使炎症阶段延长,无法顺利过渡到修复阶段,抑制骨整合的速度和质量。本文表明,0.1 μmol/L的辛伐他汀可以恢复衰老巨噬细胞的内稳态,从而促进其M1到M2表型的及时转变,且这种转变营造的免疫微环境促进干细胞的成骨分化和内皮细胞的成血管分化,而成骨和成血管是植入体骨整合的两个不可或缺的阶段。除此之外,钛表面装载辛伐他汀表现出很好的细胞相容性并促进巨噬细胞的增殖,为之后进一步探究植入体表面装载药物促进骨整合提供了参考。
衰老巨噬细胞通常表现为促炎的M1表型,其向促愈合的M2表型的转换比较困难,产生不利于骨再生和骨整合的促炎免疫环境[20]。造成这种现象的主要原因是自噬水平降低导致细胞内稳态失衡[7]。因此,通过诱导自噬来恢复衰老巨噬细胞的内稳态是一种很有前途的方法。本文使用一种临床降血脂药物辛伐他汀作为自噬诱导剂。发现0.1 μmol/L的浓度可促进衰老巨噬细胞的活力、增殖和M2型极化,降低胞内ROS水平。可以推测,辛伐他汀诱导的衰老巨噬细胞自噬在其中发挥关键作用。
接下来,本文研究在辛伐他汀刺激下由衰老的巨噬细胞营造的免疫微环境对干细胞和内皮细胞功能的影响。与巨噬细胞条件培养基一起孵育后,干细胞的I型胶原蛋白分泌和细胞外基质矿化上调。同时,条件培养基还能增强内皮细胞的迁移、NO合成和血管生成能力。这些结果表明,辛伐他汀可以使衰老巨噬细胞营造的促炎免疫微环境转变为促愈合的免疫微环境,从而促进成骨和成血管以及植入体骨整合。我们之前的工作表明,M2极化的巨噬细胞可以分泌多种细胞因子,如BMP-2、TGF-β1和VEGF[21-22]。BMP-2可以结合并激活干细胞膜上的丝氨酸/苏氨酸激酶受体,随后引发Smad1/5/8的募集和磷酸化。然后磷酸化的Smad1/5/8与Smad4结合形成异聚复合物并易位至细胞核中以触发Dlx5及其下游RUNX2和Osx的转录,从而启动干细胞的成骨分化[23]。TGF-β1也是一种成骨诱导剂,可上调具有PDZ结合基序(TAZ)的转录共激活因子在mRNA和蛋白质水平上的表达。TAZ可以作为RUNX2的共激活剂来抑制PPARγ2的表达,从而抑制干细胞的成脂分化能力[24]。VEGF是一种有效的促血管生成的细胞因子,其主要通过与内皮细胞膜上的VEGFR2结合,随后激活多种下游信号通路发挥作用。其中,PLCy-PKC-Ras-Raf-MEK-ERK1/2通路可以诱导内皮细胞的增殖,p38-MAPK和FAK-Paxillin通路促进内皮细胞迁移,PI3K-Akt/PKB通路促进内皮细胞存活,这些功能都对内皮细胞的血管生成至关重要[25]。
最后,本研究在钛表面构建壳聚糖/明胶涂层成功实现辛伐他汀的装载,壳聚糖/明胶涂层的厚度大约为20 μm,吸水溶胀后,涂层厚度可达到100 μm左右。关于辛伐他汀的释放,首先应为样品表面辛伐他汀的溶解,之后由于凝胶吸水膨胀以及明胶的水解,更多的药物逐渐暴露,进行低剂量的持续释放。由结果可知,药物装载量与衰老巨噬细胞的增殖和活力密切相关,说明该涂层可作为辛伐他汀的缓释涂层,有望通过药物的缓慢释放介导衰老巨噬细胞向M2型极化,营造促进组织修复的免疫微环境,促进钛植入体的骨整合。
4 结论
本文探究不同辛伐他汀浓度对衰老巨噬细胞功能的影响,并进一步研究其营造的免疫微环境对成骨和成血管功能的影响,以及钛表面装载辛伐他汀介导衰老巨噬细胞功能的可行性,得出以下结论:
1) 当辛伐他汀浓度低于0.1 μmol/L时,随浓度的增加巨噬细胞的增殖和活力水平提高,氧化应激水平降低,向促组织愈合的M2型极化,而浓度过高则诱导巨噬细胞凋亡。
2) 辛伐他汀可诱导巨噬细胞营造有利于组织愈合的免疫微环境,促进骨髓间充质干细胞的成骨分化和内皮细胞的成血管分化。
3) 钛表面的壳聚糖/明胶复合涂层可作为辛伐他汀的载体,通过药物的缓慢释放介导衰老巨噬细胞的免疫调节功能。

