锐尖山香圆基因组DNA 提取方法比较研究
刘小平,郭崇炎,周 蓉,周勇辉,罗素梅,廖海红,陶秀花
(1.赣州市蔬菜花卉研究所,江西 赣州 341404;2 赣州市蔬菜花卉种质资源开发与利用重点实验室,江西 赣州 341404;3.宜春学院生命科学与资源环境学院,江西 宜春 336000;4.江西九连山国家级自然保护区管理局,江西 赣州 341000;5.江西省农业科学院蔬菜花卉研究所,江西 南昌 330299)
锐尖山香圆(Turpinia arguta)为省沽油科(Staphyleaceae)山香圆属(Turpinia)落叶灌木,高可达3 m,俗名黄柿、尖树和五寸铁树[1],常生长于沟谷常绿阔叶林边缘或灌木丛下,野生分布主要在江西省、广东省、湖南省和福建省等地[2]。锐尖山香圆性寒味甘苦,具有清热解毒、利咽消肿的功效,对治疗咽喉炎、扁桃体炎和佐剂关节炎有显著疗效[3-4]。锐尖山香圆中的总黄酮是其药效的主要有效成分,其所含的女贞苷和野漆树苷也具有较强的药理活性[5]。医药市场上采用锐尖山香圆开发的产品包括山香圆片、山香圆颗粒和山香圆口服液等,药材需求量大[3,6]。
目前,学者们对锐尖山香圆的研究主要集中于其野外自然分布、药效成分分析和临床应用等方面[7-9],而关于其分子生物学方面的研究报道则甚少[10]。近十几年来,以锐尖山香圆为原料的相关药用产品不断开发,锐尖山香圆野生种质资源被掠夺式利用[11],高产高效新品种却一直没有培育出来。随着现代生物技术快速发展,分子生物遗传分析和改良也必将运用到锐尖山香圆的种质资源保护、遗传多样性分析和新品种选育中,而高质量基因组DNA 的获取则是开展锐尖山香圆分子生物学研究的重要前提。该试验通过对CTAB 法、SDS 法、高盐低pH 值法和尿素法提取锐尖山香圆DNA 的效果比较研究,获得了较为理想的锐尖山香圆基因组DNA 提取方法,为锐尖山香圆后续分子遗传学研究奠定了基础。
1 材料与方法
1.1 实验材料
锐尖山香圆植株绿色健康叶片(江西省农业科学院蔬菜花卉研究所提供)。
1.2 实验仪器与试剂
离心机(湖南湘仪);超微量紫外分光光度计(赛默飞世尔);恒温水浴锅(上海尚仪);凝胶成像仪(德国耶拿);PCR 仪(德国耶拿);水平电泳仪(北京六一);移液器(北京大龙)。
所用试剂中DNA Marker、限制性内切酶为宝日医生物技术(北京)有限公司产品,Taq Master Mix 为南京诺唯赞生物科技股份有限公司产品,其余均为国产分析纯试剂。
1.3 DNA 提取方法
1.3.1 CTAB 法
参考张宇等[12]的方法,并加以改进。取0.1 g 锐尖山香圆叶片用液氮研磨成粉末后立即加入1 mL 65℃预热提取缓冲液(2% CTAB、20 mmol·L-1EDTA.Na2、100 mmol·L-1Tris-HCl、1.5 mol·L-1NaCl、2%PVP-30,pH 8.0)和30 μL β-巯基乙醇,漩涡混匀30 s,65℃水浴30 min。12000 r·min-1离心10 min,吸取上清液。向上清液中加入等体积氯仿∶异戊醇(体积比24∶1),漩涡混匀。12000 r·min-1离心10 min,吸取上清液。向上清液中加入等体积-20℃预冷异丙醇,轻柔混匀,-20℃静置10 min。12000 r·min-1离心10 min,弃上清液,保留DNA 沉淀。加入700 μL 75%酒精,漂洗DNA 沉淀。12000 r·min-1离心5 min,弃上清液,保留DNA 沉淀。用75%酒精重复洗涤、沉淀DNA两次。吹干DNA 沉淀,加入100 μL TE 溶液溶解,放-20℃保存备用。
1.3.2 SDS 法
参考杨春霞等[13]的方法,并加以改进。取0.1 g 锐尖山香圆叶片加入液氮研磨成粉末后立即加入0.05 g PVP-30 粉末,装入2 mL 无菌EP 管中,加入1 mL 提取缓冲液(2% SDS、100 mmol·L-1Tris-HCl、50 mmol·L-1EDTA.Na2、1.5 mol·L-1NaCl)和30 μL β-巯基乙醇,混匀,65℃水浴30 min。再加入400 μL 5 mol·L-1乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。12000 r·min-1离心10 min,取上清液。向上清液中加入等体积氯仿∶异戊醇(体积比24∶1),混匀。12000 r·min-1离心10 min,取上清液。向上清液中加入等体积-20℃预冷异丙醇,轻柔混匀,-20℃静置10 min。12000 r·min-1离心10 min,弃上清液,保留DNA 沉淀。加入700 μL 75%酒精,混匀漂洗DNA 沉淀。12000 r·min-1离心5 min,弃上清液,保留DNA 沉淀。用75%酒精重复洗涤、沉淀DNA 两次。吹干DNA 沉淀,加入100 μL TE 溶液溶解,放-20 ℃保存备用。
1.3.3 高盐低pH 值法
参考许理文等[14]的方法,并加以改进。取0.1 g 锐尖山香圆叶片,用液氮研磨成细粉后加入到2 mL 无菌EP 管中。立即加入1 mL 65℃预热的提取缓冲液(100 mmol·L-1乙酸钠溶液、50 mmol·L-1EDTA.Na2、500 mmol·L-1NaCl、2% PVP-30,pH 5.5)和20 μL β-巯基乙醇,漩涡混匀30 s,65℃水浴30 min。12000 r·min-1离心10 min,取上清液。向上清液中加入400 μL 2.5 mol·L-1乙酸钾溶液(pH4.8),混匀,冰水浴10 min。12000 r·min-1离心10 min,取上清液。向上清液中加入等体积氯仿∶异戊醇(体积比24∶1),混匀。12000 r·min-1离心10 min,取上清液。向上清液中加入等体积的-20℃预冷异丙醇,轻柔颠倒混匀5 次后-20℃静置10 min。12000 r·min-1离心10 min,弃上清液,保留DNA 沉淀。加入700 μL 75%酒精,混匀漂洗DNA 沉淀。12000 r·min-1离心5 min,弃上清液,保留DNA 沉淀。用75%酒精重复洗涤、沉淀DNA 两次。吹干DNA 沉淀,加入100 μL TE 溶液溶解,放-20℃保存备用。
1.3.4 尿素法
参考白雪嵩等[15]的方法,加以改进。取样品0.1 g加入液氮研磨成粉末,装入2 mL 无菌EP 管中,立即加入1 mL 提取缓冲液(8 mol·L-1尿素、500 mmol·L-1NaCl、50 mmol·L-1Tris-HCl、20 mmol·L-1EDTA.Na2,2% PVP-40,pH 8.0)和20 μL β-巯基乙醇,混匀,65℃水浴30 min。加入400 μL 5 mol·L-1乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。向上清液中加入等体积氯仿∶异戊醇(体积比24∶1),混匀。12000 r·min-1离心10 min,取上清液。加入等体积-20℃预冷异丙醇,轻柔混匀多次,-20℃静置10 min。12000 r·min-1离心10 min,弃上清液,保留DNA 沉淀。加入700 μL 75%酒精,混匀漂洗DNA 沉淀;12000 r·min-1离心5 min,弃上清液,保留DNA 沉淀。用75%酒精重复洗涤、沉淀DNA 两次。吹干DNA 沉淀,加入100 μL TE 溶液溶解,放-20℃保存备用。
1.4 DNA 质量检测
1.4.1 DNA 浓度测定
用超微量紫外分光光度计测定4 种方法所提取基因组DNA 的OD260/280值、OD260/230值和DNA 浓度。采用Statistix 8.0 软件分析各处理间显著性差异(标记字母法,LSD0.05)。
1.4.2 琼脂糖凝胶电泳
分别吸取不同方法提取的DNA 样品6 μL 与6×Loading Buffer 4 μL 混匀,在1%琼脂糖凝胶上点样,在1×TAE 缓冲液中120 V 恒压电泳16 min 后,于凝胶成像仪上观察并拍照记录。
1.4.3 DNA 酶切
对4 种不同方法提取的DNA 分别采用EcoR I、Hind III 双酶切,酶切反应体系为:10×M Buffer 2 μL、EcoR I 1 μL、Hind III 1 μL、ddH2O 6 μL、DNA 10 μL。反应物轻柔混匀,37℃水浴反应2 h。1%琼脂糖凝胶点样、电泳检测,于凝胶成像仪上拍照记录。
1.4.4 ISSR-PCR 检测
采用ISSR UBC-807 引物(引物序列:AGAGAG AGAGAGAGAGT)对4 种方法提取DNA 进行PCR扩增,反应体系按照2×Rapid Taq Master Mix(P222,诺唯赞)说明书配制。PCR 反应程序为:95℃预变性5 min;95℃变性15 s;55℃复性15 s;72℃延伸20 s;循环33 次后,72℃延伸5 min;16℃保存。在1%琼脂糖凝胶上点样、电泳检测,于凝胶成像仪上拍照记录。
2 结果与分析
2.1 DNA 浓度检测
从表1 可知,SDS 法、CTAB 法提取的锐尖山香圆DNA OD260/280值分别为1.97、1.98,都在1.9~2.0 之间且两者无显著性差异,表明SDS 法、CTAB 法对RNA和蛋白质等大分子杂质去除得比较干净,DNA 纯度较高;高盐低pH 值法、尿素法提取的DNA OD260/280值分别为1.58、1.69,都小于1.8,表明蛋白质、RNA 等大分子杂质没有去除干净,影响了DNA 纯度。SDS 法提取的DNA OD260/230值大于2.0,CTAB 法、高盐低pH值法和尿素法提取的DNA OD260/230皆小于1.85,说明SDS 法去除小分子、酚类物质和盐等杂质的能力比CTAB 法、高盐低pH 值法和尿素法更强。就DNA 浓度和DNA 产率而言,SDS 法所达到的值最高,其次为高盐低pH 值法和CTAB 法,尿素法最低。

表1 4 种方法提取锐尖山香圆基因组DNA 结果Tab. 1 The results of genomic DNA extracted by four methods
2.2 琼脂糖凝胶电泳检测
从图1 可知,SDS 法、CTAB 法、高盐低pH 值法和尿素法都能成功提取出锐尖山香圆DNA。SDS 法提取的DNA 点样孔内无显著荧光出现,表明此方法已经将大多数蛋白质、糖类和RNA 等杂质去除,获得了较纯的DNA;高盐低pH 值法提取的DNA 点样孔中有显著的荧光,说明此方法去除蛋白质、糖类和RNA 等杂质能力较差。而其他2 种方法提取的DNA点样孔内都出现了一定程度的荧光,说明样品中还存在一定量的蛋白质、RNA 和糖类等杂质。这与表1 中检测结果相一致。
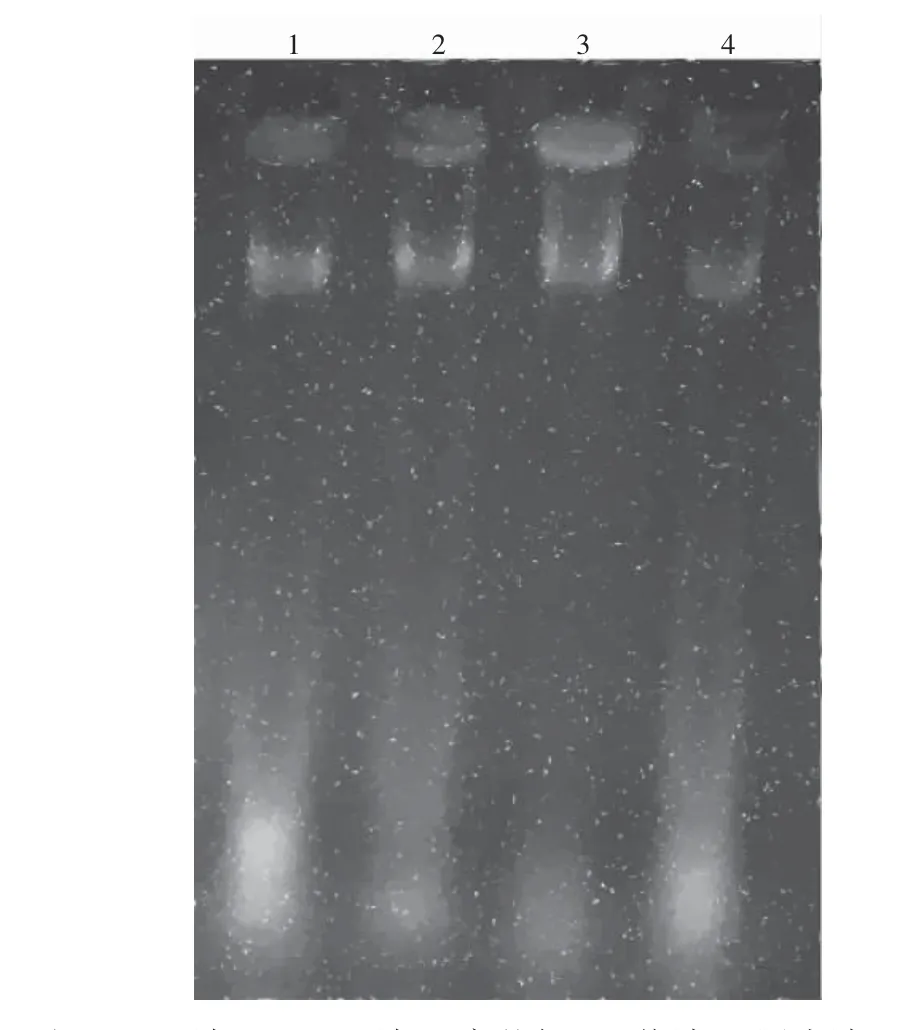
图1 4 种方法提取的基因组DNA 琼脂糖凝胶电泳Fig. 1 Agarose gel electrophoresis of genomic DNA extracted by four methods
2.3 酶切结果分析
对SDS 法、CTAB 法、高盐低pH 值法和尿素法这4 种方法提取的锐尖山香圆基因组DNA 分别进行EcoR I、Hind III 双酶切。图2 酶切结果显示,SDS 法提取的锐尖山香圆基因组DNA 酶切后呈弥散状,从低于100 bp 到高于2000 bp 之间形成清晰完整的连续拖带,条带最宽,且点样孔中无荧光,说明该方法提取的DNA 杂质含量少,DNA 质量最好。CTAB 法提取的DNA 经双酶切、电泳后,条带呈弥散状,有完整的连续拖带,点样空内无荧光,但条带宽度小于SDS 法所提取的,说明CTAB 法提取的锐尖山香圆质量次之。高盐低pH 值法和尿素法提取的DNA 酶切后低于750 bp 区间无显著连续拖带分布,在点样孔处都有显著荧光,表明这2 种方法提取的DNA 存在降解现象并含有蛋白质、多糖等杂质,DNA 质量较差。
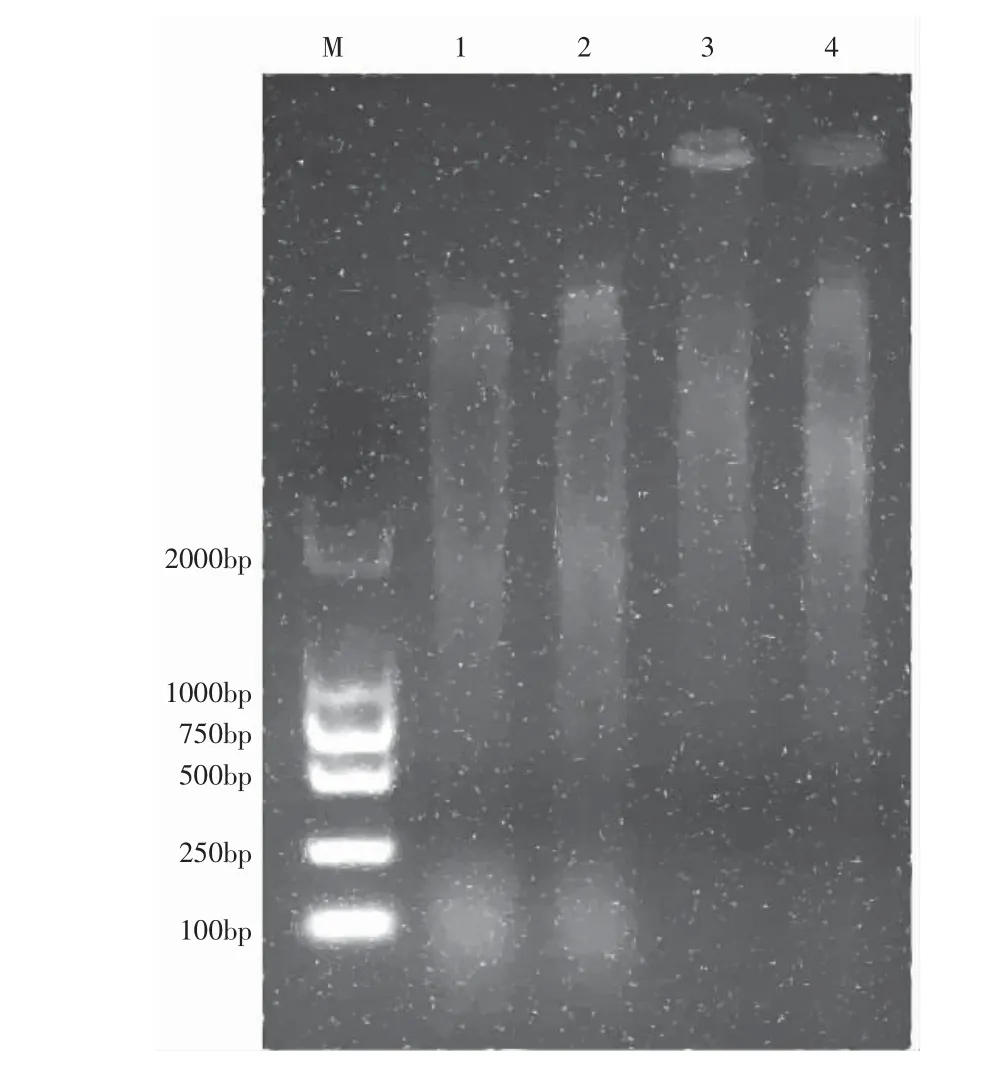
图2 4 种方法提取的基因组DNA 双酶切Fig. 2 Double enzyme digestion of genomic DNA extracted by four methods
2.4 ISSR-PCR 检测
分别以SDS 法、CTAB 法、高盐低pH 值法和尿素法提取的山香圆基因组DNA 为模板,用UBC-708引物进行ISSR-PCR 扩增,电泳跑胶,结果见图3。可知,4 种方法提取的DNA 经ISSR-PCR 扩增、电泳后分别都能在2200 bp、1500 bp 和760 bp 左右处各产生1 个条带。SDS 法相对另外3 种方法的3 个条带都更亮,CTAB 法在2200 bp 和1500 bp 处条带相对较亮、760 bp 处条带相对较暗,高盐低pH 值法和尿素法在2200 bp、1500 bp 和760 bp 左右条带相对SDS 法、CTAB 法都较暗,表明SDS 法提取效果最好,CTAB 法次之,高盐低pH 值法和尿素法较差。

图3 不同提取方法ISSR-PCR 扩增结果Fig. 3 ISSR-PCR amplification results of different extraction methods
3 结论与讨论
该研究采用的4 种方法都能提取出锐尖山香圆基因组DNA,但提取质量存在差别。4 种方法中SDS法和CTAB 法OD260/280值都在1.9~2.0 之间,尿素法和高盐低pH 值法OD260/280值都小于1.8,表明前两种方法对蛋白质和RNA 等大分子杂质去除的较干净,DNA 纯度较高,后两种方法所提DNA 则仍含有大分子杂质。4 种方法中仅有SDS 法OD260/230值大于2.0,表明SDS 法去除小分子、酚类物质和盐等杂质更为彻底。对DNA 进行琼脂糖凝胶电泳检测也得出了相同的结果。4 种方法提取的锐尖山香圆基因组DNA经过酶切验证后都能产生酶切条带、ISSR-PCR 检测也都能扩展出条带,但酶切和ISSR-PCR 检测条带存在差异,表明这4 种方法提取的DNA 虽然都可以进行分子生物学相关实验,但提取质量有高低。综合以上分析可知,不同方法提取锐尖山香圆基因组DNA质量从高至低依次为:SDS 法>CTAB 法>尿素法>高盐低pH 值法。
获得高质量的基因组DNA 是进行植物遗传多样性、功能基因分析和遗传育种等分子生物学研究的重要保障[16]。影响植物DNA 高质量提取的因素有很多,主要包括酚类物质、色素、多糖和蛋白质等,而木本植物叶片中一般富含酚类和多糖等次生产物,因此提取纯化植物DNA 的关键在于高效地除去酚类、多糖、蛋白质和色素等物质[17-18]。本研究中SDS 法提取的锐尖山香圆基因组DNA 浓度最高、纯度最好,完全可用于分子生物学方面的试验。相比于杨春霞等[13]的方法,该研究的SDS 法中直接将PVP-40 粉末与植物样本粉末立即混合,并显著提高PVP-40 用量,使PVP 快速充分地络合干扰DNA 纯度的多酚类物质,防止DNA 氧化褐变。在提取缓冲液中提高β-巯基乙醇用量,能防止DNA 断裂,可以更有效地破坏蛋白质中的肽链,从而降解植物蛋白质、抑制多种酶活性。氯仿/异戊醇抽提也能有效地除去脂类、蛋白质杂质。提取缓冲液中高浓度的NaCl 有利于去除多糖,再加入高浓度乙酸钾可以进一步防止多糖污染。
该研究对锐尖山香圆叶片基因组DNA 的提取方法进行了探索,比较了SDS 法、CTAB 法、高盐低pH值法和尿素法提取DNA 质量的差异。这4 种方法都能不同程度地去除蛋白质、多糖和酚类等杂质并成功提取出DNA,但SDS 法提取的DNA 质量和产率更佳,各项指标优于其他3 种方法,为后续锐尖山香圆分子生物学研究提供参考和借鉴。

