复方曲肽注射液治疗急性缺血性脑卒中400 例:多中心回顾性研究
刘 莹 于生元 顾 平 田军彪 贾延劼 姜 新 胡风云 何志义 杜怡峰 张祥建
1河北医科大学第二医院 河北 石家庄 050004;2中国人民解放军总医院 北京 100853;3河北医科大学第一医院 河北 石家庄 050030;4河北省中医院 河北 石家庄 050013;5郑州大学第一附属医院 河南 郑州 450052;6辽宁省人民医院 辽宁 沈阳 110016;7山西省人民医院 山西 太原 030012;8中国医科大学附属第一医院 辽宁 沈阳 110001;9山东省立医院 山东 济南 250021
脑卒中在我国是排名首位的致死性疾病[1]。缺血性脑卒中(ischemic stroke,IS)占脑卒中疾病的60%~70%,患者能否获得良好预后,很大程度上取决于是否能迅速地再通闭塞血管和及时挽救缺血半暗带[2,3]。因此,时间窗内使用静脉溶栓药物已成为治疗急性缺血性卒中的重要措施,其疗效的循证医学证据充分。然而,静脉溶栓的实施受到溶栓时间窗、药物本身的局限以及各地区卒中单元建设状况,使得总体卒中患者接受静脉溶栓治疗仅为4.1%[4]。因此,急性IS 治疗过程中“神经保护,减少再灌注损伤、抑制缺血级联反应以减轻神经功能缺损”作为血管再通之外的另一种特异性治疗手段[5,6],其合理使用亦显得尤为重要。复方曲肽在脑梗死患者、新生儿缺血缺氧性脑病等神经系统疾病中显示出其改善缺血脑组织血供、保护神经组织的作用。本研究采用多中心回顾性资料分析,对复方曲肽治疗急性IS 的安全性和有效性开展进一步评价。
1 资料与方法
1.1 研究对象收集抽取2017 年11 月到2018 年11 月于河北省医科大学第一医院、河北省医科大学第二医院、河北省中医医院、中国人民解放军总医院、辽宁省人民医院、山西省人民医院、中国医科大学附属第一医院、郑州大学第一附属医院及山东省立医院共9 家医院收治的400 例急性IS 患者的临床资料。纳入标准:(1)所有病例诊断均符合《中国急性缺血性脑卒中诊治指南2018》诊断标准[4];(2)年龄18~80 岁;(3)根据病史记录,发病14 d 内进行药物治疗的患者。排除标准:(1)短暂性脑缺血发作(TIA)、脑出血、颅内异常血管网患者;(2)已确诊脑肿瘤、脑外伤、脑寄生虫病、代谢障碍、风湿性心脏病、冠心病及其他心脏病合并房颤引起脑栓塞者或伴有严重原发性神经系统疾病患者;(3)合并严重的心、肝、肾、造血系统和内分泌系统等严重原发性疾病;(4)排除溶栓患者;(5)排除使用复方脑肽节苷脂患者。
最终纳入患者400 例。根据治疗用药情况将患者分为3 组:试验组203 例(复方曲肽注射液+常规治疗);对照组85 例(其他神经节苷脂类药物+常规治疗)及空白组112 例(常规治疗)。三组患者性别、身高、体重、体质量指数、病程及疾病分型等基线资料差异均无统计学意义(P>0.05),具有可比性。
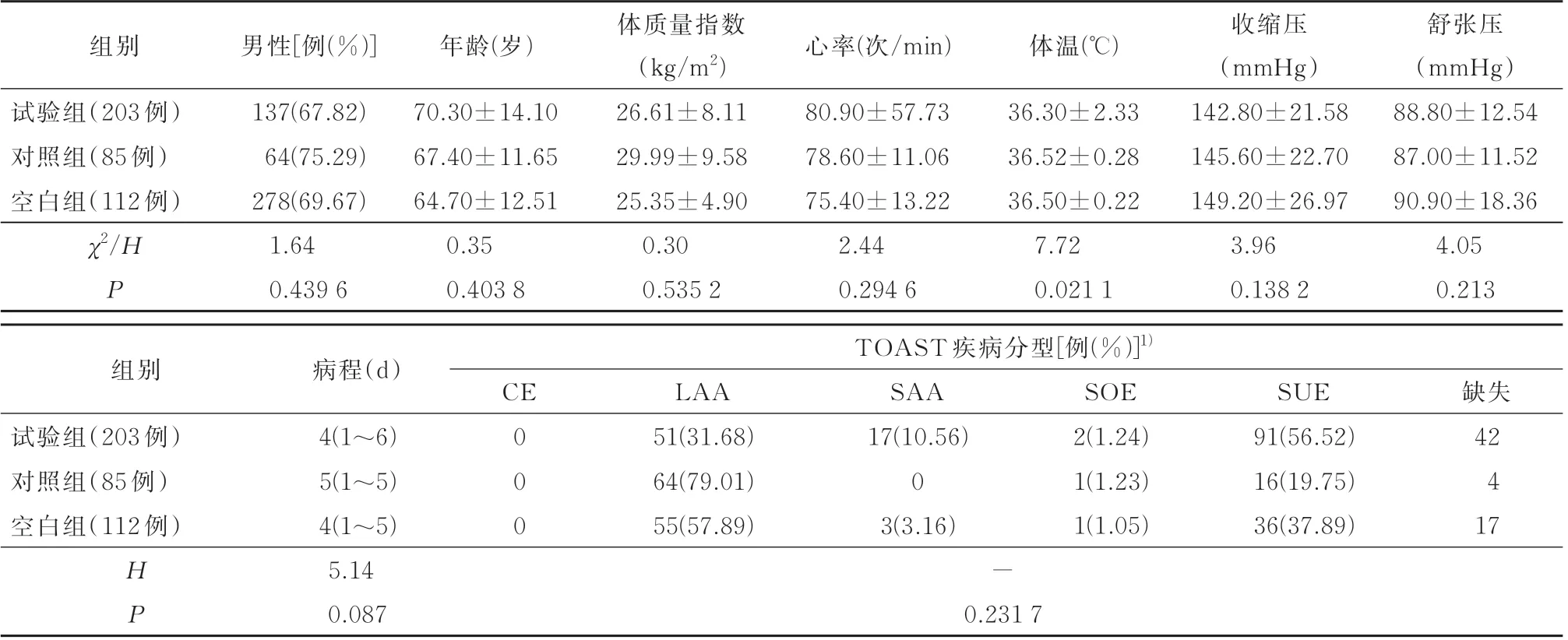
表1 三组患者基线资料、病程及疾病分型比较
1.2 方法依据美国国立卫生研究院脑卒中量表(NIHSS)评分评定卒中患者神经功能缺损程度,比较3 组患者在治疗前和治疗后(治疗2 周后)的NIHSS 评分。疗效判定标准:(1)显效,患者体征及临床症状消失,NIHSS 评分降低>45%;(2)有效,体征及临床症状明显改善,NIHSS 评分降低为18%~45%;(3)无效,NIHSS 评分变化率<18%或患者症状加重(形成脑疝)[7]。总有效率=显效率+有效率。NIHSS 评分变化率=[(治疗前总积分-治疗后总积分)÷治疗前总积分]×100%。
观察3 组患者改良Rankin 量表(mRS)评分变化情况:描述治疗前、治疗后(治疗4 周后)mRS 评分和评估结果分布情况。收集治疗过程中患者生命体征、血常规、便常规、肝肾功能、心电图和不良事件记录进行安全性分析。通过诊断内容以及用药情况分析获得患者的基础用药、合并用药、伴随用药情况,并将其作为疗效判定的混杂因素予以分析[8]。
1.3 统计学方法使用SAS 9.2 软件进行统计分析。计数资料以百分比(%)形式表示,组间比较采用χ2检验;计量资料以均数±标准差形式表示,组间比较采用t检验;计量资料多组间比较采用F检验;非正态分布资料,等级资料采用Wilcoxon 秩和检验;以P<0.05 为差异有统计学意义。
采用R 软件处理本研究所关注的疗效判定混杂用药情况(基础治疗用药、合并用药及伴随用药)。筛选合适的协变量纳入倾向评分模型中,采用条件Logistic 回归计算两组研究对象的倾向评分值。采用最邻近匹配法经倾向评分以1∶1 匹配后,按常规的统计分析方法比较试验/对照组、试验/空白组的疗效差异。
2 结果
2.1 治疗前后NIHSS 评分及疗效比较各组治疗前NIHSS 评分差异无统计学意义(H=4.41,P=0.11)。治疗后各组NIHSS 评分差异有统计学意义(H=135.00,P<0.01)。与基线分值降低程度由高到低为试验组[-4(-15~-1)]、对照组[-1(-12~0)]和空白组[0(-7~0)],差异有统计学意义(H=66.91,P<0.01)。试验组显效率为84.24%(171/203),对照组为48.24%(41/85),空白组为12.50%(14/112),组间比较差异均有统计学意义(χ2=154.128,均P<0.05)。试验组总有效率 为 92.61%(188/203),对 照 组 为 57.65%(49/85),空白组为33.04%(37/112),组间比较差异均有统计学意义(χ2=124.614,均P<0.05)。详见表2。
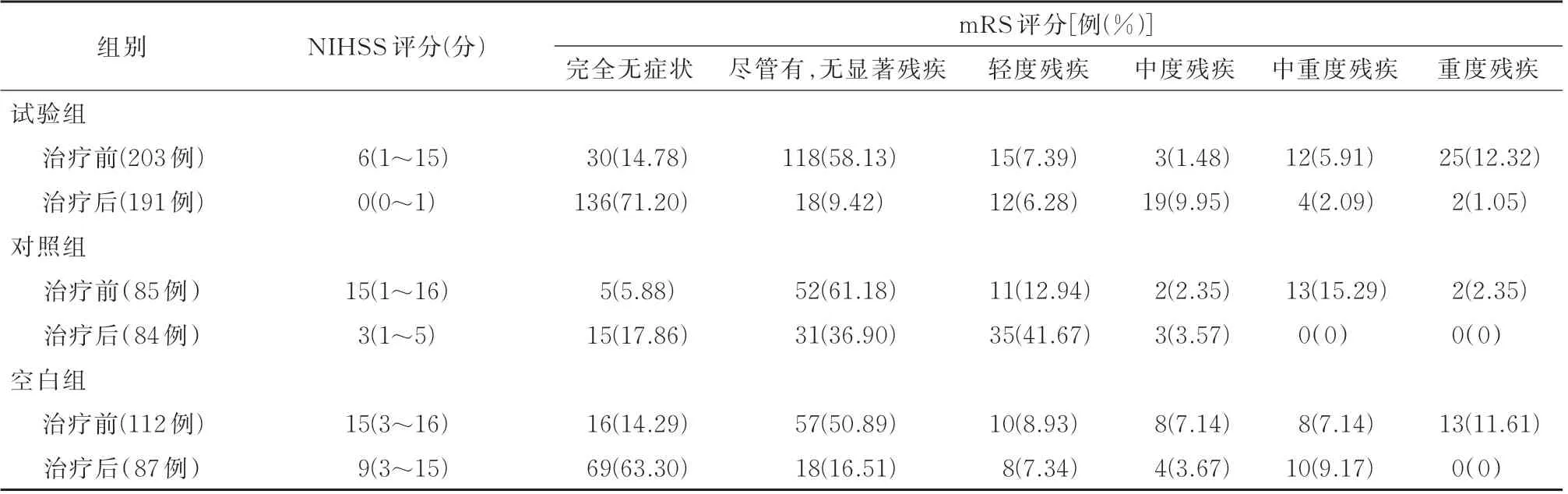
表2 各组治疗前后NIHSS 评分及改良的Rankin 量表评分评估结果情况
2.2 治疗前后各组mRS 评分分布情况各组治疗前mRS 评分分布差异无统计学意义(H=1.88,P=0.39)。治疗后试验组和空白组差异无统计学意义(P>0.05)。
2.4 不良反应试验组发生不良反应14 例(5%),可能与研究药物相关不良事件为3 例;对照组发生不良事件3 例(3.53%);空白组发生不良事件3 例(2.68%)。各组不良事件发生率差异无统计学意义(P>0.05)。本研究无严重不良事件发生。
2.5 混杂用药分析研究根据实际的用药情况,最终纳入与结局相关的9 类药物为协变量,将其作为混杂因素进行统计处理。9 类药物分别为:①抗血小板药;②抗凝降纤药;③脱水剂;④扩容药;⑤降脂药;⑥伴随用药(包括降糖药、高血压药、抗生素类、呼吸系统药、泌尿生殖系统药、消化系统药及其他伴随用药);⑦中药制剂;⑧维生素类;⑨其他(包括自由基清除剂、神经营养药、脑血管扩张药、钙离子拮抗剂、膜稳定剂、侧支循环药)。以上协变量纳入Logistic回归模型,按1∶1 比例,以最近匹配法,匹配容差设定为0.2 的原则,进行各组间两两匹配。
2.5.1试验组与对照组倾向指数匹配后分析 匹配前,试验组和对照组在“伴随用药”与“合并用药其他”的使用上差异有统计学意义。倾向指数评分后,两组各获得96 例匹配病例,两组的用药情况均衡可比。经倾向指数评分后,试验组和对照组总有效率和显效率分别为86.79%(46/53)vs52.83%(28/53)(χ2=14.5,P<0.05)、73.58%(39/53)vs44.17%(25/53)(χ2=7.73,P<0.05)。NIHSS 评分相对于基线的变化,试验组降低3(15,1),对照组降低1(12,0),差 异 有 统 计 学 意 义(H=5.45,P=0.019)。倾向指数评分匹配后,第28 天的mRS 评分数据缺失大于10%,以治疗后第14 天的评分数据补替:两组组间的mRS 量表中6 个等级患者分布差异有统计学意义(Z=13.96,P<0.05,见表3)。

表3 试验组和对照组倾向性评分后Rankin 量表评分评价情况[例(%)]
2.5.2试验组与空白组倾向指数匹配后分析 匹配前,试验组和空白组在伴随用药、合并用药其他、合并用药维生素类及基础治疗降脂药,4 类药物的使用上有显著差异。经倾向指数评分后,试验组和空白组最终各获得96 例匹配病例,两组的用药情况均衡可比。经倾向指数评分后,试验组和空白组的总有效率、显效率分别为91.67%(88/96)vs31.25%(30/96)(χ2=73.97,P<0.05),83.33%(80/96)vs10.42% (10/96) (χ2=102.484,P<0.05)。NIHSS 评分相对于基线的变化,试验组降低5(15,1),空白组降低0(6,0),差异有统计学意义(H=45.41,P<0.01)。倾向指数评分匹配后,第28 天的mRS 评分数据缺失大于10%,以治疗后第14 天的评分数据进行补替:两组组间的mRS 量表中6 个等级患者分布差异有统计学意义(Z=35.66,P<0.01)(见表4)。

表4 试验组和空白组倾向性评分后Rankin 量表评分评价情况[例(%)]
3 讨论
多个研究已经证实,复方曲肽注射液在治疗脑卒中患者中取得了明显的疗效,可以明显改善血液流变学指标(全血高切黏度、全血低切黏度、血浆黏度)、血小板聚集率、微循环损伤指标(血管内皮生长因子、基质金属蛋白酶9)、神经功能缺损情况(NIHSS)等指标[8,9]。本研究回顾性纳入国内多家医院的数据,样本量较大,可以较全面地反映复方曲肽注射液在急性缺血性卒中的疗效。
NIHSS 评分是目前临床最经常用来评估急性期的神经功能缺损的量表,分为意识障碍(整体评估、问答、指令性动作)、凝视(眼球运动)、视野、面瘫(面部运动)、上肢运动、下肢运动、共济失调(协调能力)、感觉、语言、构音障碍(咽喉功能)、忽视,共11 个大项,总计42 分。其中意识和肢体运动分值占比最重。本研究结果显示试验组于治疗后14 d的NIHSS 分值较基线降低程度分别优于对照组和空白组,而对照组NIHSS 分值较基线降低程度优于空白组;同时,在显效率和总有效率上,亦为试验组优于对照组,对照组优于空白组。可见复方曲肽注射液对急性缺血性卒中患者急性期临床症状有明显改善。复方曲肽注射液中对急性缺血性卒中患者急性期的改善作用分为如下几个方面:(1)复方曲肽注射液含曲克芦丁,曲克芦丁可增加血小板内cAMP 的含量,显著抑制血小板黏附到红细胞,抑制血小板激活因子,保护内皮细胞而起到抗血栓的作用[10];(2)它能改善血管损伤状态,使毛细血管通透性降低,改善病灶周围软组织水肿状态;(3)曲克芦丁还可增加血氧含量和氧饱和度,改善微循环,增加局部血流量,减轻水肿[11,12];(4)改善神经元代谢,影响其呼吸链,激活脑内神经递质和酶的活性,改善脑细胞缺血状态[13-15]。最近,Sui 等[16]研究发现复方曲肽降低大脑中动脉闭塞再灌注大鼠脑梗死面积,增强神经功能,抑制神经元凋亡。复方曲肽通过下调Caspase 分子减轻缺血再灌注损伤引起的神经元凋亡。
mRS 评分量表是用来衡量脑卒中后患者的神经功能恢复的状况,分为6 个等级。本研究显示,治疗后28 d 左右,试验组患者的Rankin 分值分布上则有更多比例(87% 左右)的患者分布于完全无症状-轻度残疾区间。提示对于急性IS 患者而言,复方曲肽注射液的有效性优于神经节苷脂类药物。由于治疗后mRS 数据为治疗4 周后评估结果,部分患者数据缺失,所以可能出现治疗后治疗组mRS 评估结果与空白组差异无统计学意义的结果。但经过倾向指数评分后,治疗组的mRS 评估结果优于空白组和对照组。复方曲肽注射液可以改善脑卒中后患者的神经功能恢复,可能的原因是:(1)复方曲肽注射液还含有神经节苷脂制剂,可透过血脑屏障,与大脑受损区域的神经组织高度亲和,并直接嵌入神经细胞膜,填补细胞膜缺损,有效地发挥其生物学活性,促进神经组织修复和新的神经细胞再生[17-19]。Ma 等[20]通过复方曲肽治疗大鼠大脑中动脉闭塞模型研究发现,复方曲肽可提高脑匀浆中乳酸脱氢酶水平,显著提高缺血脑组织超氧化物歧化酶活性,降低丙二醛水平。(2)复方曲肽还显著诱导人脐静脉内皮细胞的血管成熟过程,包括增殖、黏附、迁移和导管形成及刺激大鼠主动脉环和鸡胚绒毛尿囊膜的微血管形成。这些结果提供了强有力的证据,表明复方曲肽通过改善氧化应激和促进血管生成来减轻脑缺血损伤。
本研究试验组、对照组和空白组的不良事件发生率分别为6.90%(14 例,其中相关不良事件为0 例),3.53%(3 例)和2.68%(3 例),组间差异无统计学意义(P>0.05)。研究期间,未观察到发生严重不良事件。通过以上安全性评价,复方曲肽注射液在本研究中显示出较好的安全性。
本研究回顾性发现临床研究阶段的用药种类繁多,且这些用药在各组的使用情况并不均衡。因此需将临床试验过程中涉及到的药物作为本研究疗效判定的混杂因素,采用倾向性评分的方法进一步处理,以平衡各组间的药物使用情况。
本研究尚存在不足、亟需解决的问题:(1)本研究采用mRS 作为功能残疾水平的疗效判定指标,且可通过电话进行随访,已在脑卒中的长期预后研究中广泛使用。本研究中,Rankin 访视时间的节点设置为用药治疗后28 d 左右,时间较短。后续研究可考虑延长至3 个月或半年,用以明确复方曲肽的远期疗效或预后(神经功能缺损症状的改善、疾病复发及致残率、死亡率情况进行比较)。(2)其次,由于课题客观条件不允许,该研究样本量依然不足,所选取的患者有一定局限性,下一步可进行医疗系统内大样本研究,深入探讨临床上采用复方曲肽注射液治疗缺血卒中的临床疗效及安全性,并分析卫生经济学效益。

