感染对慢性阻塞性肺疾病系统性炎症反应的影响
孙皎琳 曹 霞 李婷婷 纪文文 刘 佳 崔 晨 吕 琳 程 雪 石志红
1西安交通大学第一附属医院呼吸与危重症医学科 陕西 西安 710061;2武汉大学人民医院呼吸与危重症医学科 湖北 武汉 430060
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是临床上常见的呼吸系统慢性疾病,是一种可预防和治疗的疾病,以持续性呼吸道症状以及气流受限为主要特征,与有毒颗粒或气体接触导致的气道和/或肺泡异常,引起气道、肺组织及系统性炎症反应密切相关[1]。COPD 发展的各个时期都存在着T 细胞亚群的失衡[2]。临床上常用Th1/Th2 表示T 细胞亚群失衡的状态,相较于直接测定Th1 和Th2 数量,对它们释放的特征性细胞因子的检测,能更好地反映其细胞的功能状态和活化水平。干扰素(IFN)-γ、白细胞介素(IL)-2、IL-4、IL-13 是 常 见 的 炎 性 细 胞 因 子,IFN-γ、IL-2 为Th1细胞分泌的特征性细胞因子,IL-4、IL-13 为Th2 细胞分泌的特征性细胞因子,用IFN-γ、IL-2、IL-4 和IL-13 这4 种特征性细胞因子来表示Th1/Th2 的细胞活性[3]。有研究表明COPD 急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)及缓解期的全身炎症失衡状态存在明显的不同,气道局部乃至系统性炎症反应特征可能因为感染因素的参与发生改变[4]。AECOPD最常见的诱因是细菌或病毒感染[5]。感染是否是引起COPD 系统性炎症的特征发生改变,即为本研究的重要内容。
本文以COPD 患者(包括急性加重期、治疗后缓解期)以及非COPD 对照组为对象,通过检测血清中炎症指标和血浆中以上4 个细胞因子的浓度,探究COPD 不同时期系统性炎症的特征,尤其是炎症反应水平及Th1/Th2 功能状态的变化,进而评估感染对此变化的影响。
1 资料与方法
1.1 临床资料本研究患者共分3 组,所有患者均为2016 年4—12 月期间在西安交通大学第一附属医院住院的患者。其中AECOPD 组(A 组)30 例,诊断符合我国COPD 指南中关于AECOPD 的标准[1]。排除其他可能引起炎性指标变化的疾病,如肺炎、哮喘、肿瘤、冠心病、结缔组织病、肝炎及合并其他脏器的急慢性炎症,且在入院前未服用过抗生素。缓解期组(R 组)患者15 例,为AECOPD 经标准治疗7~10 d,呼吸道症状减轻或稳定,并且符合出院标准的患者。对照组(C 组)15 例,为无呼吸系统及免疫、肿瘤等疾病入住周围血管科的非COPD患者(表1)。研究方案经西安交通大学第一附属医院伦理委员会审核备案,所有受试者均签署知情同意书,本研究符合《赫尔辛基宣言》的原则。
1.2 方法A 组、C 组入院时测定肺功能,于入院后次日清晨空腹抽取静脉血5 mL。R 组患者于出院前当日清晨空腹采集静脉血5 mL,并测定肺功能。记录患者入院后第一次或者出院前最后一次的血常规、血沉、C-反应蛋白(CRP)、降钙素原(PCT)等临床指标。采集的静脉血经3 000 r/min,10 min 离心后取上清,使用ELISA 试剂盒(RayBio)检测血浆中IFN-γ、IL-2、IL-4、IL-13 的浓度。
1.3 统计学处理计量资料以均数±标准误(x-±s)表示,若数据符合正态分布及方差齐性,选择方差分析,若方差不齐,选用非参数检验。多样本之间进行单因素方差分析,两两比较采用t检验。所有数据均使用SPSS 23.0 统计软件进行分析处理,P<0.05或者P<0.01 均表示数据结果具有统计学意义。
2 结果
2.1 入选各组患者基本情况三组之间的年龄、性别、吸烟指数无统计学差异(均P>0.05)。A 组、R 组的COPD 患者吸入支气管扩张剂后FEV1/FVC、FEV1%无统计学差异(均P>0.05,表1)。
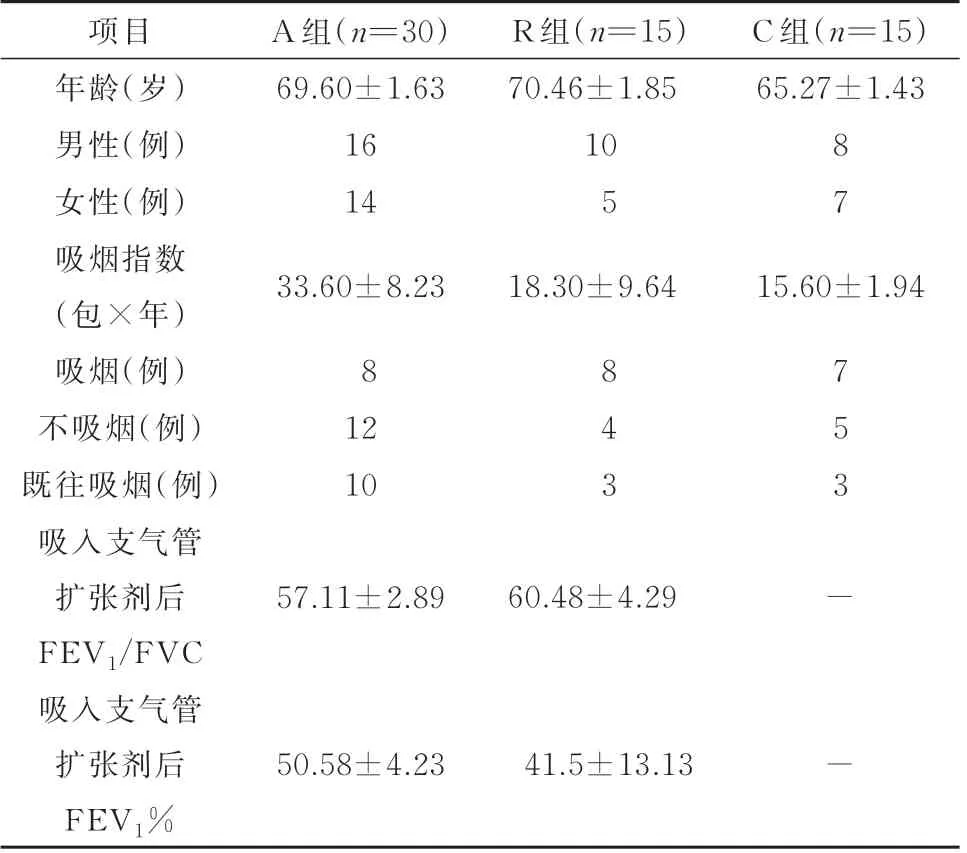
表1 入选各组患者基本情况分析
2.2 三组患者系统性炎症指标比较COPD 组(A组和R 组)中性粒细胞数(N)、中性粒细胞百分比(N%)均高于对照组(P<0.05,P<0.01);COPD急性加重期组(A 组)的淋巴细胞数(L)低于对照组(P<0.01),缓 解 期(R 组)的L 高 于 对 照 组(P<0.01),COPD 组(A 组和R 组)淋巴细胞百分比(L%)均低于对照组(P<0.01)。A 组与R 组之间的N、N%、L、L%均无差异。COPD 组(A 组和R组)CRP 均显著高于对照组(C 组)(P<0.01),A 组CRP 高 于R 组(P<0.05)。A 组 与R 组 之 间 的 血沉、降钙素原(PCT)无统计学意义。白细胞数(WBC)、嗜酸粒细胞数目(E)、单核细胞数(M)、嗜酸粒细胞百分比(E%)、单核细胞百分比(M%)在三组之间无差异(表2)。
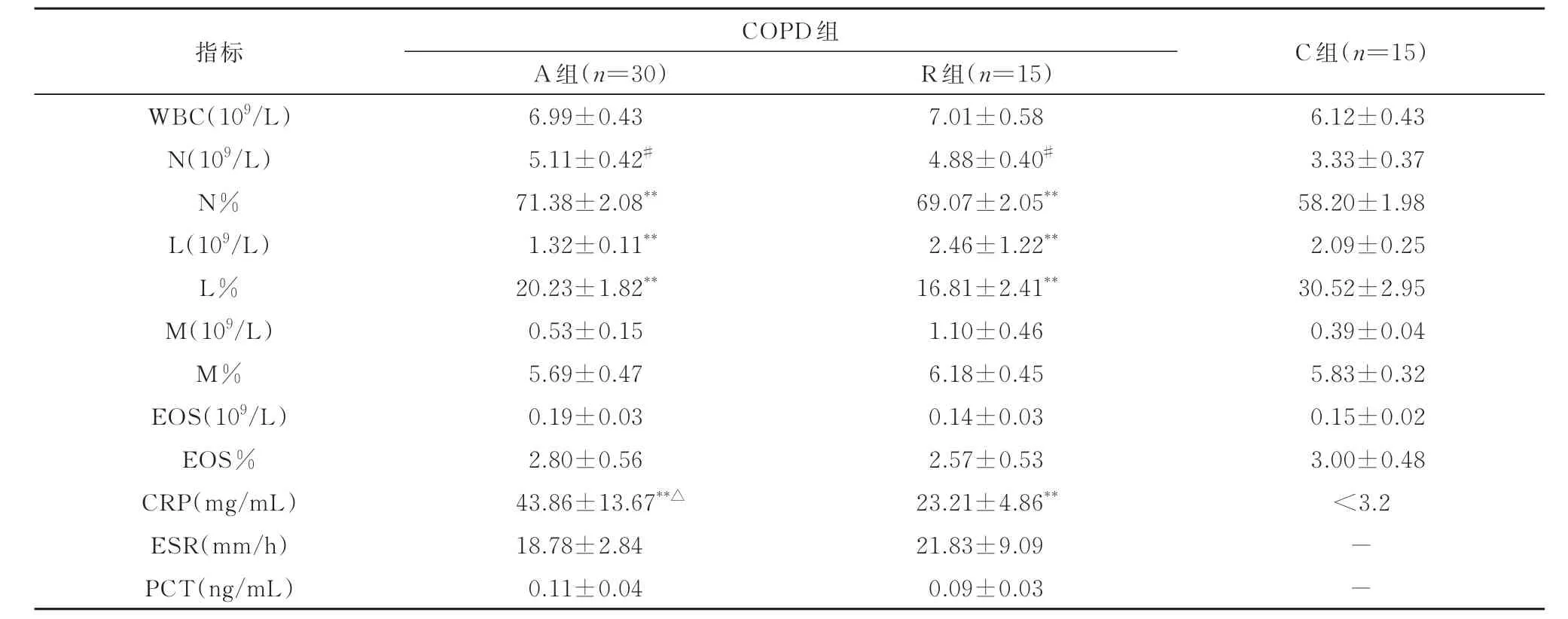
表2 三组间系统性炎症指标比较
2.3 各组之间血浆的IFN-γ、IL-2、IL-4 和IL-13浓度水平COPD 组患者(包括A 组及R 组)IFN-γ的浓度均高于C 组(P<0.05),A 组IFN-γ 的浓度低于R 组(P<0.05);COPD 组(包括A 组及R 组)IL-2浓度均低于C 组(P<0.01),A 组IL-2 浓度低于R组(P<0.05);A 组IL-4、IL-13 浓 度 均 高 于C 组(P<0.05),但A 组和R 组的IL-4、IL-13 浓度与C组相比均无差异(表3)。
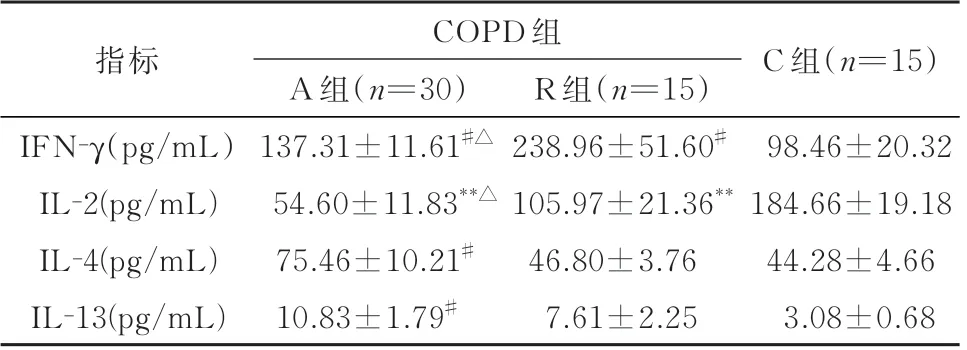
表3 各组之间血浆的IFN-γ、IL-2、IL-4 和IL-13 浓度水平
2.4 感染对COPD 急性加重期及缓解期炎性反应的影响将COPD 急性加重期和治疗后缓解期患者的PCT 大于0.1 ng/mL 的数据进行剔除,A 组有患者25 名,B 组有10 名。结果显示去除感染因素后,COPD 组(A 组和R 组)中性粒细胞数(N)、中性粒细胞百分比(N%)、CRP 均高于对照组(分别为P<0.05、P<0.05、P<0.01);淋巴细胞数(L)、淋巴细胞百分比(L%)均低于对照组(P<0.01)。A组的血沉高于R 组(P<0.05)。A 组与R 组其余实验室检查各项指标均无差异(P>0.05)。COPD 组患者(包括A 组及R 组)IFN-γ 的浓度均高于C 组(P<0.05),IL-2 浓度均低于C 组(P<0.01),A 组与R 组的各项炎性细胞因子均无差异(P>0.05,表4)。
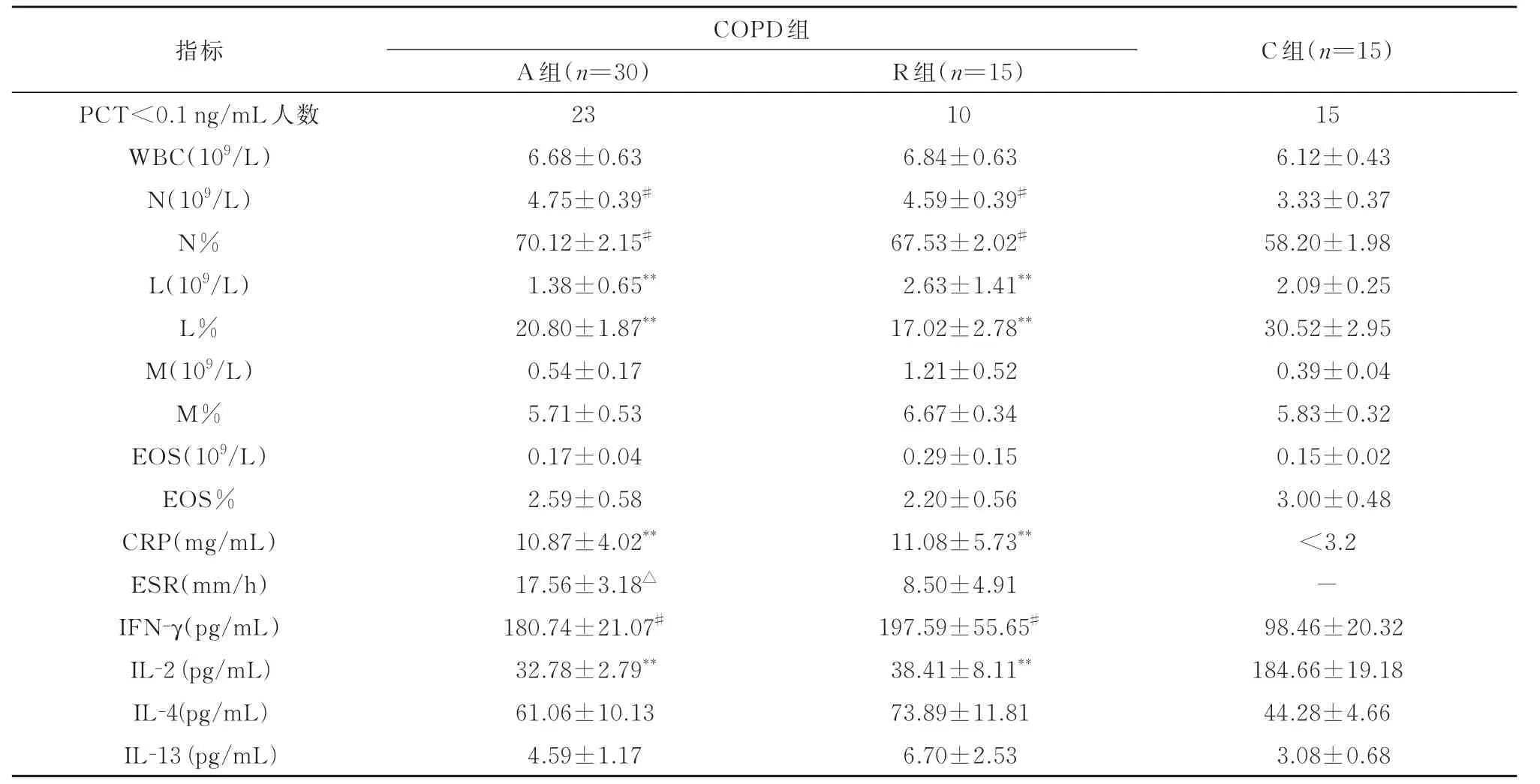
表4 感染对慢性阻塞性肺疾病急性加重期及缓解期炎性反应的影响
3 讨论
慢性阻塞性肺疾病(COPD)是呼吸科常见的慢性疾病,因其具有高患病率、高致残率、高疾病负担而成为非常重要的世界性公共卫生问题,同样在我国COPD 的高发病率也值得重视[6]。目前为止COPD 的发病机制仍未探究清楚,适应性免疫在COPD 发生过程中的作用备受关注,因其可能是导致COPD 气道乃至全身炎症反应迁延、进展的重要机制而成为众多学者关注的焦点[7]。急性呼吸道感染尤其是细菌感染是引起AECOPD 最常见的诱因,临床上常用白细胞、中性粒细胞、单核细胞、嗜酸粒细胞(ESO)的数目和百分比以及血沉、CRP、PCT,作为反映体内细菌感染及炎症反应的指标[8]。T 淋巴细胞的活化及向Th1/Th2 的转化,是机体免疫炎症反应的重要环节[9]。Th1/Th2 的失衡常存在于感染、肿瘤、自身免疫病、变态反应、移植排斥反应等多种疾病中。Th1/Th2 可以产生特定细胞因子IFN-γ、IL-2、IL-4 和IL-13。相较直接检测Th1/Th2 细胞计数,检测这些细胞因子可以更好地反映体内Th1/Th2 的活化和失衡状态[10]。本研究探究COPD 不同时期系统性炎症的特征,尤其是炎症反应水平及Th1/Th2 功能状态的变化,进而评估感染对此变化的影响。
本研究中,与对照组(C 组)相比,COPD 组(A组和R 组)N(P<0.05)及CRP(P<0.01)显著增高。可见中性粒细胞在AECOPD 患者中具有相对特异性;同时CRP 是第一个公认的急性时相反应蛋白,当机体处在感染或者受损的情况时,其在血浆中浓度急剧上升,具有激活补体和增强吞噬细胞吞噬功能的作用,有助于清除机体内的病原微生物[11]。COPD 急性加重期的典型特点为各种诱因所致的急性气道乃至系统性的炎症,有大量研究表明COPD 急性加重期其体内CRP 的浓度可准确反映出炎症的严重程度,CRP 浓度不仅可作为COPD全身炎症程度的参考,也可作为判断COPD 病情严重程度的辅助检测指标之一[12]。本研究结果还显示,在COPD 组内,A 组即急性加重期组CRP 高于R 组即治疗后缓解期组,提示COPD 系统性炎症反应持续存在于整个病程中,在急性加重期,系统性炎症反应加剧,治疗后伴随呼吸道症状和气道炎症的缓解,系统性炎症反应也有所缓解,但维持存在,这也支持COPD 系统性炎症反应导致多器官损害和病情逐步进展的理论[13]。COPD 患者的淋巴数目低于对照组,其原因可能与中性粒细胞和单核细胞数目增多后,导致淋巴细胞的数目相对减少有关。本研究中急性加重期及治疗后缓解期的ESR无显著差异,但均高于正常值,因为ESR 在炎症性疾病、各种急性全身性或局部性感染、结缔组织病、组织损伤或坏死等疾病上有明显的增加[14]。
本研究发现WBC、EOS、M 在各组之间无差异。白细胞被称为免疫细胞,和中性粒细胞一起常常作为细菌感染时的诊断参考指标,因为入组的患者主要为老年人,WBC 受到多种因素的影响,如年龄、生理因素、呕吐、出血、药物等,故在COPD 急性期,WBC 计数对其诊断及病情评估缺乏特异性,并不能有效地反映感染、炎症的程度。EOS 是COPD病情评估重要的指标,近年来在AECOPD 的治疗以及预后中起着重要的作用,在某些COPD 患者中,与气道炎症有着密切的联系[15,16]。对于COPD患者,血中高EOS 数目可视为肺中EOS 高表达的标志,并且血中EOS 含量较高的患者,使用吸入型糖皮质激素与减少急性加重次数有关[17]。本研究中EOS 在各组之间无显著差异,可见高EOS 并不是普遍存在于COPD 患者中,在本组患者中不具有诊断意义。高EOS 在国人COPD 中的流行病学,有待进一步大样本的流行病学研究。PCT 是近年来发现的用于全身细菌感染诊断和鉴别诊断的血浆标志物,血PCT 水平与感染范围呈正相关,细菌感染时显著升高,可反映出感染的严重程度及炎症活动情况,PCT 可作为感染性COPD 急性加重期的特异性指标[18]。本实验未发现其在急性加重组和治疗后缓解期之间的差异,可能与入组例数较少和受到多种因素干扰有关。
在对选取的资料进行炎性因子分析时,结果发现相较于对照组,COPD 组(A 组和R 组)患者的IFN-γ、IL-2、IL-4 和IL-13 的浓度都存在明显改变。可见不论是在急性加重期还是治疗后缓解期,COPD 患者都存在着T 细胞的活化及Th1/Th2 功能的失衡,表现为相较于对照组,COPD 组Th1 细胞释放的细胞因子IFN-γ 显著增加,IL-2 显著降低,Th2 细胞释放的IL-4 和IL-13 有所增加。COPD 组内的比较发现,急性加重期的IFN-γ、IL-2 浓度相较于缓解期有明显减低。处于急性加重期时,各种原因导致的气道乃至全身炎症反应加重,使得以保护性反应为主要功能的Th1 细胞被抑制而以迟发型变态反应为主要功能的Th2 型细胞为主,相反在治疗后缓解期,则以保护性反应为主要功能的Th1 细胞的活跃为主[19]。
感染对于COPD 患者体内免疫炎症反应有着重要的作用。多数COPD 急性加重期患者血浆PCT 位于正常范围,有研究表明PCT<0.1 ng/mL的COPD 急性加重患者初始治疗时不给予抗菌药物,可显著减少抗菌药物的使用。因此本研究以PCT 小于0.1 ng/mL 认为体内处于非细菌感染状态[20]。本 研 究 发 现,PCT 小 于0.1 ng/mL 时,COPD 患者(A 组与R 组)中性粒细胞、中性粒细胞百 分 比、CRP 以 及IFN-γ、IL-2 仍 与 对 照 组 存 在 差异,研究观察的其余各项指标均无显著差异。这一结果说明,在去除感染因素后,COPD 无论是急性加重期还是缓解期,系统性炎症反应仍然持续存在,T 细胞活化及转化的功能状态是一致的,其系统性炎症的本质依然是以Th1 活化,刺激特异性IFN-γ 及抑制IL-2 释放为特征,这一炎症特征持续存在于COPD 病程的整个过程中,是COPD 系统性炎症的核心特征。对其机理的深入研究,将有助于揭示COPD 免疫炎症维持的机制。而急性加重期感染的存在,可能是导致T 细胞活化功能状态改变及全身炎症反应的重要原因。
综上所述,本研究提示不论是在急性加重期还是治疗后缓解期,COPD 患者都有反映系统性炎症反应的CRP 的持续升高,和T 细胞活化及Th1/Th2功能的失衡。其系统性炎症的本质依然是以Th1活化,增加特异性IFN-γ 及减少IL-2 释放为特征,这一炎症特征持续存在于COPD 病程的整个过程中,是COPD 系统性炎症的核心特征。中性粒细胞、CRP 简单易操作,可用于评估COPD 系统性炎症反应程度。对COPD T 细胞活化及转化的深入研究,必将有助于揭示COPD 免疫炎症维持,及疾病持续进展的机制。

