热处理对“陇藜1号”藜麦分离蛋白二级结构及热稳定性的影响
赵爱萍,何兴芬,陈 娟,杨富民,*
(1.陇东学院农林科技学院,甘肃 庆阳 745000;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
藜麦(Chenopodium quinoa Willd.)是一种伪谷物,已在安第斯山脉种植了数千年[1]。在我国,藜麦的种植历史可以追溯到1987年[2]。藜麦蛋白质含量高(约15%)[3],必需氨基酸平衡[4]。与谷物和豆类相比,藜麦的氨基酸谱更广[5]。与其他谷物蛋白质类似,藜麦的蛋白质成分包括白蛋白、球蛋白、醇溶蛋白和谷蛋白。在过去的十年中,藜麦因其高营养价值和优良的蛋白质品质而受到关注[6],如果蔬-开菲尔藜麦发酵混合冻干食品[7]。此外,动物蛋白往往会产生致敏性,因此使用藜麦蛋白等植物蛋白作为部分替代品是当下食品产业发展的趋势[8]。植物蛋白因其特定的结构和功能特性,在食品工业中发挥着重要作用。有关新的植物蛋白质来源和加工对这些蛋白质结构和功能特性影响的研究越来越受到关注,并变得十分重要。因此,在食品工业中,藜麦在作为优质蛋白质提取原料的应用中具有巨大的潜能[2]。
人们通常将藜麦种子置于过量的水中煮沸后食用。热处理是最常见的处理方法,用于改变从不同来源获得的蛋白质结构和功能特性[9]。它会导致蛋白质变性,即由于非共价氢键、疏水和静电相互作用和/或共价交联的变化,从天然状态转变为无序状态[10],蛋白质的天然结构经不同时间和温度的热处理会导致其营养价值和功能特性显著改变。因此,在食品研究和生产中需对热处理条件进行严格的把控[11]。而蛋白质的功能特性可能与其二级结构有关。傅里叶变换红外光谱(FTIR)是获得蛋白质二级结构的非常强大的工具[12]。通过适当拟合蛋白质原始FTIR的酰胺I谱带,并分析其二阶导数,可以获得蛋白质的二级结构(α-螺旋、β-折叠、β-转角和无规卷曲)的相对含量[13]。齐宝坤等[14]报道称蛋白质的β-转角和无规卷曲可以促进热聚集体的形成。但目前有关热处理对“陇藜1号”藜麦蛋白质热稳定性和二级结构的影响尚未见报道。本研究通过分析不同温度、时间热处理下藜麦分离蛋白(QPI)的热重分析(TGA)特性及FTIR变化,表征热处理对其热稳定性和二级结构的影响,旨在为“陇藜1号”藜麦的加工及其在食品工业中的应用提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
“陇藜1号”藜麦,2017年9月采收于甘南藏族自治州,真空包装脱壳后的藜麦籽粒储藏在干燥、避光环境下,直至使用。
石油醚(30~60℃),pH 7.0磷酸盐缓冲液(PBS),1 mol/L NaOH,1 mol/L HCl,KBr,以上试剂均为分析纯,上海麦克林生化科技有限公司。
1.1.2 仪器与设备
FTIR 920傅里叶变换红外光谱仪,天津市拓普仪器有限公司;TGA 550热重分析仪,美国TA仪器有限责任公司;LyoQuest-85真空冷冻干燥机,河南兄弟仪器设备有限公司;H-1850 R高速冷冻离心机,长沙湘仪离心机有限公司;FW-100超高速万能粉碎机,西安仪创实验室仪器设备有限公司;LDZX-50 KBS立式高压灭菌锅,上海申安医疗器械厂;HH-M4水浴锅,上海赫田科学仪器公司;PHS-3E型pH计,上海仪电科学仪器股份有限公司。
1.2 方法
1.2.1 QPI的制备和保存
粉碎后的藜麦粉过60目筛,脱脂3次(30~60℃石油醚),每次3 h,置于通风橱风干后按一定料液比加入蒸馏水,并用1 mol/L NaOH调节pH至10,在47℃下提取2 h,以5 000 r/min下离心15 min,取上清液,用1 mol/L HCl将其pH调至4.5,4℃静置2 h后以5 000 r/min离心15 min,收集沉淀。用蒸馏水将沉淀复溶后水洗5次,调节pH至中性,透析后真空冷冻干燥得到藜麦分离蛋白[15]。所得QPI纯度为87.17%。
1.2.2 QPI溶液热改性产物的制备
将QPI溶解在磷酸盐缓冲液(0.2 mol/L,pH 7.0)中,同时在环境温度(25℃)下搅拌2 h,并在4℃下储存过夜以增强水合作用。使用浓度为5%的QPI溶液分别在60、70、80、90、100、121℃温度下处理5、10、20、30 min,然后用冰水快速冷却5 min。样品在4℃下储存,一般在处理后2 d内进行分析[16]。
1.2.3 热重分析
称取“1.2.2”中处理30 min的QPI热改性产物10.0 mg于铂铑合金托盘中,扫描速率和温度范围分别设置为50℃/min和50~700℃,对其在氮气环境中进行热重分析[17]。
1.2.4 傅里叶红外光谱
称取冷冻干燥后的QPI热改性产物冷1.0 mg,并与200 mg KBr充分研磨,制成薄片上机测定。测定条件为:波数4 000~400 cm-1,分辨率4 cm-1,精度0.01 cm-1,扫描次数64次,温度为25℃[18]。
1.2.5 数据处理
应用Oringin 2021软件作图,使用Peak Fit V4.12软件对傅里叶变换红外光谱进行高斯拟合并分析其二阶导数。
2 结果与分析
2.1 热重分析测定结果
由图1可见,随着热重分析温度的升高,所有样品的质量分数下降趋势相似,分为3个阶段,分别为50~200℃,200~400℃和400~650℃。经过不同温度(60~121℃)处理30 min后的QPI热稳性均有所提高,且在121℃下处理30 min时有达到最大值。
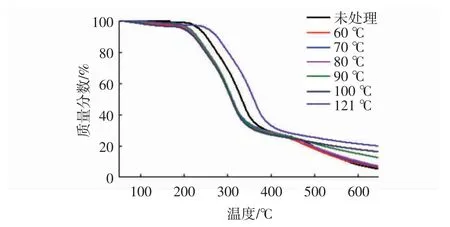
图1 不同热处理条件对QPI热重的影响Fig.1 Effects of different heating treatment conditions on thermo-gravimetric of QPI
2.2 傅里叶红外光谱图分析
由图2可见,不同热处理条件下的QPI其傅里叶红外光谱图存在很大差异。FTIR可以显示出蛋白质中的氨基基团、酰胺I带、酰胺Ⅱ带和酰胺Ⅲ带等信息[19]。酰胺I带(1 700~1 600 cm-1)和酰胺Ⅲ带(1 320~1 230 cm-1)之间存在一定的对应关系[20]。利用高斯拟合二阶导数法对FTIR谱图中的酰胺I、Ⅲ带细分,得到QPI中4种二级结构的含量[21]。
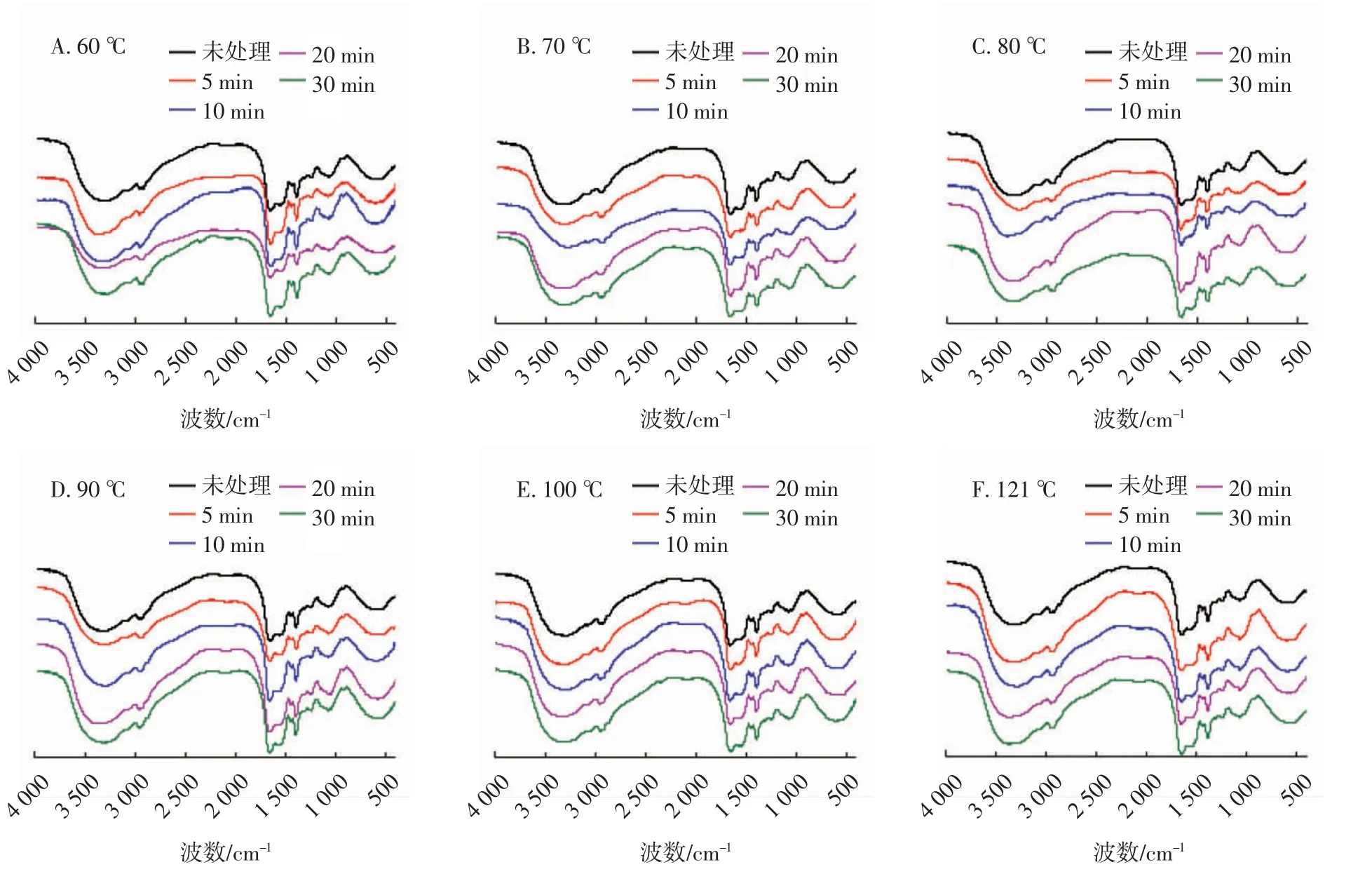
图2 不同热处理条件对QPI傅里叶红外光谱图的影响Fig.2 Effects of different heating treatment conditions on FTIR spectra of QPI
据报道,蛋白质酰胺Ⅰ带中4种二级结构与波谱的对应关系分别为:1 640~1 610 cm-1对应β-折叠,从1 670~1 660 cm-1对应β-拐角,1 658~1 650 cm-1对应α-螺旋,1 650~1 640 cm-1对应无规则卷曲[22]。图3为QPI的去卷积酰胺I带二阶导数拟合图谱,QPI的4种二级结构含量最终由积分面积得出。
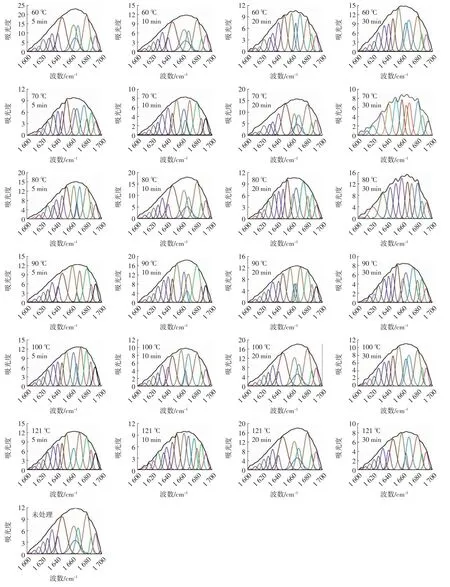
图3 QPI的去卷积酰胺I带二阶导数拟合图谱Fig.3 The second-derivative spectra of deconvolution amide I in QPI
酰胺Ⅰ带各二级结构相对含量拟合结果见图4。由图4可见,不同热处理对QPI酰胺Ⅰ带二级结构的相对含量影响较大。在同一温度下随着热处理时间的延长,QPI酰胺Ⅰ带中的α-螺旋含量呈逐渐降低的趋势,在100℃处理30 min时含量最低,为25.11%;β-转角含量在60、70、100、121℃处理下则与α-螺旋含量呈现相反的趋势(图4A、B、E、F),在100℃处理30 min时含量最高,为40.59%,而在80℃与90℃处理下随着热处理时间的延长呈现先上升后下降的趋势(图4C、D);在同一温度下,β-折叠含量随热处理时间的延长呈先降低后升高的趋势,在100℃处理20 min时含量最低,为24.22%;无规则卷曲含量在热处理过程中同样发生变化,但是较其他3种结构而言,其变化不显著。
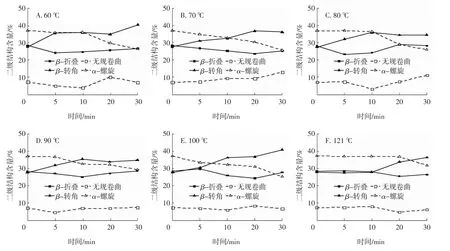
图4 利用酰胺Ⅰ带拟合不同热处理条件制备的QPI二级结构含量Fig.4 The secondary structures contents of QPI prepared by different heat treatment conditions fitted through amide I bands
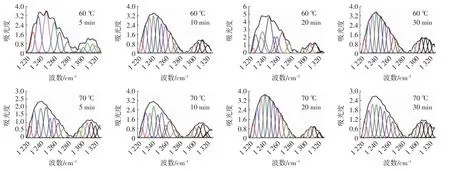
酰胺Ⅲ带的谱峰归属如下:1 330~1 290 cm-1为α-螺旋;1 295~1 265 cm-1为β-转角;1 270~1 245 cm-1为无规卷曲;1 250~1 220 cm-1为β-折叠[23]。图5为QPI的去卷积酰胺Ⅲ带二阶导数拟合图谱。
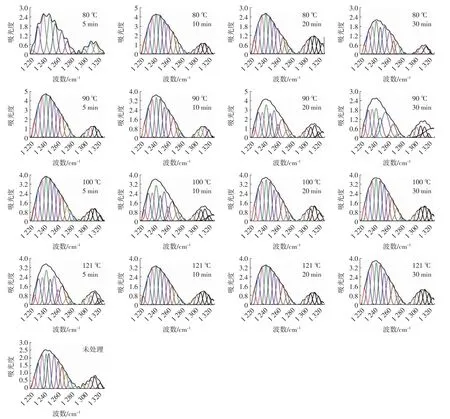
图5 QPI的去卷积酰胺Ⅲ带二阶导数拟合图谱Fig.5 The second-derivative spectra of deconvolution amideⅢin QPI
根据图6酰胺Ⅲ带拟合不同热处理条件制备的藜麦分离蛋白二级结构相对含量可以看出,不同热处理对QPI酰胺Ⅲ带二级结构有显著影响。在80、100℃下随着热处理时间的延长,QPI酰胺Ⅲ带中的α-螺旋含量呈先上升后下降的趋势,在60、90℃下呈逐渐上升趋势,而在60、121℃下呈先升高后下降再升高的趋势,在80℃下处理30 min时含量最低,为9.02%;β-转角含量则与α-螺旋含量呈现相反的趋势,在100℃下处理20 min时含量最高,为12.92%;β-折叠含量在60、70、90、100、121℃下随热处理时间的延长呈先上升后下降的趋势,在80℃时呈现先上升趋势,在90℃下处理20 min时含量最低,为40.80%;无规则卷曲含量在热处理过程中同样发生变化,呈先下降后上升,在80℃下处理30 min时含量最高,为36.49%。
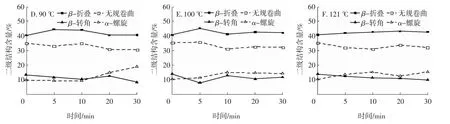
图6 利用酰胺Ⅲ带拟合不同热处理条件制备的QPI二级结构含量Fig.6 The secondary structures contents of QPI prepared by different heat treatment conditions fitted through amideⅢbands

3 讨论
3.1 热处理对QPI热重特性的影响
TGA结果表明,经过不同温度(60、70、80、90、100、121℃)处理30 min后的QPI热稳性均有所提高,且在121℃下处理30 min时有最大值。所有样品的质量分数下降趋势相似,分3个阶段,分别为:50~200℃,200~400℃和400~650℃。由于热处理后QPI的热稳定性得到提升,导致热处理的QPI热量损失较低,这与Zhang等[24]在研究蒸汽爆破处理对山茶(Camellia oleifera Abel.)种饼蛋白的热重特性时也观察到的趋势类似。第一阶段的质量主要损失在残留水和低分子量挥发物上。第二阶段的质量损失主要归因于蛋白质的降解,在此降解阶段,分子间和分子内的氢键、静电和疏水相互作用等的非共价键裂解以及氨基酸残基之间的共价键断裂共同导致这一阶段的质量损失[25]。第三个降解中QPI的质量损失斜率变小了,这可能是由于气流下蛋白质分离物的氧化所致。这与Malik等[26]的研究结果一致。
3.2 热处理对QPI二级结构含量的影响
在同一温度下,藜麦分离蛋白中α-螺旋和β-折叠结构的含量随着热处理时间的延长整体呈降低的趋势,而β-转角和无规卷曲相对含量逐渐增加,表明藜麦蛋白分子的α-螺旋和β-折叠向β-转角和无规卷曲转变。这可能是因为加热破坏了QPI分子间的氢键,导致蛋白质分子内最为紧密的α-螺旋结构聚集,而蛋白质内部的β-折叠随之展开,形成无序松散的无规卷曲[27]。蛋白质变性的典型表现之一即为出现更多的无序结构。有研究表明,大豆蛋白的二级结构中α-螺旋结构的相对含量随着热处理时间的延长逐渐减少,而无规卷曲相对含量则增多[14]。因此,认为无规卷曲和β-转角可以促进热聚集体的形成。酰胺Ⅲ带各二级结构拟合结果中,由于在同一温度下随着热处理时间的延长,导致维持α-螺旋的氢键作用减弱,使其逐渐解旋,随处理时间的进一步延长,导致展开后的蛋白重新排列,使得α-螺旋含量增多,相应的无规卷曲含量减少。
4 结论
从热稳定性和二级结构的角度研究了热处理后的藜麦分离蛋白,结果表明:热处理的QPI热稳性高于未处理组,且热处理温度越高其热稳定性越好;热处理导致QPI分子内的α-螺旋聚集,β-折叠展开,形成更多松散的无规卷曲结构,说明通过调节热处理条件可以改善QPI的热稳定性,同时改变QPI的二级结构,为QPI的进一步加工利用提供理论依据。但热处理对QPI功能性质的影响以及结构与功能性质之间的关系还需进一步探究。

