MR影像组学在鉴别腮腺良恶性肿瘤中的临床应用价值
齐金博,高安康,白洁,程敬亮,文宝红,王斐斐,张赞霞,马潇越
腮腺肿瘤约占头颈部肿瘤的3%~6%,其中80%为良性肿瘤,良性肿瘤最常见的是多形性腺瘤,其次是Warthin 瘤,恶性肿瘤中,最常见的是黏液表皮样癌[1]。因腮腺多形性腺瘤、Warthin 瘤和恶性肿瘤的生物学行为存在差异,临床对三者的治疗方法不同[2-3]。穿刺活检是临床腮腺肿瘤术前常用检查,但取材局限,且具有肿瘤细胞种植转移、诱发腮腺炎等风险[1,4]。因此,术前准确、无创的腮腺肿瘤鉴别诊断方法对临床治疗和判断预后有指导意义。磁共振成像(magnetic resonance imaging,MRI)具有无创、多方位成像及软组织分辨率高的特点,虽然已有研究显示MRI 表现对鉴别腮腺良恶性肿瘤具有一定的价值,如肿瘤的位置、边界、囊变或坏死及周围结构侵犯等[5-6],但是结果往往会受到放射科医师的主观影响。
影像组学可从医学图像中提取出大量的影像组学特征,通过高通量的方法构建影像组学预测模型,能够无创评估肿瘤的多种生物学行为,对肿瘤进行定性诊断,已经广泛应用于肿瘤的鉴别诊断及预后评估[7-8]。但国内外应用影像组学研究腮腺良恶性肿瘤的鉴别诊断尚较少,且这些研究缺乏与肿瘤血管生成直接相关的信息[9-10]。本研究基于MRI T2 脂肪抑制序列(fat saturated T2 weighted imaging, FS-T2WI)、表观扩散系数(apparent diffusion coefficient,ADC)及对比增强T1 加权成像(contrast enhanced T1 weighted imaging,CE-T1WI)的影像组学特征构建单序列、双序列和多序列联合影像组学模型,探讨其在鉴别腮腺良恶性肿瘤中的临床应用价值。
1 资料与方法
1.1 一般资料
本研究经郑州大学第一附属医院医学伦理委员会批准,免除受试者知情同意,批准文号:2019-KY-0015-001。回顾性分析2019 年1 月至2021 年7 月于郑州大学第一附属医院就诊并接受术前常规MRI 检查的腮腺肿瘤患者资料。纳入标准:(1)经病理证实为腮腺肿瘤患者;(2)术前无穿刺及放射化学治疗史。排除标准:(1)最大直径<5 mm 的肿瘤,以避免部分容积效应;(2)图像质量欠佳。
1.2 仪器与方法
采用西门子3.0 T (Skyra, Prisima, Verio)MRI 扫描仪和头颈联合线圈。MRI 扫描序列及参数:FS-T2WI:TR 4000 ms,TE 83 ms,矩阵224×320,FOV 230 mm×230 mm,层厚4.0 mm,层间距0.4 mm;DWI:b=0、1000 s/mm2,TR 3300 ms,TE 54 ms,矩阵160×160,FOV 240 mm×240 mm,层厚4.0 mm,层间距1.2 mm,扫描后自动重建表观扩散系数(apparent diffusion coefficient,ADC)图;CE-T1WI:使用高压注射器经肘静脉注入Gd-DTPA 用于对比增强成像,TR 776 ms,TE 10 ms,矩阵224×320,FOV 230 mm×230 mm,层厚4.0 mm,层间距0.4 mm。
1.3 图像分析
肿瘤的MRI 影像学特征包括肿瘤的边界(清晰/不清晰)、是否涉及深叶(通过下颌后静脉最背侧点与颈椎骨同侧最背侧点的连线划分浅深叶)、T2 加权成像(T2 weighted imaging,T2WI)信号均匀(肿瘤内部不同的信号<10%)、囊肿或坏死(FS-T2WI 高信号,CE-T1WI 未强化区域)、周围结构侵犯(浸润邻近的肌肉软组织、骨及皮下间隙)及淋巴结有无扩散(颈部淋巴结坏死或短轴直径>10 mm)。上述图像分析由分别具有10 年和8 年工作经验的2 名放射科主治医师共同判定。如果意见有分歧,则由另1名高级职称医师对其进行评判。
1.4 图像分割与特征提取
通过统一标准的图像存档与通信系统(picture archiving and communication system, PACS)将患者的术前MRI图像以DICOM 格式导出,由2名有经验的放射科诊断医师使用ITK-SNAP软件(http://www.itksnap.org/pmwiki/pmwiki.php?n=Downloads.SNAP3)在轴位FS-T2WI上沿肿瘤边缘手动勾画全层感兴趣区(region of interest,ROI) (图1),然后配准到CE-T1WI和ADC图上。采用华东师范大学上海市磁共振重点实验室开发的FAE软件[11](https://github.com/salan668/FAE)对每例患者每个序列的ROI均提取1316个特征,包括(1)形状特征;(2)一阶直方图特征;(3)二阶纹理特征,包括灰度共生矩阵、灰度相关矩阵、灰度游程长度矩阵、灰度尺寸区域矩阵及邻域灰度差分矩阵特征;(4)高阶特征,对以上形状特征、一阶直方图特征和二阶纹理特征进行对数、指数、梯度、平方、平方根及小波(包括LLL,HLL,LHL,LLH,HHL,HLH,LHH,和HHH)变换。
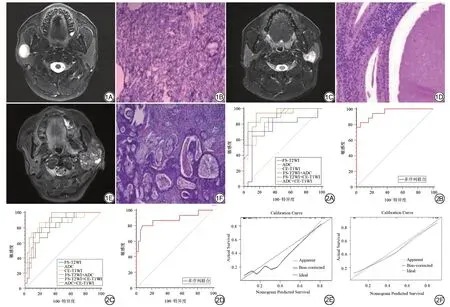
图1 三组腮腺肿瘤示例及相对应的病理证实图片。1A~1B:男,35岁,T2脂肪抑制序列显示右侧腮腺肿瘤,病理证实为多形性腺瘤(HE×40);1C~1D:男,57岁,T2脂肪抑制序列显示左侧腮腺肿瘤,病理证实为Warthin瘤(HE×100);1E~1F:女,48岁,T2脂肪抑制序列显示左侧腮腺肿瘤,病理证实为黏液表皮样癌(HE×40)。 图2 ROC 曲线及校准曲线。2A:单、双序列模型鉴别诊断腮腺良恶性肿瘤的ROC 曲线;2B:多序列联合模型鉴别诊断腮腺良恶性肿瘤的ROC 曲线;2C:单、双序列模型鉴别诊断多形性腺瘤和Warthin 瘤的ROC 曲线;2D:多序列联合模型鉴别诊断多形性腺瘤和Warthin 瘤的ROC 曲线;2E:多序列联合模型鉴别诊断腮腺良恶性肿瘤的校准曲线;2F:多序列联合模型鉴别诊断多形性腺瘤和Warthin瘤的校准曲线。Fig.1 Three groups of parotid tumors and pathological confirmation pictures corresponding to them.1A-1B:a 35-year-old man with a right parotid tumor on fat saturated T2 weighted imaging(FS-T2WI),the corresponding pathological picture confirmed pleomorphic adenoma(HE×40);1C-1D:a 57-year-old man with a left parotid tumor on FS-T2WI,the corresponding pathological picture confirmed Warthin tumor(HE×100);1E-1F:a 48-year-old woman with a left parotid tumor on FS-T2WI,the corresponding pathological picture confirmed mucoepidermoid carcinoma(HE×40).Fig.2 The ROC curves and the calibration curve.2A:the ROC curves of single sequence and double sequences models in differentiating benign from malignant tumor of parotid gland;2B:the ROC curve of multi-sequence joint model in differentiating benign from malignant tumor of parotid gland;2C:the ROC curves of single sequence and double sequences models in differentiating pleomorphic adenomas from Warthin tumor;2D:the ROC curve of multi-sequence joint model in differentiating pleomorphic adenomas from Warthin tumor;2E:the calibration curve of multi-sequence joint model for differentiation between parotid benign tumor and malignant tumor;2F:the calibration curve of multi-sequence joint model.
1.5 特征选择与模型构建
首先将所有的特征归一化在[0,1]之间,计算所有特征间的Pearson 相关系数(Pearson correlation coefficient,PCC)值,如果两个特征之间的PCC 值>0.99,则删除其中一个。为了确定模型中要保留的最佳特征数量,采用循环特征消除(recursive feature elimination,RFE)方法进行特征选择,它在重复构建分类模型过程中可消除对分类效果贡献最小的特征。利用筛选的特征建立支持向量机分类模型,验证方式选择5 折交叉验证,应用受试者工作特征(receiver operating characteristic,ROC)曲线评估分类模型的效能,指标包括曲线下面积(area undercurve,AUC)、准确度、敏感度、特异度、阳性预测值(positive predictive value,PPV)和阴性预测值(negative predictive value,NPV)。
1.6 统计学分析
采用SPSS 26.0 软件及R (4.1.0)语言进行统计学分析。首先对计量资料进行正态性检验和方差齐性检验,符合正态分布的计量资料用±s 表示,采用独立样本t检验;不符合正态分布者以中位数±四分位间距表示,采用非参数Mann-WhitneyU检验进行比较。对于分类资料,采用卡方检验进行比较。采用组内相关系数(intra-group correlation coefficient,ICC)评价2 名医师提取特征的一致性。采用Delong检验评估单序列、双序列及多序列联合模型之间的差异。此外,绘制校准曲线评估模型预测概率与实际结果的一致性。P<0.05 为差异有统计学意义。
2 结果
共纳入176例腮腺肿瘤患者,其中,124例为腮腺良性肿瘤患者(64 例多形性腺瘤,60 例Warthin 瘤),52例为腮腺恶性肿瘤患者。52例恶性肿瘤中包括黏液表皮样癌13例,腺泡囊性癌9例,腺泡细胞癌6例,鳞状细胞癌8 例,涎腺导管癌5 例,上皮-肌上皮癌5 例,多形性腺瘤4 例,涎腺分泌性癌1 例,基底细胞腺癌1例。
2.1 临床资料及MRI表现
2.1.1 腮腺良性肿瘤和恶性肿瘤
腮腺良性肿瘤和恶性肿瘤的年龄分布及性别的差异无统计学意义(P>0.05)。与良性肿瘤相比,恶性肿瘤多位于深叶或双叶(P<0.001),边界欠清晰(P<0.001),肿瘤内部信号欠均匀(P=0.003),多发生囊变、坏死(P=0.002)。肿瘤侵犯周围结构或出现淋巴结转移提示恶性肿瘤的可能性较大(P<0.001) (表1)。
2.1.2 腮腺多形性腺瘤和Warthin瘤
腮腺Warthin瘤好发于中老年男性;两组患者肿瘤的解剖位置、边界、T2WI 信号均匀、囊变或坏死、周围组织结构侵犯及淋巴结转移方面的差异不存在统计学意义(P>0.05) (表1)。
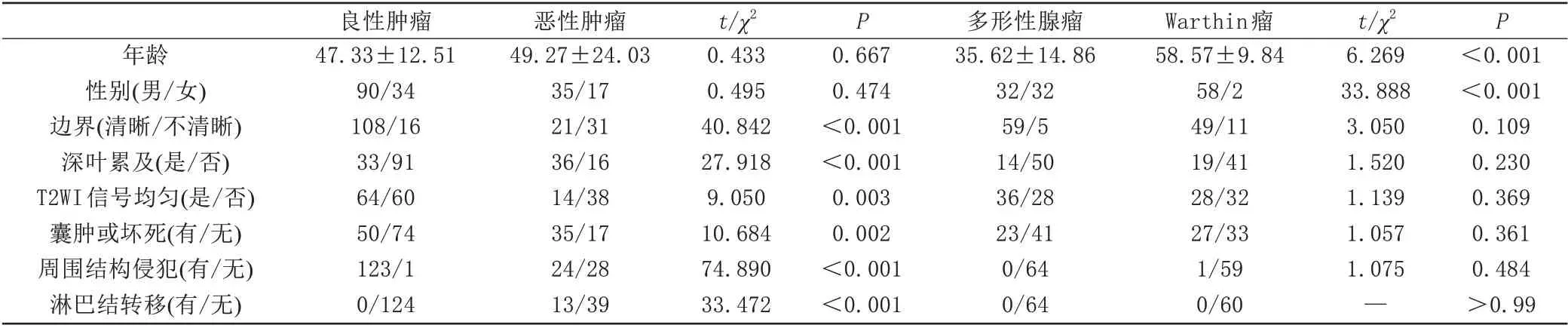
表1 腮腺肿瘤的临床资料及MRI表现比较Tab.1 Comparison of clinical data and MRI characteristics of parotid gland tumors
2.2 影像组学模型的效能评价
2.2.1 一致性评估
2 名医师提取影像组学特征的ICC 范围为0.754~0.923,一致性较好。
2.2.2 腮腺良性肿瘤和恶性肿瘤
按照7∶3 的比例,123 例患者(87 例良性肿瘤,36 例恶性肿瘤)被分到训练集,53 例患者(37 例良性肿瘤,16 例恶性肿瘤)被分到测试集,利用测试集对模型进行验证。基于FS-T2WI、ADC 及CE-TIWI 序列构建7 个影像组学模型鉴别腮腺肿瘤的良恶性,其AUC值如下(图2A):FS-T2WI模型为0.798,ADC模型为0.838,CE-T1WI 模型为0.856,FS-T2WI+ADC 模型为0.815,FS-T2WI+CE-T1WI 模型为0.858,ADC+CE-T1WI模型为0.863,多序列联合模型为0.878,其准确率分别为76.9%、82.7%、86.5%、84.6%、88.5%、75.0%、88.5%。Delong检验揭示了FS-T2WI模型与多序列联合模型、CE-T1WI 模型与多序列联合模型之间差异具有统计学意义(P=0.014、0.023)。多序列联合模型的校准曲线(图2C)显示测试集的拟合曲线在对角线周围小幅度摆动,表示预测值接近实际值,拟合效果较好。
2.2.3 腮腺多形性腺瘤和Warthin瘤
按照7∶3 的比例,87 例患者(45 例多形性腺瘤,42例Warthin瘤)被分到训练集,37例患者(19例多形性腺瘤,18 例Warthin 瘤)被分到测试集。以同样的方法构建7 个影像组学模型鉴别腮腺多形性腺瘤和Warthin 瘤,其AUC 值分别为(图2B):0.724、0.910、0.848、0.887、0.876、0.915、0.954,准确率分别为77.8%、88.9%、75.0%、83.3%、80.6%、88.9%、91.7%。Delong 检验揭示了FS-T2WI 模型与多序列联合模型之间差异具有统计学意义(P=0.021)。多序列联合模型的校准曲线(图2D)显示测试集的拟合曲线与对角线几乎重合,表示预测值接近实际值,拟合效果好。
各个模型的AUC、准确度、敏感度、特异度、NPV及PPV见表2。多序列联合模型中选定的影像组学特征见表3。
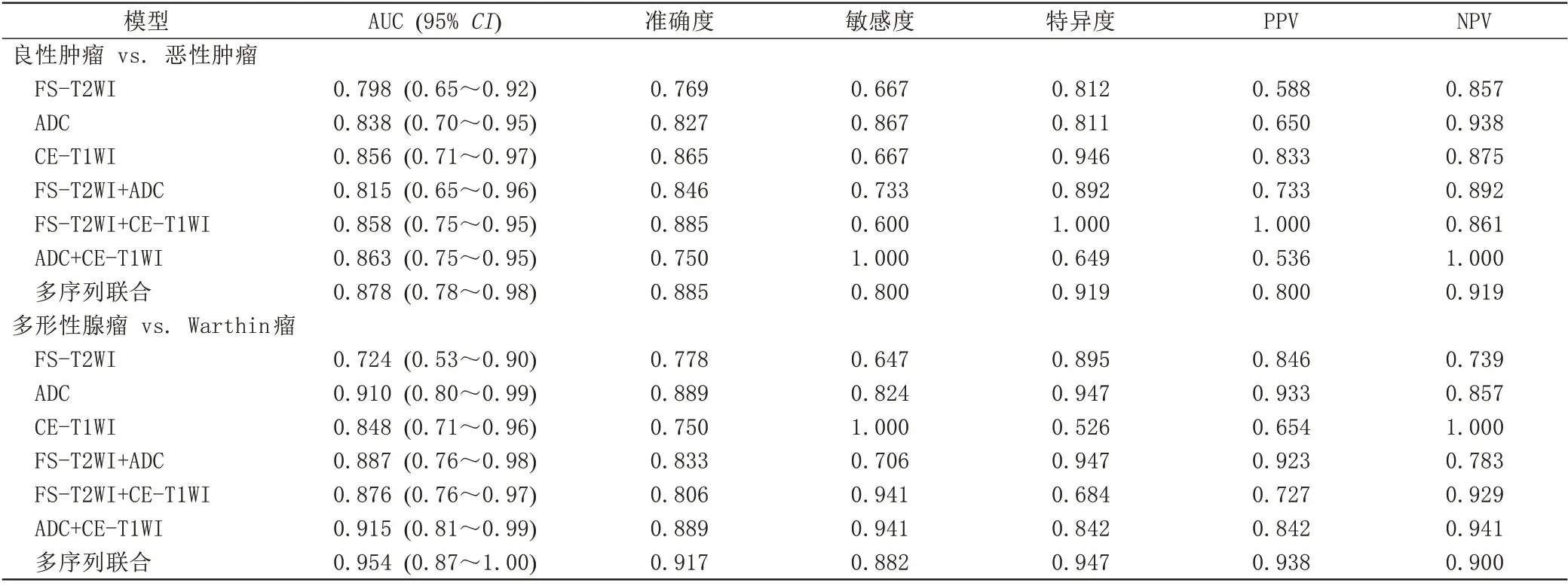
表2 影像组学模型鉴别诊断腮腺肿瘤的效能Tab.2 Diagnostic performance of radiomics models for differentiation parotid gland tumors
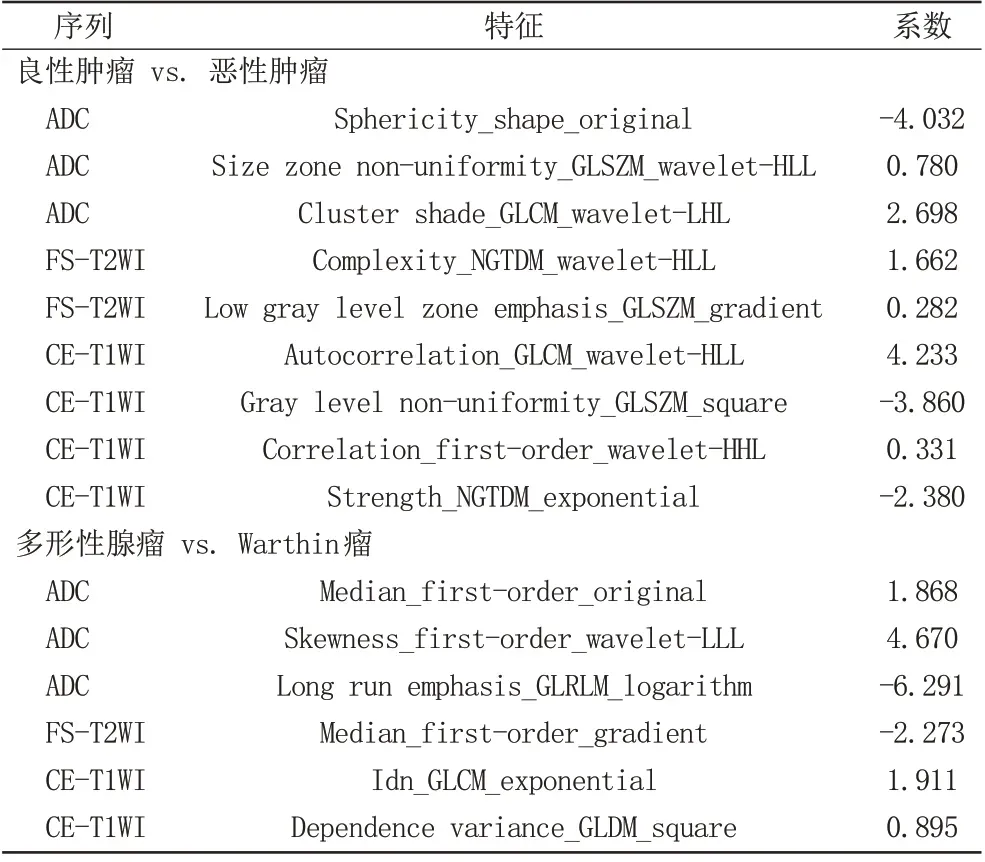
表3 多序列联合模型的影像组学特征Tab.3 Radiomics feature of multi-sequence joint model
3 讨论
本研究基于FS-T2WI、ADC 及CE-T1WI 序列获得不同的影像组学特征,分别构建7个影像组学模型鉴别腮腺肿瘤的良恶性及区分多形性腺瘤和Warthin瘤,旨在提高其术前诊断的准确率。运用测试集对模型进行验证,发现多序列联合模型较单一序列或双序列模型有更高的诊断效能。同时,采用校准曲线来验证模型预测结果与实际结果的吻合情况,结果显示多序列联合模型在腮腺肿瘤鉴别中的准确性较稳定。此外,MR 影像学特征分析发现恶性肿瘤较良性肿瘤相比多位于深叶或双叶,边界欠清晰,囊变、坏死的发生率较高,肿瘤侵犯周围结构或出现淋巴结转移提示恶性肿瘤的可能性较大。
3.1 影像组学相关研究比较
目前,国外已有研究探讨影像组学在鉴别诊断腮腺良恶性肿瘤中应用价值[10,12-13],但国内相对较少。Piludu等[14]基于ADC和T2WI序列构建的影像组学模型在鉴别腮腺良恶性肿瘤方面表现出良好的鉴别效能,并通过外部队列证实。Zheng等[15-16]比较了临床模型,影像组学模型及临床数据结合影像组学模型在鉴别诊断腮腺肿瘤的良恶性及区分多形性腺瘤和Warthin瘤中的效能,结果都显示临床数据结合影像组学模型优于单一模型。上述的研究仅用了单一序列或双序列构建影像组学模型,并且缺少能够直接反映肿瘤血管信息的增强序列。本研究基于FS-T2WI、ADC及CE-T1WI的影像组学特征构建单序列、双序列模型和多序列联合模型,探讨其在鉴别腮腺良恶性肿瘤中的临床应用价值。
3.2 多序列联合影像组学模型的对比分析
有研究证明,多序列联合影像组学模型结合了不同序列的特点,可综合量化评估肿瘤的异质性,具有更高的诊断效能[17-20]。多序列联合模型在胶质瘤基因分型、孤立性纤维瘤/血管外皮细胞瘤与血管瘤型脑膜瘤的鉴别诊断等研究中具有较好的效果[21-22]。本研究结果表明多序列联合影像组学模型能较好地鉴别腮腺肿瘤的良恶性及区分多形性腺瘤和Warthin瘤。CE-T1WI反映了肿瘤区域的血管生成,ADC可提供有关肿瘤细胞结构和密度的信息,FS-T2WI包含了肿瘤的解剖特征及异质性[23-25],三者联合能够更全面地反映腮腺肿瘤的生物学信息。
3.3 单序列和双序列影像组学模型的对比分析
单序列的结果显示基于CE-T1WI 的影像组学模型鉴别腮腺良性肿瘤与恶性肿瘤的效能优于FS-T2WI及ADC,并且在多序列联合模型选择的影像组学特征中,CE-T1WI特征所占比例相对较大,该结果可能与两组肿瘤内部的血管异质性有关,导致在CE-T1WI上的差异较明显,这与Fruehwald-Pallamar 等[26]发现CE-T1WI包含最相关的纹理信息,可用于区分腮腺良性肿瘤和恶性肿瘤的结果相一致。同时,我们发现CE-T1WI 结合FS-T2WI 或ADC 构建的影像组学模型优于单一序列模型。
在区分腮腺多形性腺瘤和Warthin瘤时,单序列的结果显示基于ADC 的影像组学模型的鉴别效能优于FS-T2WI 和CE-T1WI,一定程度上验证了ADC 值定量分析在二者鉴别诊断中的应用[10,27]。多形性腺瘤含有丰富的黏液样和软骨样组织间质,细胞外间隙较大,水分子扩散不明显,而Warthin 瘤淋巴细胞增生,细胞排列紧密,水分子扩散明显受限,导致其在ADC 上有着较大异质性[28-29]。另外,FS-T2WI 或CE-T1WI结合ADC构建的影像组学模型一定程度上提高了单序列模型的效能,这与以往的研究相符[17,30]。
3.4 局限性
本研究存在以下不足:(1)这是一项单中心的回顾性研究,可能会存在选择偏倚;(2)恶性肿瘤的样本量相对较少,且病理类型较多,可能影响结果的准确性;(3)本研究仅纳入FS-T2WI、ADC 及CE-T1WI 序列的数据进行分析,在后期的研究中会补充收集T1WI 及T2WI序列对研究结果进行验证。
综上所述,基于FS-T2WI、ADC 及CE-T1WI 序列构建的多序列联合影像组学模型能够更全面、客观、准确地鉴别腮腺肿瘤的良恶性及区分多形性腺瘤和Warthin 瘤,从而辅助临床医生制订手术治疗方案,判断预后。
作者利益冲突声明:全体作者均声明无利益冲突。