鸡血藤药渣对废水中Cu2+的吸附行为
曹阳,杨燕,刘若琪,曹衬衬,李凤,李艾莲,徐小逊,2*
(1.四川农业大学环境学院,成都 611130;2.四川省土壤环境保护重点实验室,成都 611130)
随着我国工业的快速发展,大量含重金属的废水也随之产生。黄铜制造、皮革鞣制和石油冶炼等行业排放的废水中含有大量的铜(Cu),会对水环境造成不利影响,其通过食物链进入人体,还会导致严重的健康问题[1]。过量的Cu对人体具有毒害作用,会造成脑损伤以及肝脏损害,甚至诱发抑郁症和癌症等[2]。因此,寻求一种合理有效的方式处理废水中的Cu 显得尤为重要。
常见的废水中Cu 的去除方法主要有吸附法、化学沉淀法、电化学法、膜过滤法等。其中,吸附法具有操作简单、效率高、适应性广等特点,被认为是去除有毒废水的最佳技术[3]。吸附法的核心是吸附材料的选择,然而,目前所使用的吸附剂存在价格高昂、易二次污染等问题。因此,筛选环保、经济、高效的吸附剂非常必要。
近年来,一些农林废弃物,如橘子皮、废茶叶、稻壳等,因来源广泛、生态友好、廉价易得等优点而被认为是去除Cu的高效生物吸附剂[4]。然而,这些材料往往存在机械强度不足、去除效率有限等问题[5]。相比之下,中草药在提取有效成分的蒸煮过程中已经过水、酸、碱或醇的浸泡,所剩下的固体成分具备较强的机械强度和化学稳定性[6]。据报道,我国中药渣的排放量每年达3 000万t,而其除了少部分被用来栽培食用菌、作为饲料或制备有机肥以外,大部分被随意丢弃,污染环境的同时又造成资源的极度浪费[7]。中药渣中富含大量高分子化合物,如单宁、木质素、纤维素、多糖等[7],这些化合物表面的官能团(羟基、氨基、醚等)能通过络合、螯合作用与重金属离子结合[8]。目前,已有学者使用麻黄药渣、甘草药渣和板蓝根药渣等去除废水中的重金属和染料,均获得良好的吸附效果[9-11]。因此,进一步挖掘广泛的中药渣资源有利于拓宽生物吸附剂的选择范围。
鸡血藤(Spatholobus suberectusDunn.,SSD)是我国重要的药用植物资源,广泛分布于广东、广西和云南等地。据报道,SSD 中含有大量的原花青素(3.99%~8.63%)[12],这种多酚聚合物能够有效结合重金属离子。LEE等[13]从SSD中分离出1个黄酮、3个异黄酮、5个黄烷酮、2个黄酮醇和1个查尔酮,这些结构中的邻苯二羟基可与重金属离子发生离子交换反应和络合反应[14]。然而,利用SSD作为吸附剂吸附废水中Cu的研究还鲜见报道。因此,本研究拟用SSD作为吸附剂,通过吸附性能和吸附机理分析,探讨其对废水中Cu的吸附可行性,以期为废水中Cu的去除和中药渣废弃物的资源化利用提供环境友好的方案。
1 材料与方法
1.1 吸附剂制备
供试鸡血藤药渣取自彭州市某制药企业。样品经自来水和蒸馏水洗净,置于烘箱中,调节温度为70 ℃后烘干至恒质量。冷却后粉碎,过65目筛(粒径约为0.23 mm),过筛后的中药渣粉末置于干燥器中储存备用。
1.2 静态吸附实验
称取适量制备好的鸡血藤样品于50 mL 离心管中,加入30 mL 一定浓度的Cu2+溶液,用0.1 mol·L-1的NaOH 或HNO3调节溶液pH,密封后于(25±1)℃恒温振荡箱中以250 r·min-1振荡一定时间后取样,过滤,用原子吸收分光光度计测定滤液中Cu2+的浓度。其中:吸附剂剂量为0.5~8 g·L-1,pH 为1.5~6.0,温度为25~45 ℃,初始离子浓度为50~400 mg·L-1,吸附时间为1~480 min;共存离子为不同浓度(0~20 mg·L-1)的K+、Na+、Ca2+和Mg2+。
上述每组试验重复3 次,若无特别说明,吸附剂剂量为5 g·L-1,pH 为5,温度为25 ℃,初始离子浓度为100 mg·L-1,吸附时间为180 min。
1.3 材料表征方法
采用扫描电子显微镜(SEM,S-4800,Hitachi,日本)和能谱分析仪(EDS,Bruker EDS Quantax,德国)对吸附前后材料的尺寸分布、形貌特征、团聚程度、孔隙大小和元素组成等进行观察。采用傅里叶变换红外光谱仪(FTIR,Spectrum Two,PerkinElmer Inc,美国)分析吸附前后鸡血藤生物吸附剂特征官能团的变化情况。采用pH 漂移法[15]测定吸附剂在零电荷点的pH 值(pHpzc),将0.1 g 吸附剂加入50 mL 0.1 mol·L-1NaCl 溶液(pH 为2~10)中,在200 r·min-1、25 ℃条件下作用24 h。用0.1 mol·L-1HCl 或NaOH 溶液调节初始pH 值,用pH 计(PHS-3C,雷磁)测定最终pH 值,pHpzc是在ΔpH=0时获得。
1.4 数据处理
利用统计软件SPSS 19.0 对数据进行单因素方差分析,利用最小显著极差法(LSD)进行处理间多重比较(P<0.05)。数据绘图使用Origin 9.0软件进行。
Cu2+的吸附去除率R(%)和平衡吸附量Qe(mg·g-1)由公式(1)和公式(2)进行计算。
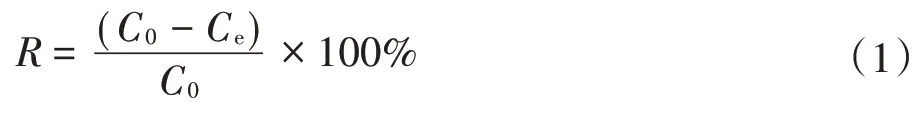
式中:C0和Ce分别为Cu 的初始离子浓度和吸附达到平衡时的浓度,mg·L-1。
和师父在天葬院中一同生活了十年,他竟是第一次见到师父的身体。这个神秘而孤僻的老头,总是一个人关在屋子里,不晒太阳,不散步,除了天葬仪式,他只有在偶尔的黑夜才会走出天葬院。他一天只吃一顿饭,不沾荤腥,还要自己将饭盛好放到他的门口。他一年四季都穿着同一件黑色的羽袍,就连炎炎夏日,也是如此。

式中:V为吸附溶液的体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 吸附剂剂量对吸附效果的影响
吸附剂投加量反映了在初始浓度和体积一定的情况下,参与反应的物质的量,是影响吸附效果的重要因素。Cu2+的去除率随着投加量的增加(0.5~8 g·L-1)而上升(19.74%~63.16%)(图1)。吸附剂剂量的增加代表有效吸附位点和表面积的增加,故Cu2+去除率随投加量的增加而上升。然而,SSD 对Cu2+的吸附量随投加量的增加呈下降趋势,降幅高达79.51%(图1)。这是因为溶液中的吸附质含量是一定的,而吸附剂越多,其相互之间的重叠、聚合作用越大,导致单位吸附剂所吸附的吸附质含量减少,故吸附量降低。WU 等[2]用改性活性炭吸附废水中的Cu2+时也得到类似的结果,随着活性炭吸附剂用量的增加,单位吸附剂对Cu2+的吸附量降低。综合考虑溶液中Cu2+吸附效果和材料的最大吸附量,本研究选择5 g·L-1作为最适吸附剂剂量,此时吸附去除率为52.92%,吸附量为10.58 mg·g-1。

图1 吸附剂剂量对SSD吸附Cu2+的影响Figure 1 Effects of adsorbent dose on Cu2+adsorption by SSD
2.2 溶液pH对吸附效果的影响
当溶液pH 值>6 时,水体中的Cu2+会以沉淀形式存在[16],故本试验在pH 值为1.5~6.0 范围内考察不同pH 条件下SSD 对Cu2+吸附效果的影响(图2)。随着溶液初始pH 值由1.5 升至4,Cu2+的去除率显著提高(P<0.05),从4.94%上升到66.15%;而随着pH 值进一步增加,SSD对Cu2+的去除率逐渐趋于稳定并在pH值为6 时达到最大值68.19%(图2b)。SSD 的pHpzc值为4.76(图2a),表明当pH<4.76时,SSD 表面被质子化从而带正电荷,会与Cu2+产生静电排斥,不利于Cu2+的去除,这是在pH 值较低时Cu2+去除率不高的原因(图2a)。此外,pH 值较低时,溶液中的H+会与Cu2+竞争SSD表面的活性位点。随着pH值的升高,溶液中的H+减少、OH-增多,Cu2+与SSD 表面的斥力降低、引力增强,因而去除率也随之提高[17]。考虑到实际废水的pH值以及吸附效果,选择pH为5进行后续的试验。

图2 零电荷点的pH值(a)和初始pH对SSD吸附Cu2+的影响(b)Figure 2 Plot of zero electric charge(a)and the effect of initial pH on Cu2+adsorption by SSD(b)
2.3 吸附等温线
随着平衡浓度的升高,SSD 对Cu2+的吸附量呈先快速增加后趋于平衡的趋势(图3)。为进一步了解SSD 对Cu2+的吸附特性,采用双参数模型和三参数模型对不同温度下的吸附过程进行拟合(图3),拟合参数见表1。不同温度下SSD 对Cu2+的吸附均符合Sips等温吸附模型,25、35、45 ℃下R2分别为0.97、0.97、0.98,表明吸附特征是Langmuir 模型和Freundlich 模型的结合。在低浓度下,SSD 对Cu2+的吸附由扩散控制,而在高浓度下是具有饱和值的单分子层吸附,MOHAN 等[18]用生物炭吸附废水中的Cr6+时也发现,Sips等温线模型对实验数据的拟合效果最好。

图3 不同温度下SSD对Cu2+的吸附等温曲线Figure 3 The isothermal adsorption curve of Cu2+onto SSD at different temperatures
随着温度的升高,平衡吸附量先增加后降低,在25、35 ℃和45 ℃时理论最大吸附量(Qm)分别为11.72、12.31 mg·g-1和9.55 mg·g-1(表1)。Langmuir 模型中的Qm和Freundlich 模型中的KF是反映吸附剂吸附能力强弱的参数,Qm和KF值越大,吸附能力越强[1]。25 ℃时,Qm和KF均较大,表明室温下SSD 能作为吸附剂有效去除Cu2+,这与文献中的研究结果[16]一致。用Freundlich 模型拟合得到的参数n在1~10 区间,表明SSD 对Cu2+的吸附由多种机制共同控制。钟金魁等[1]用两种玉米秸秆生物炭吸附Cu2+时,Freundlich 方程拟合得到的参数1/n均小于1,表明吸附是多种机制共同作用的结果,与本研究结果类似。表2 比较了不同生物吸附剂对Cu2+的吸附性能,结果表明SSD 对Cu2+的吸附具有一定的优势,可作为吸附剂有效去除废水中的Cu2+。
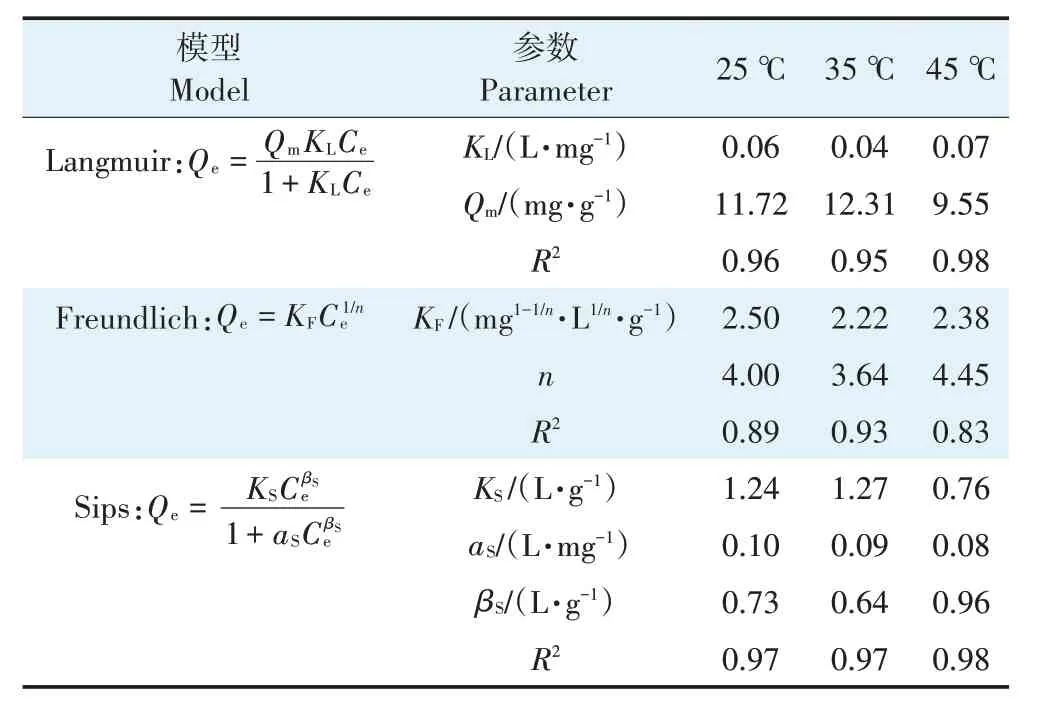
表1 不同温度下SSD对Cu2+的等温吸附参数Table 1 Isothermal adsorption parameters of Cu2+onto SSD at different temperatures

表2 不同吸附剂对Cu2+吸附性能的比较Table 2 Comparison of adsorption capacities of different adsorbents for Cu2+
2.4 吸附动力学
随着时间的延长,SSD 对Cu2+的吸附分为两个过程(图4a)。在0~30 min 阶段,吸附量快速增加(P<0.05),之后随着时间延长到480 min,吸附量增加缓慢并趋于稳定(P>0.05)。吸附量在0~30 min 的快速增加可能是由于在反应初期,有足够多的吸附位点和较大的浓度梯度作为驱动力[23],而随着游离的活性位点逐渐被占据,且固-液界面上的斥力增强,SSD 对Cu2+的吸附越来越困难,吸附量变化不再显著。SSD对Cu2+的最大去除率为58.47%,在反应开始的10 min内,Cu2+的去除率达到54.45%,为最高去除率的93.12%,因此,综合考虑时间成本和吸附能力,SSD吸附Cu2+的最适吸附时间为10~30 min。
动力学参数(表3)和图4b、图4c 进一步表明,SSD 对Cu2+的去除率随时间的变化更符合准二级动力学方程(R2=0.87),且模型得到的理论吸附量(Qe,cal=11.49 mg·g-1)与实际平衡吸附量(Qe,exp=11.82 mg·g-1)更接近,表明吸附过程受化学吸附控制[24],在吸附过程中Cu2+和SSD 发生了化学变化。颗粒内扩散模型拟合结果表明,SSD 对Cu2+的吸附主要经历两个阶段(图4d),在第一阶段,Cu2+很容易克服阻力,通过边界层到达SSD 的外表面,由于表面有大量的活性位点,此阶段吸附速率较大;在第二阶段,Cu2+在外表面吸附饱和后会扩散到吸附剂内部,该阶段扩散阻力明显增大,速率减小,与内扩散速率常数结果(K1>K2)一致(表3)。直线不过原点,表明颗粒内扩散不是反应的唯一限速步骤[25],CHENG 等[26]用颗粒内扩散模型来估计甲基橙吸附过程的实际控速步骤时也得到类似的结果,线性直线不过原点,颗粒内扩散不是唯一的速率控制步骤。这也表明SSD 对Cu2+的吸附过程是多步骤过程,包括颗粒外传质和颗粒内扩散。

表3 SSD对Cu2+的吸附动力学参数Table 3 Adsorption kinetics parameters for the adsorption of Cu2+onto SSD
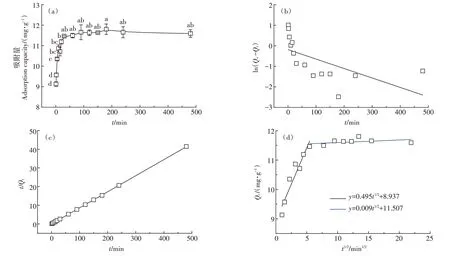
图4 接触时间对SSD吸附Cu2+的影响(a)以及SSD吸附Cu2+的准一级动力学(b)、准二级动力学(c)和颗粒内扩散模型(d)Figure 4 Effects of contact time on Cu2+adsorption by SSD(a),pseudo-first-order(b),pseudo-second-order(c)adsorption kinetics and intraparticle diffusion equation(d)of Cu2+onto SSD
2.5 共存阳离子对吸附效果的影响
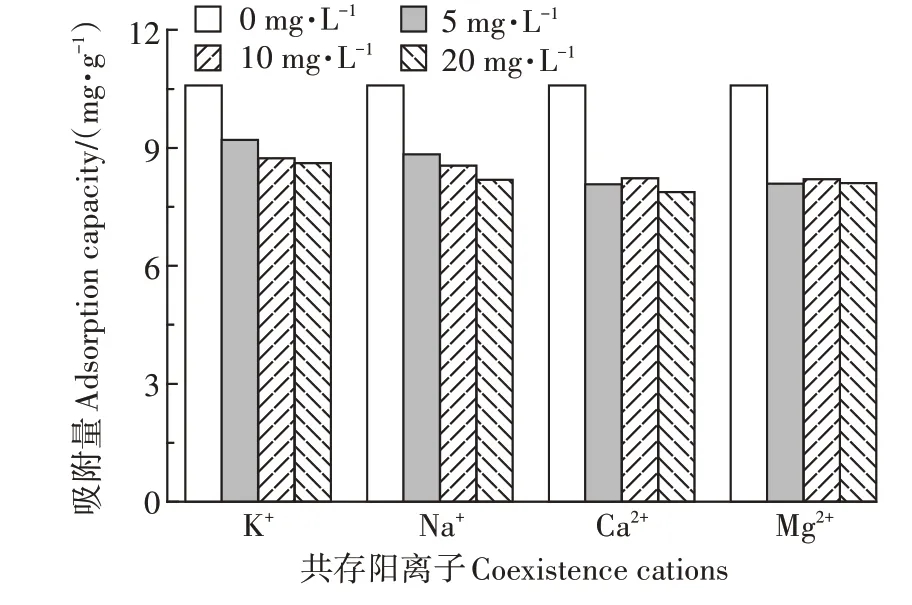
图5 共存阳离子对SSD吸附Cu2+的影响Figure 5 Effects of coexistence cations on Cu2+adsorption by SSD
2.6 鸡血藤去除废水中Cu2+的潜在机制
2.6.1 SEM/EDS分析
对吸附Cu2+前后的SSD 进行了扫描电镜和能谱分析,吸附前SSD 表面比较光滑,吸附后的材料表面粗糙不平,出现很多微小颗粒,推测Cu 被吸附到SSD上(图6a、图6b),EDS图上出现的Cu离子峰(图6c、图6d)也佐证了这一推测。吸附前后SSD的元素组成见表4,吸附前SSD 主要由C 和O(质量分数分别为63.55%、34.76%)组成,同时还存在少量N、Mg、Si 和Ca。吸附后SSD 表面的Ca 和Mg 含量下降,表明在吸附过程中可能发生了Cu2+与Ca2+、Mg2+间的离子交换。

表4 吸附前后鸡血藤化学组成及含量(%)Table 4 Chemical composition and content of SSD before and after adsorption(%)
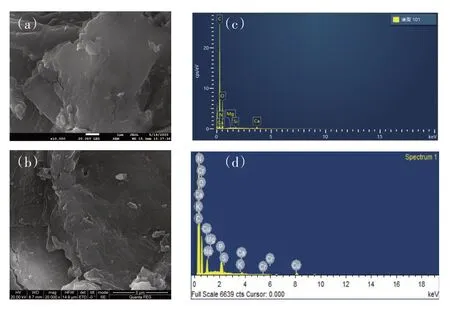
图6 SSD吸附前(a,c)和吸附后(b,d)的SEM和EDS谱图Figure 6 SEM-EDS images of SSD before(a,c)and after(b,d)adsorption
2.6.2 FTIR分析
在500~4 000 cm−1的波数范围内,对SSD 吸附前后Cu2+的红外光谱进行了分析(图7)。吸附前,材料峰出现在3 401 cm-1,属于O—H 和N—H 的伸缩振动。2 917 cm-1处的峰归属于—CH和—CH2中的C—H的伸缩振动[28]。1 732 cm-1处,SSD 出现了一个吸收峰,这归因于羰基CO 的伸缩振动。1 620 cm-1和1 442 cm-1分别对应羧基中的CO 和C—O 吸 收带[29]。1 034 cm-1出现的峰对应于C—O 键的拉伸振动[30]。代表羧基中C—O键、氨基中N—H键以及—OH官能团的峰在吸附Cu2+后发生了位移和强度的变化,表明吸附Cu2+的机制不只是Cu2+与Ca2+、Mg2+发生的离子交换,还包括上述官能团的参与[31],这与吸附等温分析中吸附由多种机制共同控制的结果一致。1 732 cm-1处的峰移至1 738 cm-1,表明该波数代表的官能团(CO)通过SSD 与Cu2+的共用或者交换电子参与吸附过程。代表羧基的峰在吸附Cu2+后向高频移动,表明Cu2+与该官能团的相互作用进一步增强[32]。由此可见,在Cu2+的吸附过程中,多种官能团均参与了吸附过程。
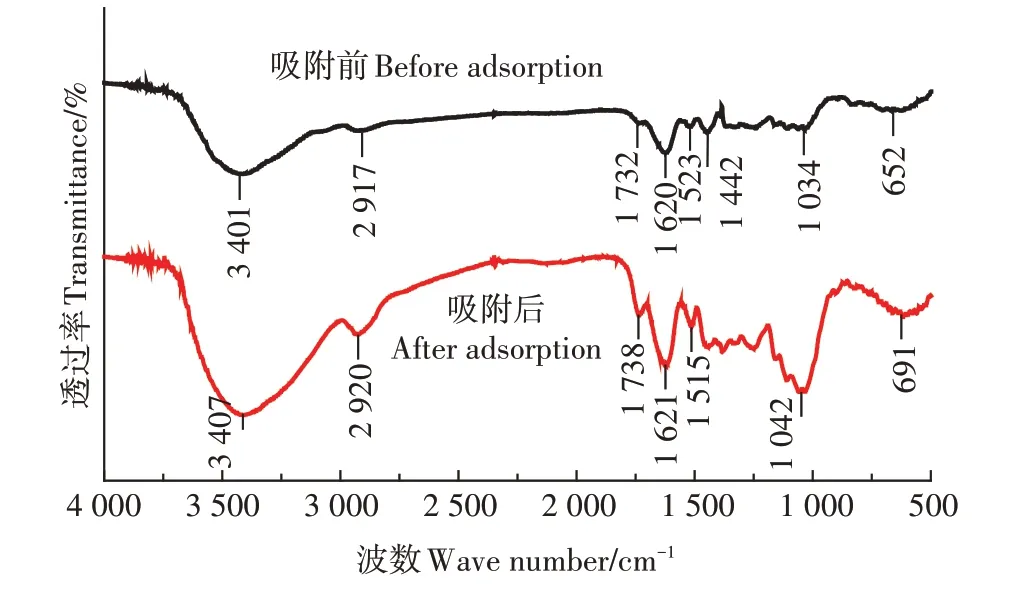
图7 SSD吸附前后的FTIR谱图Figure 7 FTIR spectra image of SSD before and after adsorption
2.7 吸附机理
重金属离子从水体中去除是一个复杂的反应过程,涉及络合、螯合、离子交换、表面吸附等多种机制。LI 等[12]的研究表明鸡血藤中的原花青素含量占3.99%~8.63%,原花青素又称为缩合单宁,结构式如图8a 所示。缩合单宁会与金属离子通过邻苯二酚基团中的邻二羟基发生离子交换作用或络合作用[33],金属阳离子会取代邻二羟基形成甲酸,同时邻苯二酚也是形成稳定金属螯合物所必需的基团[14]。本研究中,带正电荷的Cu2+首先会与SSD 表面的负电荷产生静电吸引,吸附在材料表面的Cu2+会与SSD表面的Ca2+、Mg2+发生离子交换作用(式3、式4),随着反应的进一步进行,Cu2+会与邻二羟基发生离子交换作用或络合作用(图8b、图8c),Cu2+也会与SSD 上的CO 键通过共用或者交换电子的方式参与吸附过程(式5)。

图8 原花青素的结构(a)、Cu2+-邻苯二酚的离子交换反应(b)和Cu2+-邻苯二酚的络合反应(c)Figure 8 The structure of procyanidins(a),Cu2+-catechol group ion exchange(b)and Cu2+-catechol group complexation(c)
3 结论
(1)SSD 能够有效吸附Cu2+。吸附剂剂量、溶液pH 值、反应时间、反应温度及共存阳离子均是影响Cu2+吸附效果的重要因素。Cu2+的去除率随着吸附剂剂量的增加而上升;随pH 值升高,Cu2+去除率呈先升高后平稳的趋势;SSD 对Cu2+的吸附速率较大,在30 min 时吸附达到平衡;共存阳离子会在一定程度上抑制SSD 对Cu2+的吸附,影响强弱表现为Ca2+>Mg2+>Na+>K+。
(2)SSD 对Cu2+的吸附过程符合Sips 等温吸附模型,吸附特征是Langmuir 模型和Freundlich 模型的结合,在低浓度下,SSD 对Cu2+的吸附由扩散过程控制,而在高浓度下是具有饱和值的单分子层吸附,室温下SSD 能作为吸附剂有效去除Cu2+。Cu2+在SSD 上的吸附主要受化学吸附控制,吸附过程涉及两个阶段的扩散机制。
(3)SSD 对Cu2+的去除机理包括离子交换作用、与表面官能团的络合作用以及与材料所带负电荷之间的静电吸引作用。
综上所述,SSD 对废水中Cu2+有较好的吸附去除效果,且其来源广泛、价格低廉,可作为一种良好的生物吸附剂去除废水中的Cu2+,达到以废治废的效果。

